【话险危夷】体外膜肺氧合后行主动脉内球囊泵可降低心源性休克患者死亡率:中国体外生命支持注册数据库分析
时间:2025-10-08 12:13:08 热度:37.1℃ 作者:网络
摘要
背景
主动脉内球囊反搏(IABP)联合动静脉体外膜氧合(VA-ECMO)在心源性休克(CS)患者中的作用尚不明确。本研究旨在探讨VA-ECMO后应用IABP进行左心室(LV)减压对降低CS患者死亡率的影响。
方法
从CSECLS注册库中收集2017年1月至2023年7月期间接受VA-ECMO治疗的5492例连续CS患者数据。主要结局指标为院内死亡率,次要结局指标包括30天死亡率、VA-ECMO存活率及各类并发症。评估VA-ECMO后应用IABP与院内预后的关联性。
结果
在5,492例接受体外膜氧合(VA-ECMO)治疗的患者中(平均年龄54.7±15.1岁,3,917例[71.3%]为男性),832例(15.1%)在VA-ECMO后接受了主动脉内球囊反搏(IABP)治疗。在VA-ECMO之前,VA-ECMO后IABP组的心脏介入(13.9% vs. 16.7%)和心肌梗塞(12.0% vs. 14.8%)发生率更高(均P < 0.05)。该队列中,VA-ECMO后使用IABP组的院内死亡率较低(52.5% vs. 48.0%,P=0.017),VA-ECMO存活率较高(75.4% vs. 79.4%,P=0.014)。多变量模型分析显示,VA-ECMO后使用IABP与降低院内死亡风险相关(调整比值比[aOR],0.823 [95%置信区间[CI],0.686–0.987]; P=0.035)及辅助期间死亡率(aOR=0.828[95%CI,0.688–0.995];P=0.044)。然而,在体外膜氧合(VA-ECMO)后使用主动脉内球囊反搏(IABP)也与并发症发生率增加相关,包括机械性并发症(aOR:1.905,[95% CI,1.278–2.839]; P=0.002)、出血(aOR:1.371,[95% CI, 1.092–1.721]; P=0.007)、肾脏(aOR:1.252,[95% CI, 1.041–1.505];P=0.017)及肺部(aOR:1.768,[95% CI, 1.446–2.163];P<0.001)并发症发生率上升。
结论
在这项多中心回顾性研究中,对接受体外膜氧合(VA-ECMO)治疗的冠状动脉搭桥术后患者使用主动脉内球囊反搏(IABP)可降低院内死亡率。这些发现表明,IABP可能为接受VA-ECMO治疗的冠状动脉搭桥术后患者提供左心室减压优势,但需通过随机对照试验进一步验证,以更全面地评估其风险与获益的平衡。
引言
过去数十年间,静脉动脉体外膜氧合(VA-ECMO)在治疗心源性休克(CS)中的应用日益广泛。然而,心源性休克患者的死亡率仍高达约50%。由于血管血流方向逆转,VA-ECMO会对心脏施加高后负荷,从而对生存率产生负面影响。从生理学角度看,主动脉内球囊反搏(IABP)通过减轻左心室(LV)后负荷来辅助VA-ECMO,这可能增加冠状动脉血流,提供搏动性血液供应以改善循环状态,促进心肌恢复,提高VA-ECMO成功撤机概率,并理论上改善CS患者的生存率。尽管部分研究表明VA-ECMO联合IABP可降低CS患者死亡率,但这些研究中IABP并非专用于VA-ECMO后的左心室减压。VA-ECMO前应用IABP的决策依据与治疗目标不同于左心室减压,由此产生混杂偏倚。因此,VA-ECMO后常规启动IABP进行左心室减压是否对CS患者有益尚不明确。为解决这一不确定性,本研究排除了VA-ECMO前接受IABP治疗的患者,旨在确定VA-ECMO后使用IABP进行左心室减压与CS患者预后之间的关联性。
方法
研究设计与研究对象
我们通过中国体外生命支持(CSECLS)注册库对2017年1月至2023年7月期间接受体外膜氧合(VA-ECMO)治疗的连续病例进行了回顾性评估。该自愿性数据库收集了中国112家以上中心成人及儿童VA-ECMO应用、并发症及预后信息。数据通过该组织网站提交的标准化电子报告表收集。本研究已获首都医科大学北京安贞医院伦理委员会批准(2019040X)。
接受VA-ECMO治疗的冠心病患者筛选流程如图1所示。纳入标准为:(1) 2017年1月至2023年7月期间因冠心病接受VA-ECMO治疗;(2) 年龄大于18岁。符合下列任一标准者予以排除:(1)妊娠期患者;(2)数据缺失者;(3)接受ECMO模式转换者;(4)经中心静脉置管或其他形式左心室减压治疗者;(5)VA-ECMO前已接受主动脉内球囊反搏(IABP)治疗者。

图1 研究流程图
结局指标与定义
主要结局指标为院内死亡率。次要结局指标包括30天死亡率、体外膜氧合(ECMO)存活率(成功脱离ECMO后48小时存活率)及各类并发症,涵盖机械性(包括以下任一情况:膜肺氧合功能障碍、管路破裂、接头开裂、热交换器加热故障、插管问题及血栓形成)、出血性 (包括:胃肠道出血、插管出血、手术相关出血、溶血、血清血红蛋白>50mg/dl及弥散性血管内凝血)、神经系统(包括:脑出血、脑梗死、癫痫发作及脑死亡)、肾脏(包括:肌酐升高及持续性肾替代治疗)、肺部(包括:气胸、 肺出血、感染),代谢性(以下任一项:血糖<40mg/dL、血糖>240mg/dL、pH<7.2、pH>7.6),肢体并发症(以下任一项:远端缺血、坏死、筋膜切开术、截肢、栓塞清除术、腔内剥脱术)。
统计分析
所有统计分析均采用SPSS(版本19.0;SPSS公司,美国伊利诺伊州芝加哥)和R 4.3.2(http://www.R-project.org)软件完成。连续变量以均值±标准差表示,分类变量以频率及比例表示。连续变量采用Student's t检验或Mann-Whitney U检验进行比较,分类变量则采用Fisher's精确检验或Pearson卡方检验。30天生存率采用Kaplan-Meier方法计算,两组间比较采用log-rank检验。P < 0.05视为具有统计学意义。院内死亡率、支持治疗期间死亡率及并发症发生率作为二分类结局指标,采用卡方检验及多变量逻辑回归模型进行比较。多变量模型纳入的协变量包括年龄、性别、体重指数(BMI)、合并症、ECMO前心搏骤停(CA)及血管加压素使用情况。敏感性分析采用逻辑回归模型,在性别、年龄、肥胖状态、ECMO前诊断、pH值、ECMO前CA、血管加压素使用及大型中心(年病例数>30例)等关键亚组中,评估IABP与院内死亡率的关联性。针对pH值、动脉二氧化碳分压(PaCO₂)及动脉氧分压(PaO₂)缺失数据(N=1747),采用链式方程多重插补法处理缺失值。该方法基于数据随机缺失的假设,旨在降低不完整数据引发的潜在偏倚。共生成5个插补数据集,
通过合并结果获得模型参数的有效估计值。同时进行敏感性分析,确保插补与未插补数据结果保持一致(详见补充材料)。鉴于本观察性数据集存在混杂因素,采用以下变量计算倾向评分以降低已知潜在混杂因素的影响:性别、年龄、BMI、既往病史(心脏介入治疗、心肌梗死、高血压、糖尿病、高脂血症、心力衰竭、慢性肾病、肝硬化及吸烟史)、ECMO前心源性休克、ECMO前血管加压素使用情况、ECMO前机械通气情况。基于倾向评分,采用最近邻匹配法将接受VA-ECMO后行IABP治疗的患者与仅接受VA-ECMO治疗的患者进行1:1配对。在倾向评分匹配队列中计算了各协变量的标准化均差。
结果
患者特征
研究队列详见表1。本登记研究共纳入5,492例患者并纳入分析,其中4,660例(84.9%)仅接受体外膜氧合(ECMO)治疗,832例(15.1%)在ECMO后接受主动脉内球囊反搏(IABP)治疗。总队列平均年龄为54.7±15.1岁,男性患者占比71.3%。与仅接受ECMO治疗组相比,ECMO后IABP组患者心脏介入治疗、心肌梗死、肝硬化及吸烟史的发生率更高(P=0.040、P=0.031、P=0.040、P=0.025)。ECMO前诊断分类为:心肌炎9.9%,术后心源性休克9.0%,急性心肌梗死24.4%,慢性心力衰竭0.4%,脓毒症5%,两组间无显著差异。43%的患者在ECMO前出现心源性休克,ECMO后IABP组的心源性休克发生率低于仅ECMO组,但差异无统计学意义(P=0.117)。经倾向性匹配后,ECMO后IABP组与ECMO单用组各832例患者的基线特征均达到良好平衡(所有SMF值均接近0)(补充表1)。ECMO后IABP组使用血管加压素的比例高于ECMO单用组(P=0.005),且使用超过3种血管加压素的情况更为常见(P<0.001)。然而,ECMO后IABP组减少使用血管加压素种类的情况更为常见(10.6% vs. 7.8%,P=0.007)。此外,ECMO前需机械通气的患者比例在ECMO后IABP组更低(P=0.021)。ECMO前乳酸水平:ECMO后IABP组为8.86 ± 7.95 mmol/L,单纯ECMO组为9.11 ± 14.1 mmol/L(P = 0.168)。ECMO期间, ECMO后IABP组4小时及24小时乳酸水平分别为8.51 ± 6.73 mmol/L和4.69 ± 4.98 mmol/L,ECMO单用组则分别为8.47 ± 6.54 mmol/L和5.06 ± 5.39 mmol/L。两组在任何时间点均无显著差异。
表1按IABP分层的VA-ECMO支持患者基线特征

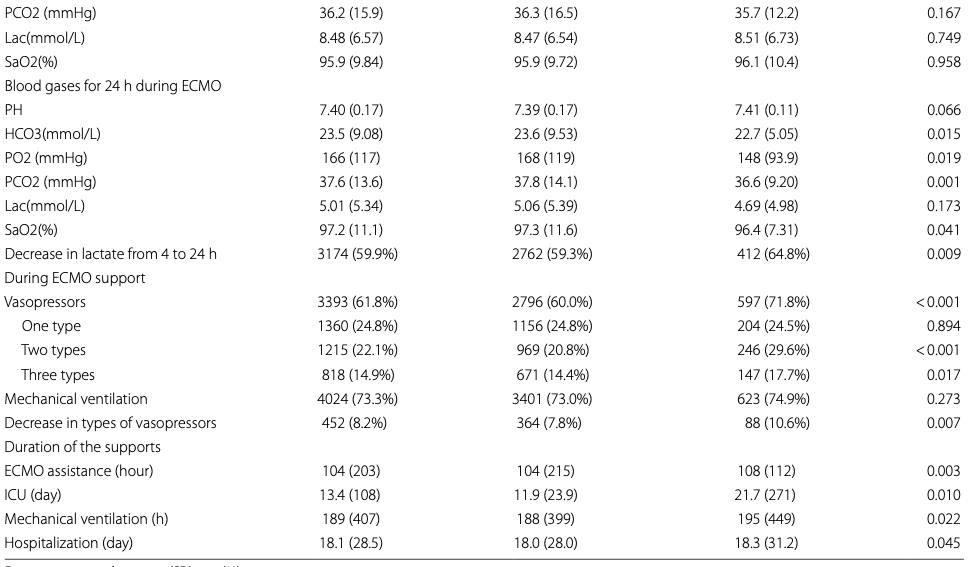
数据以均值(标准差)或例数(百分比)表示。
BMI,体重指数;ECMO,体外膜氧合;SBP,收缩压;DBP,舒张压;MAP,平均动脉压。
主要结局指标
ECMO后行IABP治疗组的院内死亡率低于仅行ECMO治疗组(48.0% vs. 52.5%,P=0.017),且ECMO治疗期间生存率更高(79.4% vs. 75.4%,P=0.014) (表2)。在倾向性匹配队列中,两组同样呈现低死亡率(48.0% vs. 53.6%,P=0.024)及高ECMO存活率(79.4% vs. 74.5%,P=0.020)(表3)。此外,在ECMO植入后4至24小时内乳酸水平下降的患者比例,在ECMO后使用IABP组更高(64.8% vs 59.3%,P=0.009)(表1)。多变量逻辑回归分析显示,ECMO后使用IABP与降低院内死亡风险相关(调整比值比[aOR],0.823 [95% CI, 0.686–0.987]; P=0.035)及支持治疗期间死亡风险降低(aOR=0.828[95%CI,0.688-0.995];P=0.044)(图2)。ECMO后接受IABP治疗的患者30天死亡风险低于仅接受ECMO治疗者,该结果与倾向性评分匹配分析一致(图3)。ECMO后使用IABP与降低院内死亡率的相关性在各临床亚组中保持一致,但并非所有亚组均呈现相同效应。特定群体中观察到显著的死亡率降低,例如:≥65岁患者(aOR=0.73 [95% CI, 0.56–0.95]); P=0.021),BMI<28者(aOR=0.80[95%CI,0.68–0.93];P=0.005),无心肌炎患者(aOR=0.81[95%CI,0.69–0.94]; P = 0.006),PCS(aOR,0.80 [95% CI, 0.69–0.94];P = 0.005),AMI(aOR,0.83 [95% CI, 0.70–0.98]; P=0.032),或脓毒症(aOR=0.85[95%CI,0.73–0.99];P=0.032),使用较少血管加压药(0–1种)(aOR=0.77[95%CI,0.63–0.95]; P=0.015),以及大型医疗中心(aOR=0.77[95%CI,0.63–0.95];P=0.016)。ECMO后使用IABP与亚组定义变量间未见显著交互作用(图4)。这些发现与倾向性匹配队列的结果一致(补充图1)。
表2 两组之间的结果
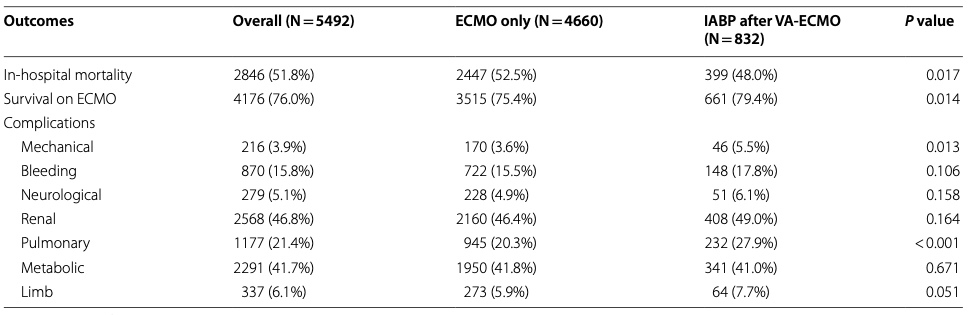
数据以n(%)形式呈现
ECMO,体外膜氧合
表3 PSM队列支持的结果和持续时间
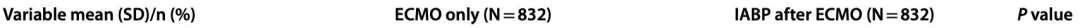

PSM,倾向匹配;体外膜肺氧合
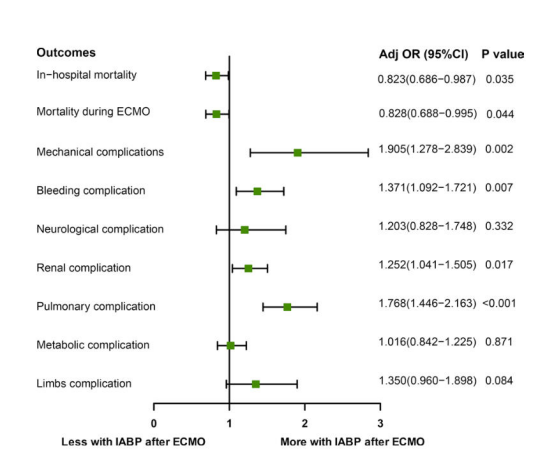
图2 IABP使用与预后之间的关系。
调整因素包括年龄、性别、BMI、合并症、ECMO前心脏骤停及血管加压素使用情况。
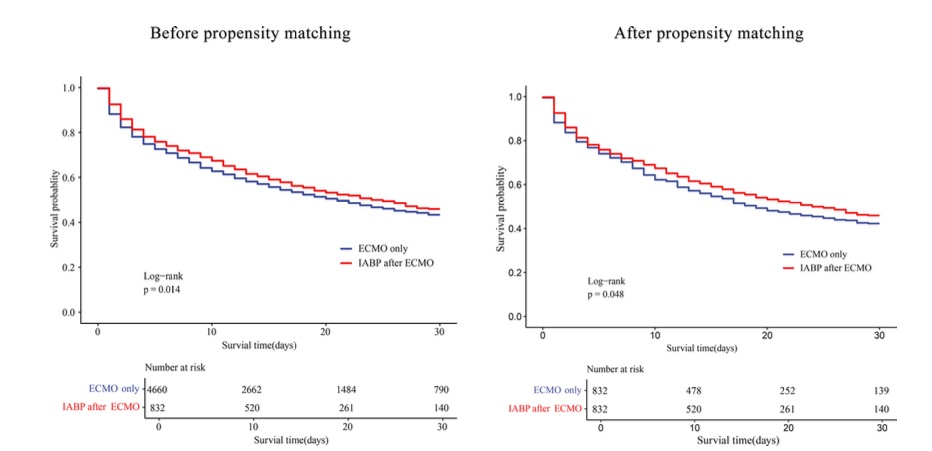
图3 两组之间的生存率曲线
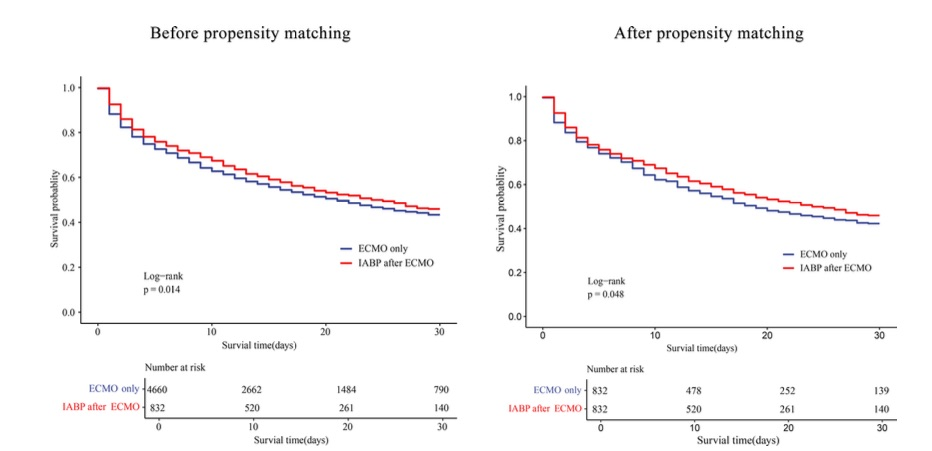
图4 亚组分析探讨体外膜肺氧合后使用主动脉内球囊反搏装置与死亡率之间的关联
其他结局
机械并发症(P = 0.013)和肺部并发症(P < 0.001)在ECMO后使用IABP的组别中更为常见。然而,ECMO后使用IABP与以下风险增加存在关联:机械性并发症(校正比值比,1.905 [95%置信区间,1.278–2.839];P=0.002)、出血性并发症(校正比值比,1.371 [95%置信区间,1.092–1.721]; P=0.007)、肾脏并发症(aOR=1.252 [95% CI, 1.041–1.505]; P=0.017)及肺部并发症(aOR=1.768 [95% CI, 1.446–2.163]; P < 0.001)显著降低(图2)。此外,ECMO后使用IABP组的ECMO辅助时间(P=0.003)、ICU住院时间(P=0.010)、机械通气时间(P=0.022)及总住院时间(P=0.045)均显著长于仅ECMO组(表1)。这些结果在倾向性匹配队列中得到验证,详见表3及补充图2。
讨论
在这项针对接受体外膜氧合(VA-ECMO)支持的心源性休克(CS)患者的大型多中心注册研究中,我们证实:在VA-ECMO支持后联合使用主动脉内球囊反搏(IABP)进行左心室减压,与仅使用VA-ECMO支持相比,显著降低了院内死亡率和支持期间死亡率。VA-ECMO联合IABP可改善循环状态,并可能增强组织灌注——这体现在ECMO后接受IABP治疗的患者中,乳酸水平下降的比例更高,且使用的血管加压素种类更少。然而,ECMO后使用IABP也伴随着并发症发生率的增加。
体外膜氧合(VA-ECMO)为心源性休克(CS)患者提供临时循环支持;然而,其增加的左心室后负荷可能导致左心室扩张,阻碍功能恢复并潜在降低患者生存率。为应对ECMO后左心室扩张,当前左心室减压策略涵盖侵入性与非侵入性方法。在侵入性手段中,主动脉内球囊反搏(IABP)和Impella装置最为常见,其中IABP作为最直接、简便且广泛应用的左心室减压策略。多项研究直接探讨了VA-ECMO联合IABP与院内死亡率的关系,但这些研究常因样本量小、未调整基线特征等局限性而存在偏倚。对ELSO注册数据库的回顾性分析表明,采用IABP及经皮心室辅助装置(pVAD)等策略实施左心室减压可降低院内死亡率。
然而,该研究中多数左心室减压病例是从主动脉内球囊反搏(IABP)或体外辅助装置(pVAD)升级至体外膜氧合(VA-ECMO),且发生于VA-ECMO治疗之前而非之后。一项基于日本全国多中心数据的研究显示,在接受VA-ECMO治疗的心源性休克(CS)患者中,同时使用VA-ECMO和IABP的组别28天死亡率显著降低。但该研究未明确界定IABP的适应症及应用时机。类似地,CSECLS注册数据库分析显示,对心包填塞患者联合应用ECMO与IABP并无降低死亡率的益处,且该研究纳入了IABP升级为VA-ECMO的病例。由于各研究中IABP适应症及应用时机缺乏一致性,加之并非所有研究都明确以左心室减压为目标,IABP是否应常规用于VA-ECMO后左心室减压的问题仍未解决。本研究特意排除了IABP升级至VA-ECMO的病例,并明确了VA-ECMO后通过IABP实现左心室减压与降低院内死亡率之间的关联性。
理论上,IABP可降低左心室前负荷与后负荷,增加每搏输出量及冠状动脉灌注,同时增强外周组织灌注,从而改善患者预后。乳酸水平作为组织灌注与微循环功能的间接标志物,既往研究已强调乳酸及其清除率在评估ECMO治疗心肌梗死疗效中的重要价值。值得注意的是,ECMO支持后乳酸清除率与院内死亡率高度相关,尤其在心脏手术后患者中更为显著。本研究显示,ECMO后联合应用IABP可使更多患者出现乳酸水平下降及血管活性药物用量减少,这理论上可归因于IABP在改善循环状态、恢复重要器官灌注及增强心包填塞综合征患者微循环方面的作用。IABP通过增强组织灌注、改善微循环、降低乳酸水平及减少血管活性药物需求,进一步凸显其在CS患者联合VA-ECMO治疗中的潜在获益。本研究中VA-ECMO后IABP的生存获益可能源于若干关键生理机制:IABP直接降低左心室后负荷并提升心脏效率;其诱导的舒张压升高可增加冠状动脉血流,促进心肌恢复;此外,IABP提供的搏动性血流改善了组织灌注与微循环,从而降低死亡率。
一项系统性综述和荟萃分析指出,接受体外膜氧合(VA-ECMO)治疗的患者中,无论是否同时使用主动脉内球囊反搏(IABP),其神经系统、胃肠道及肢体相关并发症发生率均无显著差异。在IABP-SHOCK II试验中,接受IABP治疗与未接受IABP治疗的急性心肌梗死伴循环衰竭(AMI-CS)患者之间,大出血发生率亦无差异。当VA-ECMO与IABP联合使用时,出血等并发症的发生可能更多取决于VA-ECMO的管理策略。早期研究未发现IABP相关并发症增加,这可能源于分析方法学局限及不良事件检测差异。本研究数据源自中国大型多中心注册库,通过标准化不良事件定义降低偏倚。机械性、出血性、肾脏及肺部并发症亦与IABP使用相关。出血可能源于装置造成的血管损伤,需额外配置动脉装置。肾损伤发生率较高可能与溶血性色素性肾病有关。肺部并发症多见于肺部感染患者,主要与基线状况不良患者存在易感染特征相关。当前,VA-ECMO联合IABP植入的决策较为复杂,启动IABP的关键参数尚未明确界定。左心室减压需求取决于原生右心与左心功能、全身动脉特性及VA-ECMO血流之间的复杂交互作用。此外,不同医疗手段与器械疗法对左心室减压的程度差异显著,其中IABP是中国最常用的左心室减压疗法。本研究发现,VA-ECMO后联合应用IABP可降低死亡率,尤其对老年患者及BMI较低者效果显著。此外,技术实力更强的综合性医疗中心在ECMO后应用IABP时疗效更佳,表明中心特异性因素可能影响干预成功率。这些结果揭示了不同中心实践方式的差异性,强调需进一步探究机构规模、经验积累及技术能力等因素如何影响临床决策与患者预后。尽管VA-ECMO后应用IABP可降低死亡率,但同时伴随更多并发症,这凸显了合理患者选择与严格管理的重要性。未来研究需明确该治疗场景中增减并发症风险的因素,为体外膜氧合后使用IABP的决策提供依据。
局限性
本研究的主要局限在于其观察性设计,该设计本身存在残余混杂因素。尽管通过配对分析努力减轻这些问题,但无法排除所有残余和未测量的混杂因素仍是一个挑战。数据收集的回顾性特征亦可能导致事件记录不完整或缺失。此外,CSECLS注册数据库未收录详细的血管加压剂剂量及血管活性-强心指数(VIS),因此无法直接反映IABP在VIS中的作用。该缺口阻碍了我们直接评估IABP对血管加压剂使用的影响,而这在评估血流动力学支持策略时至关重要。尽管死亡结局数据完整,但部分变量存在缺失值,可能导致研究结果产生偏倚。虽然采用多重插补法处理了1747例患者的pH、PaCO₂和PaO₂缺失数据,但无法完全排除非随机缺失导致的偏倚风险。敏感性分析显示插补对结果无显著影响,但在解读数据不完整的研究发现时仍需谨慎。虽然我们按中心规模进行了分层分析,但不同中心在机构规程、医师专业水平及资源可用性方面的差异可能影响了IABP的使用决策。另一局限在于:虽然排除了ECMO前接受IABP的患者,但IABP植入的具体适应症(无论是用于左心室减压还是常规应用)均由医师决定,且未作明确界定。未来研究应重点确定心源性休克患者启动ECMO后使用IABP的最佳时机。此外,中国注册数据库缺乏出院后随访数据,导致本研究仅能评估住院期间的生存率与预后。因此,后续研究应通过全面的随机对照试验及长期随访评估,阐明IABP联合ECMO治疗心源性休克患者的获益及长期预后影响。
结论
在这项针对心源性休克患者的大型多中心队列研究中,经体外膜氧合(ECMO)治疗后联合使用主动脉内球囊反搏(IABP)可降低死亡率,但并发症发生率高于单纯体外膜氧合治疗。尽管本研究支持对接受体外膜氧合治疗的心源性休克患者采用IABP进行左心室减压,但需通过严格的患者筛选和管理来降低并发症风险。本研究结果与评估体外膜氧合支持下心源性休克患者使用IABP疗效的随机对照试验结论一致。
缩写词
VA-ECMO
静脉-动脉体外膜氧合
CS
心源性休克
IABP
主动脉内球囊反搏泵
CA
心脏骤停
LV
左心室
CSECLS
中国体外生命支持
PCS
心脏术后心源性休克
AMI
急性心肌梗死
BMI
身体质量指数
pVAD
经皮心室辅助装置
VIS
血管活性-正性肌力评分
话险危夷·述评
本文基于中国体外生命支持注册数据库的大样本数据,探讨了VA-ECMO后联合IABP对心源性休克患者预后的影响。研究显示,ECMO后使用IABP可显著降低院内死亡率,尤其在老年、非心肌炎、急性心梗等亚组中获益更明显,提示其在左心室减压和改善组织灌注方面的潜在价值。然而,IABP也伴随机械性、出血、肾脏及肺部并发症的增加,提示临床需权衡利弊。
该研究设计严谨,采用多变量分析与倾向评分匹配以控制混杂因素,结果具有较高可信度。但其观察性本质及缺乏长期随访数据仍是主要局限。未来需通过随机对照试验进一步明确IABP在VA-ECMO支持中的最佳适用人群与管理策略,以实现个体化治疗并优化风险获益比。
原始文献
Wang K, Wang L, Ma J, Xie H, Li C, Hao X, Du Z, Wang H, Hou X. Intra-aortic balloon pump after VA-ECMO reduces mortality in patients with cardiogenic shock: an analysis of the Chinese extracorporeal life support registry. Crit Care. 2024 Nov 29;28(1):394. doi: 10.1186/s13054-024-05129-1. PMID: 39614333; PMCID: PMC11606124.


