有器官移植史的转移性小肠腺癌患者检出dMMR/MSI-H/TMB-H获益免疫联合化疗,实现临床缓解
时间:2025-10-02 12:15:35 热度:37.1℃ 作者:网络
本文报告一例 65 岁女性病例,该患者因 1 型糖尿病接受过肾和胰腺移植,因小肠梗阻就诊,被发现患有低分化小肠腺癌,伴多灶性骨和淋巴结转移。基于血浆的下一代循环肿瘤脱氧核糖核酸(DNA)测序显示错配修复缺陷和异常高的肿瘤突变负荷(TMB),达 1069 个突变/兆碱基(mut/Mb)。鉴于急需临床应答,初始治疗采用细胞毒性化疗(FOLFOX方案;5-氟尿嘧啶、亚叶酸钙和奥沙利铂)。经多学科讨论和共同决策后,在第 3 周期FOLFOX中加用纳武利尤单抗。调整了移植相关免疫抑制治疗,并密切监测胰腺和肾移植功能。使用供体来源的cfDNA(dd-cfDNA)监测潜在的器官排斥反应。未观察到免疫相关不良事件。经过 5 个周期的治疗(其中 3 个周期联合纳武利尤单抗),患者获得了完全的临床、分子和影像学缓解。仅有轻微的同种异体移植物排斥反应证据,无功能障碍迹象。停止治疗,后续的监测影像学检查显示,停止治疗后至少 9 个月持续缓解。本病例强调了在罕见癌症患者中进行基因组检测和针对可靶向分子改变的重要性,以及多学科诊疗的作用。
背 景
小肠腺癌(SBA)是一种相对少见但侵袭性强的恶性肿瘤,其发病率显著上升。转移性疾病患者初始治疗采用多药细胞毒性化疗。尽管可靶向突变罕见,但在二线治疗中,若有可用的靶向药物则为首选。此外,一部分SBA患者有资格接受免疫治疗,包括免疫检查点抑制剂(ICI)。具体而言,ICI可用于携带DNA错配修复缺陷(dMMR)、高度微卫星不稳定(MSI-H)和/或肿瘤突变负荷(TMB)升高的SBA患者。约15%的SBA肿瘤为MMRd/MSI-H,而约 10% 具有高TMB(定义为 ≥10 个突变/兆碱基[mut/Mb])。虽然ICI在未经选择的SBA患者中无效,但在dMMR/MSI-H患者中观察到 40-50% 的缓解率。帕博利珠单抗是一种程序性死亡受体-1(PD-1)抑制剂,基于KEYNOTE-158试验获得了针对TMB ≥10 个突变/兆碱基患者的不限癌种批准,尽管该试验未专门纳入SBA患者。已报道的“超高”TMB(定义为TMB ≥100 个突变/兆碱基)罕见癌症患者在子宫内膜癌、结直肠癌和其他以基因组不稳定为特征的恶性肿瘤中相对富集。这些肿瘤通常为dMMR/MSI-H和/或携带聚合酶编码基因突变,例如DNA聚合酶ϵ(POLE)或δ1(POLD1)。然而,此类超突变病例在SBA中尚未见报道。
免疫治疗(包括ICI)的应用可能因患者的合并症而复杂化,包括自身免疫性疾病和/或实体器官移植。既往存在自身免疫性疾病的患者中,约半数在开始ICI癌症治疗时会出现疾病复发和/或症状进展。同样,实体器官移植患者中近半数在ICI治疗后发生同种异体移植物排斥反应。然而,近期研究已明确可降低并发症风险同时维持ICI疗效的免疫抑制方案。本文报告一例独特病例:一名肾和胰腺移植患者新诊断为转移性低分化小肠腺癌,血TMB异常升高(>1000 个突变/兆碱基),接受抗PD-1免疫治疗并获得成功。本文报告一例独特病例:一名肾和胰腺移植患者新诊断为转移性低分化小肠腺癌,血TMB异常升高(>1000 个突变/兆碱基),接受抗PD-1免疫治疗并获得成功。
病 例
患者女,65 岁,有高血压、高脂血症、1型糖尿病及肾和胰腺移植史,因腹痛和呕吐就诊于急诊科。患者约 15 年前因进行性糖尿病并发症(包括神经病变、视网膜病变、糖尿病昏迷及恶化的肾病伴即将需要透析)接受同期肾和胰腺移植。本次住院前的长期免疫抑制方案包括他克莫司(目标浓度 5–8 μg/L)、麦考酚酸(360 mg每 12 小时一次)和泼尼松(5 mg每日一次)。患者有明确癌症家族史:父亲 60 多岁时诊断为结直肠癌,母亲 40 多岁时诊断为胃癌,哥哥 60 多岁时诊断为肝细胞癌,舅舅 60 多岁时诊断为胰腺癌,姨姨 40 多岁时诊断为乳腺癌。腹部和盆腔计算机断层扫描(CT)增强扫描显示小肠肿块伴肠套叠及肠系膜淋巴结肿大(图1),同时可见弥漫性硬化性骨病变和腹膜后淋巴结肿大。腹膜后淋巴结穿刺活检显示非典型上皮细胞呈巢状及单个细胞排列,罕见腺样分化,符合低分化腺癌(图2)。免疫组化显示细胞角蛋白7(CK7)和尾型同源盒基因2(CDX-2)阳性,该表型高度提示上消化道原发肿瘤。多种其他标志物表达阴性,包括细胞角蛋白20(CK20)、GATA结合蛋白3(GATA-3)、富含AT序列特异性结合蛋白2(SATB2)、配对盒基因8(PAX8)、SRY相关高迁移率族盒转录因子17(SOX17)、突触素、嗜铬粒蛋白、肝细胞石蜡抗原1(HepPar-1)、精氨酸酶及人黑色素瘤黑色45(HMB-45),进一步排除了其他常见原发部位的肿瘤。其诊断最符合转移性低分化小肠腺癌。通过免疫组化评估错配修复(MMR)蛋白[MutL同源物1(MLH1)、MutS同源物2(MSH2)、MutS同源物6(MSH6)和减数分裂后分离增加蛋白2(PMS2)]以及包括下一代测序(NGS)在内的体细胞分子检测,均因组织量不足而未成功。因此进行基于血液的NGS检测,检测结果显示MSH2和MSH6致病性突变、高度微卫星不稳定(MSI-H)状态、异常高的肿瘤突变负荷(TMB)(1069 个突变/兆碱基),以及POLE E1977*变异(平均变异丰度[MAF]为 0.67%)。随后进行胚系检测,未发现致病性遗传性基因突变,因此排除林奇综合征。
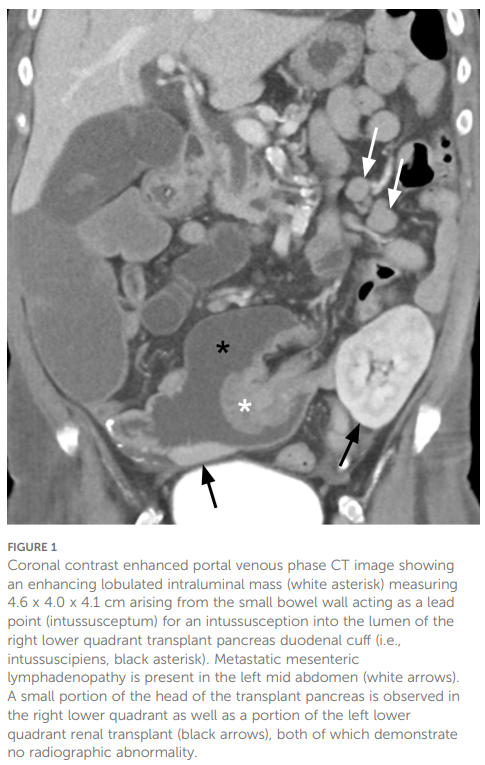
▲图1 冠状位增强门静脉期CT图像显示一个强化的分叶状腔内肿块(白色星号),起源于小肠壁

▲图2 腹膜后淋巴结活检的代表性切片
尽管已行胃减压和保守治疗措施,但小肠梗阻(SBO)持续存在,因此启动住院FOLFOX方案细胞毒性化疗以诱导快速肿瘤减灭。患者接受了两剂FOLFOX治疗,随后出现顺行肠功能恢复迹象,因此出院。与患者、肿瘤内科及移植团队完成了广泛的多学科讨论,讨论围绕患者的错配修复缺陷/高度微卫星不稳定(dMMR/MSI-H)状态和升高的肿瘤突变负荷(TMB),在治疗方案中添加免疫治疗的风险和获益展开。患者表示并不害怕癌症诊断甚至死亡,而是害怕“不能充分享受生活”。对患者而言,反复腹痛和癌症并发症严重降低了生活质量,患者不得不住院。由于多学科团队一致同意进行免疫治疗,遂每 2 周静脉注射纳武利尤单抗 240 mg,与FOLFOX治疗同步。在接受免疫治疗前,通过血液测量供体来源的cfDNA(dd-cfDNA),通过单核苷酸多态性区分供体和患者DNA,以报告患者血液中dd-cfDNA的百分比。患者接受免疫治疗前的基线dd-cfDNA为<0.08%[参考范围:dd-cfDNA ≥1% 与移植排斥风险增加相关]。该检测将作为参考点,以便评估接受抗PD-1免疫治疗后dd-cfDNA(进而评估患者同种异体移植物排斥的潜在风险)可能如何变化。为预期接受免疫治疗,移植团队调整了免疫抑制方案,将他克莫司和麦考酚酸替换为依维莫司(目标浓度 4–6 μg/L)。泼尼松剂量也从每日 5 mg增加至 10 mg。在两周期FOLFOX治疗后,患者接受了 3 个周期FOLFOX联合纳武利尤单抗的化疗联合免疫治疗。在 4 个周期治疗后(包括联合 2 个周期纳武利尤单抗),即约在开始全身治疗后 2 个月,采用NGS进行重复液体活检,提供与基线检测相比的分子缓解评分。该分子缓解评分基于体细胞单核苷酸变异、小插入和缺失变异及基因融合,计算两个时间点的平均变异丰度的比值。检测显示循环肿瘤DNA(ctDNA)减少 100%,且初始MSH2和MSH6突变未检出。此外,在总共 5 个周期治疗后,重复进行的胸部、腹部和盆腔无静脉造影剂计算机断层扫描(CT)显示,先前的小肠套叠消退,相关小肠肿块体积缩小且显影不清,肠系膜和腹膜后淋巴结肿大消退(图3)。尽管可见骨病变硬化程度增加,但随后的正电子发射断层扫描(PET)-CT显示骨骼或其他先前病变部位无代谢活跃性病变证据,因此认为这些改变反映了治疗效应和骨愈合。综合来看,这些数据表明临床、分子和影像学完全缓解。患者治疗、实验室检查和影像学概述见图4。

▲图3 5个周期FOLFOX方案联合3个周期纳武利尤单抗治疗后,随访冠状位非造影CT图像显示小肠肿块和套叠(白色星号)消退,小肠梗阻消退,肠系膜淋巴结肿大消退(白色箭头)

▲图4 治疗时间线和实验室检查结果
鉴于患者获得显著的临床和分子缓解,多学科团队随后与患者围绕进一步癌症针对性治疗的风险和获益展开讨论。为辅助决策,在 5 个周期治疗后进行了重复检测,结果显示dd-cfDNA为 0.81%[参考范围:dd-cfDNA ≥1% 与移植排斥风险增加相关]。尽管dd-cfDNA仍低于制造商设定的 1% 排斥风险增加参考阈值,但与免疫治疗前 <0.08% 的基线相比已有所升高。重复检测后,移植团队决定加强免疫抑制治疗:添加他克莫司(目标浓度 4–6 μg/L),同时将泼尼松减至每日 5 mg,并继续使用依维莫司(目标浓度 4–6 μg/L)。在与患者及其移植团队进一步讨论后,结合亚临床同种异体移植物排斥证据和完全缓解的情况,决定停止进一步的癌症针对性治疗,转而进行密切监测。在停止化疗联合免疫治疗三个月后,再次进行dd-cfDNA检测,结果显示dd-cfDNA降至 0.19%,提示在停止化疗联合免疫治疗的情况下,同种异体移植物排斥风险降低。在最后一剂化疗联合免疫治疗四个月后完成重复PET/CT检查,未发现疾病复发证据。治疗停止四个月后,再次进行NGS检测,结果显示未检测到MSH2和MSH6突变,且高度微卫星不稳定(MSI-H)状态阴性。体细胞变异GNAS Q227H和ESR1 R269C的变异丰度(VAF)均低于 1%。DNMT3A W709*(VAF 0.3%)、GNAS R201H(VAF 0.09%)、NF1 D2346G(VAF 0.2%)和SMO N309S(VAF 0.2%)均被报告为潜在的克隆性造血变异。在本报告发表时(停止全身治疗后 9 个月),患者仍无疾病证据。在此期间,患者恢复了显著的身体机能,已恢复兼职工作,并过着充实的生活。预计将继续进行监测,包括每 3 个月重复PET/CT和NGS液体活检。
讨 论
尽管小肠腺癌(SBA)的罕见性限制了临床认知,但近期研究已开始阐明其肿瘤发生的分子驱动因素,其中部分临床可干预。这些研究还揭示,基因组不稳定性特征(包括错配修复缺陷/高度微卫星不稳定[dMMR/MSI-H]和高肿瘤突变负荷[TMB])在SBA中相对常见。报告的dMMR/MSI-H发生率与结直肠癌和妇科癌症(这些缺陷最常见的癌症)中观察到的发生率相似。这些基因组不稳定性被认为会增加新抗原的表达,而新抗原可被免疫系统识别。不限组织或组织学来源的治疗方案越来越受关注,尤其是在胃肠道恶性肿瘤中。值得注意的是,基于KEYNOTE-016试验结果,帕博利珠单抗于 2017 年首次获得美国食品药品监督管理局(FDA)加速批准,用于治疗dMMR/MSI-H恶性肿瘤。FDA随后于 2023 年授予完全批准。同样靶向PD-1的多塔利单抗基于GARNET试验,于 2021 年获得FDA初始批准用于dMMR/MSI-H患者。两项试验均显示约 40% 的客观缓解率(ORR)。
基于KEYNOTE-158试验结果,帕博利珠单抗也被批准用于高TMB患者。该试验未纳入SBA患者,且高TMB的SBA患者的免疫检查点抑制剂(ICI)应答尚未见报道。然而,部分(约 10%)SBA患者的肿瘤似乎具有高TMB。MMRd/MSI-H恶性肿瘤与高TMB相关。BRCA1/2等DNA修复通路的突变也会导致TMB轻度升高。一项代表性病例报告描述了一名转移性壶腹癌患者,携带BRCA2胚系突变,TMB为 11 个突变/兆碱基,该患者实际上对化疗有显著应答。还有早期研究表明,某些药物可影响MMRd或TMB表达升高。在POLE和POLD1突变患者中观察到更显著的TMB升高。这些基因编码DNA聚合酶,包含聚合酶结构域和外切酶结构域,后者执行校对功能,这对DNA复制过程中维持DNA保真度至关重要。通常发生在外切酶结构域的功能丧失突变会破坏这种校对功能。由此导致的突变累积可导致TMB显著升高(>100 个突变/兆碱基),通常称为超高TMB。此范围内的TMB升高在癌症中罕见——即使在dMMR肠癌中,TMB >100 个突变/兆碱基的通常不到 5%,TMB >500 个突变/兆碱基的不到 1%。
据研究人员所知,本文详述的病例是首例报道的TMB >100 个突变/兆碱基的SBA病例。该患者的SBA在dMMR/MSI-H疾病和POLE变异的情况下,具有异常高的TMB(1069 个突变/兆碱基)。值得注意的是,尽管仅dMMR/MSI-H状态即与高TMB相关,但TMB >100 个突变/兆碱基的情况罕见。这提出了一种可能性,即患者显著的突变负荷是由dMMR/MSI-H和POLE功能丧失共同导致的,正如先前报道的那样。然而,POLE E1977*变异仅在另一例中被报道,且与 182 个突变/兆碱基的TMB相关,尽管其罕见性使其无法归类为致病性变异。事实上,需要大样本队列来验证罕见POLE变异的致病性。此外,该变异并不位于有助于维持基因组完整性的校对(外切酶)结构域内(大多数致病性突变发生于此结构域),且在该患者中检测到的MAF较低,为 0.67%。因此,如此显著升高的突变负荷产生的潜在机制仍不清楚。值得注意的是,尽管基于ctDNA的血液TMB(bTMB)测量与组织来源的TMB(tTMB)呈正相关,但一致性有限,且部分研究估计bTMB可能比tTMB高 2-3 倍。因此,尽管该患者不能归类为超高TMB,但升高的TMB和对ICI的显著应答与其他高TMB患者免疫治疗的报道一致。
器官移植患者是弱势群体,必须平衡适当的免疫抑制水平与感染及其他并发症风险。ICI治疗具有显著的同种异体移植物排斥风险。一项回顾性研究报道,41% 的患者在接受ICI后发生同种异体移植物排斥。相关地,一项纳入 2014-2017 年报告的系统综述报道了因同种异体移植物排斥风险高而反对使用ICI的证据,尽管该综述纳入的患者数量相对较少(20 例患者中 12 例发生同种异体移植物排斥)。
肿瘤学与实体器官移植的交叉领域往往难以处理,因为器官保留所需的免疫抑制与抗癌疗效所需的免疫刺激目标相互冲突。一篇文献综述显示,在接受免疫治疗的实体器官移植患者中,不到三分之一(30.8%)的患者实现了“有效免疫治疗且移植物保留”这一理想结局(43)。因此,肿瘤学家通常对在实体器官移植患者中使用免疫检查点抑制剂(ICI)持谨慎态度,倾向于将免疫治疗留到没有合适替代治疗方案的情况。对于本例患者,研究人员最初也犹豫是否在其全身治疗方案中添加ICI,而是优先选择化疗。然而,由于反复小肠梗阻导致长期住院和生活质量下降,研究人员决策和患者偏好转向支持纳入免疫治疗。这一决定也受到错配修复缺陷/高度微卫星不稳定(MMRd/MSI-H)状态和高肿瘤突变负荷(TMB)检测结果的影响。
一旦决定对实体器官移植患者进行免疫治疗,如何检测移植物排斥的问题便随之产生。肿瘤学和产科学等领域正在开创的一个研究方向涉及循环游离DNA(cfDNA)评估,cfDNA是指凋亡细胞释放到血液中的碎片化细胞外DNA。在移植医学中,供体来源循环游离DNA(dd-cfDNA)利用这一概念测量供体移植物的碎片化DNA,作为器官排斥的早期指标。近期研究越来越多地表明,dd-cfDNA升高与器官排斥相关,其水平升高可预测估算肾小球滤过率(eGFR)下降,以及供体特异性抗体或T细胞介导的排斥风险增加。在实践中,目前尚无触发临床管理改变的dd-cfDNA金标准水平。早期研究表明,dd-cfDNA <1% 提示无活动性排斥,而 >1% 则提示活动性排斥可能性更高。在本病例中,免疫治疗开始前及接受三个周期化疗联合纳武利尤单抗后两个月均测量了dd-cfDNA。两次检测中dd-cfDNA均低于 <1% 的参考阈值,但从 <0.08% 明显升至 0.81%,这导致对患者的免疫抑制方案进行了调整。
由于研究人员预估长期ICI治疗会增加移植物排斥风险,因此采用分子和影像学方法识别初始ICI治疗后的残留病灶。患者完成第四个周期治疗后重复液体活检显示循环肿瘤DNA(ctDNA)持续下降,且MSH2和MSH6突变未检出。研究表明,ctDNA有助于表征肿瘤的分子谱,并可用于筛查早期复发。此外,纵向检测可能有助于筛查克隆变化和治疗耐药风险。此外,基于ctDNA的分子应答评估与无分子应答患者相比,可预测无进展生存期和总生存期改善。值得注意的是,分子研究与多次影像学评估结果一致,提示本例患者达到完全缓解。此外,这种缓解在开始免疫治疗后 2-3 个月内快速实现。因此,考虑到移植物维持的潜在进一步风险,最终决定停止抗癌治疗,转而进行密切监测。目前关于此类患者最佳管理的数据有限,也无正式方案。监测将通过每 3 个月进行一次正电子发射断层扫描-计算机断层扫描(PET/CT)和液体活检下一代测序(NGS)检测完成。截至目前,在初始诊断 11 个多月后,患者仍持续处于完全临床和分子缓解状态。
本文单病例报告结果难以广泛推广到高TMB的小肠腺癌(SBA)患者。此外,本研究缺乏正式的定量分析。尽管讨论的许多概念和临床改变的理由可能具有参考价值,但具体细节未必适用于其他患者。尽管本例患者实现了完全缓解,但积极结局并非必然,其他患者可能面临抗PD-1免疫治疗的显著不良反应和/或免疫治疗无效。此外,研究人员无法进行DNA突变特征分析,而该分析本可明确dMMR/MSI-H和POLE突变对观察到的TMB升高的相对影响。尽管如此,本病例强调了分子检测如何有可能为临床困境中的患者拓展独特治疗选择,尤其是在恶性组织不可用或不足的情况下。未来研究将聚焦于阐明罕见POLE和POLD1突变(如本例所述的POLE E1977*变异)对癌症体细胞超突变的影响。有趣的是,许多似乎导致突变累积的POLE和POLD1突变并不编码外切酶结构域内的DNA。还需要进一步研究制定移植物患者免疫治疗使用指南,并准确评估移植物排斥风险。
结 论
本文报告一例侵袭性、转移性低分化小肠腺癌患者,该患者有反复小肠梗阻发作。液体活检显示,她存在错配修复缺陷、微卫星不稳定和高肿瘤突变负荷(>1000 个突变/兆碱基)。因此,除标准治疗化疗(FOLFOX方案)外,还是抗PD-1免疫治疗的独特候选者。然而,由于对同种异体移植物排斥的担忧,患者的肾和胰腺移植史使这一治疗选择具有风险。尽管患者已启动化疗,但因小肠梗阻导致反复腹痛发作而长期住院,这促使在第 3 个周期添加纳武利尤单抗。尽管关于dd-cfDNA的临床认知仍在发展中,但在此独特情况下,其被用于评估同种异体移植物排斥的潜在风险。经过 5 个周期的全身治疗(2 个周期为FOLFOX方案,3 个周期为FOLFOX联合纳武利尤单抗)后,获得显著应答,并通过该化学免疫治疗方案实现完全缓解。尽管在器官移植情况下使用免疫治疗存在一定风险,但对于高度微卫星不稳定(MSI-H)状态和/或高肿瘤突变负荷的患者,其获益可能特别显著。
参考文献:
Phung QH, Tsai AK, Park BU, Schat R, Spong R, Tsai LJ, Kulkarni AA, Antonarakis ES, Gupta A. Case Report: Metastatic small bowel adenocarcinoma with DNA mismatch repair deficiency in an organ transplant recipient treated with anti-PD-1 immunotherapy. Front Oncol. 2025 Jun 12;15:1579364. doi: 10.3389/fonc.2025.1579364. PMID: 40575172; PMCID: PMC12197958.


