变化万千的脑血管周围间隙(V-R间隙)
时间:2025-09-30 12:15:08 热度:37.1℃ 作者:网络
论坛导读:脑血管周围间隙(Virchow-Robin间隙)是围绕脑部小血管的液性填充腔隙。正常情况下,V-R间隙在MRI上通常不可见,当它扩大到一定程度(直径>0.66mm)后,MRI才能显示。直径<2mm的V-R间隙属正常解剖结构,直径>2mm的被认为是V-R间隙扩大,常见于老年脑、高血压、糖尿病、神经变性性疾病等。EPVS被认为是脑小血管病的一种早期影像学标志,但目前其病理生理机制尚未明确,可能与血管搏动、呼吸运动、睡眠觉醒周期、脑部淋巴系统和水通道蛋白-4有关。越来越多的证据表明,EPVS对认知功能障碍、抑郁症有影响。
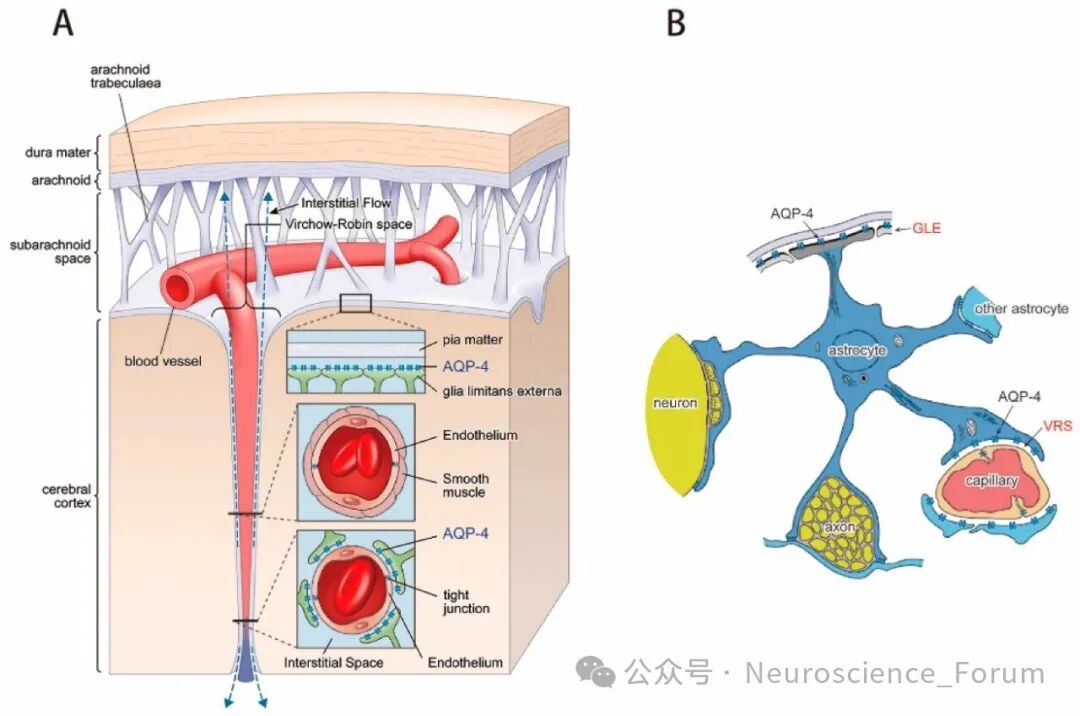
脑血管周围间隙(perivascular spaces,PVS)是指脑小血管从蛛网膜下腔穿过脑实质时围绕在其周围充满液体的间隙。PVS最早是Durand Fardel和Pestalozzi分别在1842年及1849年提出。Rudolf Virchow及Charles Philippe Robin分别在1951年及1959年在病理上进一步证实PVS的存在,故PVS又称为V-R间隙。正常的PVS在CT及MRI上很难辨认,只有当PVS扩大到一定程度才能在MRI上显示。早在1843年,Durant Fardel就提出血管周围间隙扩大(enlarged perivascular spaces,EPVS)的概念。Virchow-Robin间隙(V-R间隙),也称为血管周围间隙,是大脑内正常的解剖结构。它是由软脑膜(大脑表面的一层薄膜)伴随穿通动脉(或小静脉)进入脑实质时形成的潜在性腔隙。这个间隙是脑脊液循环的通道之一,有助于清除脑组织间的代谢废物(即“类淋巴系统”功能),并可能参与免疫调节。PVS的病理生理机制在脑内液体的转运中起着重要作用。驱动液体经过PVS主要有以下因素:血管搏动、呼吸运动、睡眠觉醒周期、脑部淋巴系统和AQP4。正常情况下V-R间隙非常微小,在常规的CT或MRI扫描上不可见。
V-R间隙是脑穿支血管由蛛网膜下腔进入脑实质时,临近软脑膜内陷在小血管周围形成的介于两层软脑膜间的间隙。正常情况下,VRS常常很小,直径约1~2mm,VRS充满组织间液,而不是脑脊液。直径>2mm的VRS被认为是VRS扩大,还见有巨大VRS、海绵状VRS等,直径>15 mm的VRS,通常称为瘤样VRS。 扩大的VRS的特征是边界光滑清楚,呈圆形或线形(由于部位和切面不同)。与穿通动脉的行径相一致。临床往往无明显症状,大多为年龄较大者因脑血管病变或其它脑内病变检查而发现。如老年脑、高血压、糖尿病、脑白质病变、脑部感染、儿童脑发育异常等,表现为原发病变的临床特点。临床表现严重程度与VRS扩大程度及占位效应有关,通常,临床症状可以间接反映VRS的扩大部位。PVS扩大和脑积水形成互为因果关系,PVS扩大在某些情况下也是脑积水形成的原因,脑积水患者组织间液回流不畅可促进PVS扩大。因此,某种程度上脑积水和PVS扩大的形成存在一定联系。4种常见不同类型VR间隙分布于特定区域。

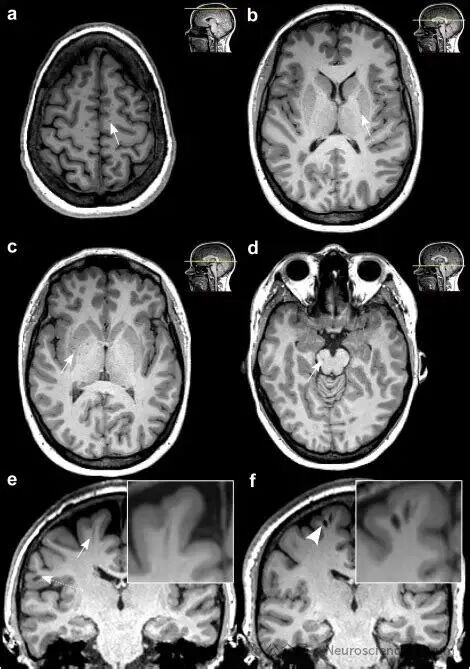
🔹 I型:沿豆纹动脉进入基底节区,多为圆形或卵圆形。位置主要位于豆状核(包括壳核和苍白球)的下部,特别是靠近前连合水平的区域。血管穿通动脉经由前穿质进入大脑。影像特征表现在横断面(轴位)MRI上,表现为点状或线状的T2加权像高信号、T1加权像低信号,与脑脊液信号完全一致。它们通常沿着穿通血管的走行方向排列。此型最为常见。通常被认为是良性表现。但大量的、密集的基底节区EPVS与脑小血管病,特别是与高血压性微血管病密切相关,也可能与轻微的认知功能下降有关。
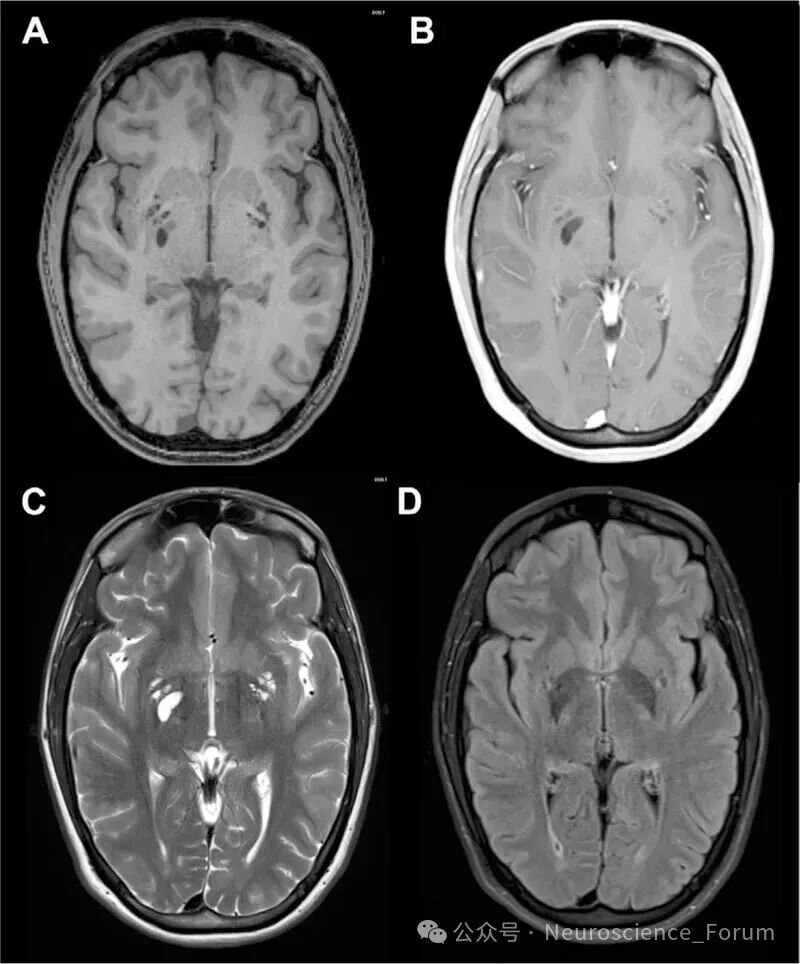
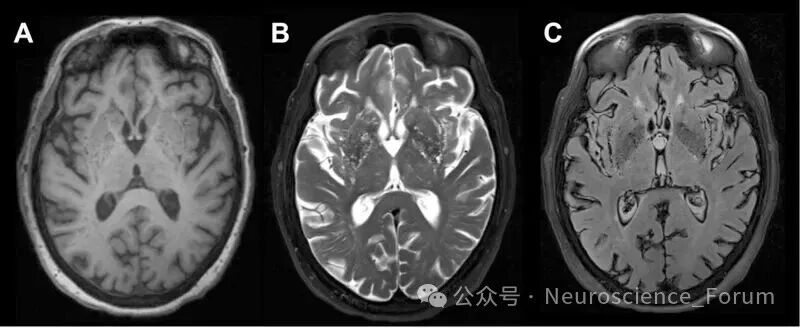
🔹 II型:沿髓质动脉延伸至大脑半球灰质和白质,可呈线状或弯曲状。位置位于大脑半球的深部白质(半卵圆中心)区域。这里的血管是髓质动脉。影像特征通常呈线性或点状,其走向与侧脑室体部垂直。需要与腔隙性脑梗死和扩大的血管周围间隙(本身就是) 鉴别。关键点:EPVS的信号与脑脊液完全相同,且通常不会引起周围的胶质增生(在FLAIR序列上,EPVS中心是低信号,周围没有高信号的“晕环”,而陈旧性腔梗灶周围常有)。临床此型也常见。同样,数量增多、程度加重与脑小血管病有关,尤其是脑淀粉样血管病。研究表明,半卵圆中心的EPVS与年龄相关的认知衰退和阿尔茨海默病风险增加有更显著的相关性。
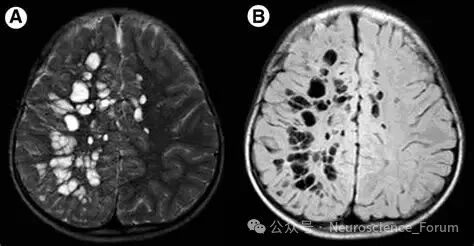
🔹 III型:位于中脑,尤其是大脑脚,此类间隙常较大、形态不规则,易与囊性病变混淆。位置位于中脑(大脑脚)区域。影像特征表现为中脑的圆形或线状脑脊液信号灶。由于中脑导水管的存在,此区域的EPVS扩大有时需要与导水管通畅的正常变异相鉴别。临床此型相对少见。中脑的EPVS扩大有时可能与帕金森病等突触核蛋白病相关,因为该病可能影响脑干的功能。但其临床意义尚不完全明确,通常也视为良性变异。

🔹IV型:丘脑、小脑部位也可存在扩大的血管周围间隙。
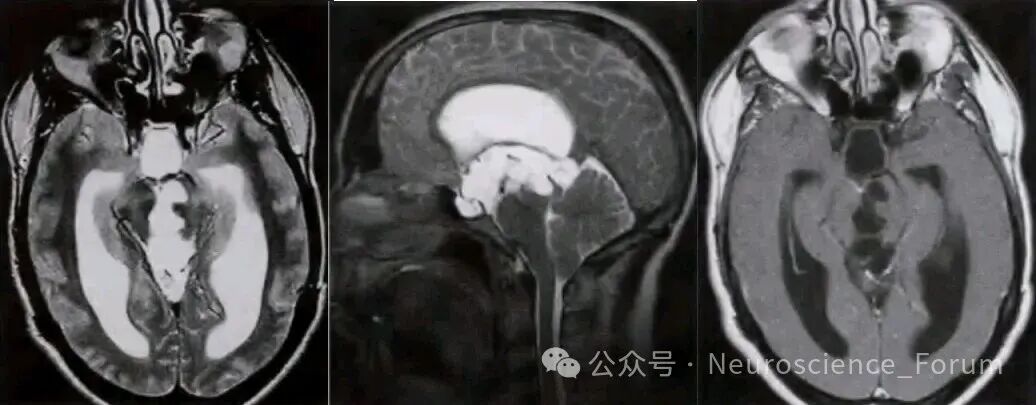
🔹 IV型:位置在岛叶下区(subinsular)及颞叶前内侧区(anteromedial temporal regions),少见类型,易误诊为腔隙性脑梗死。
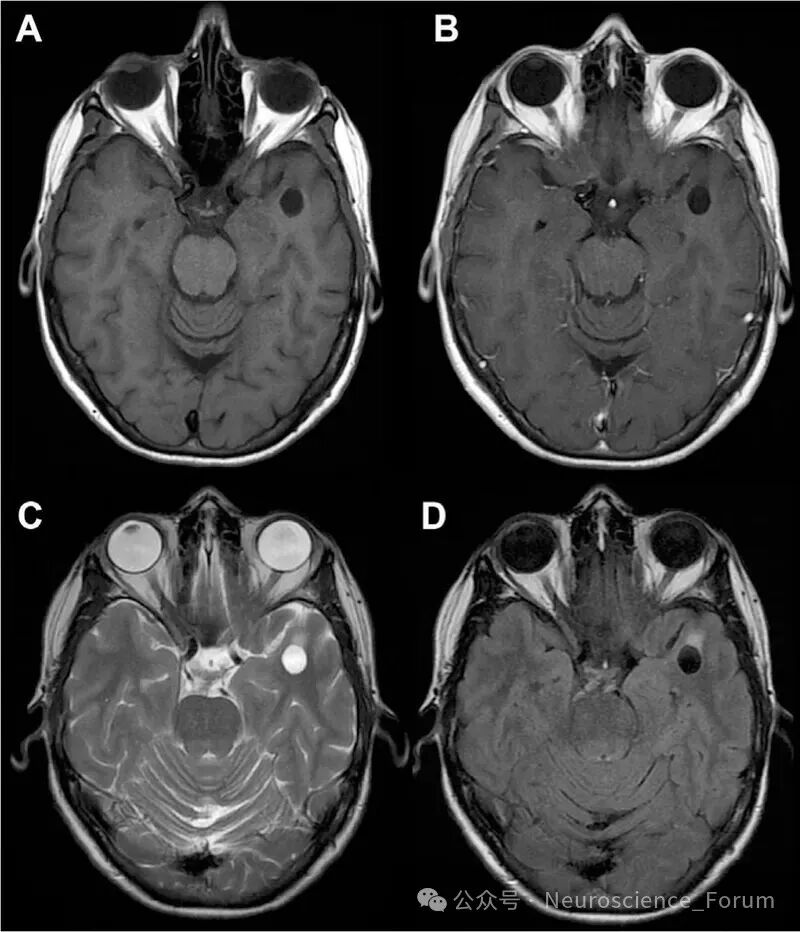
临床和科研中对EPVS的严重程度进行量化分级,最常用的采用视觉半定量方法评估EPVS严重程度,但方法未统一。由于不同位置的EPVS解剖学差异,故不同区域的EPVS评估方法不同。最常用的是Potter评估法,以EPVS负荷较重的一侧大脑半球对基底节区及半卵圆中心进行计数:0分为0个EPVS,1分为1~10个EPVS,2分为11~20个EPVS,3分为21~40个EPVS,4分为 > 40个EPVS;中脑评分:0分为无EPVS,1分为有EPVS。但其未对海马进行评估。对负荷较重的大脑半球基底节区、半卵圆中心、海马中的EPVS也采用了0~4分的评估。对海马EPVS的评级为:1级,< 5个;2级,5~10个;3级,> 10个。通常认为,重度EPVS(3级或4级) 具有更高的临床意义,提示脑小血管病的负荷较重。
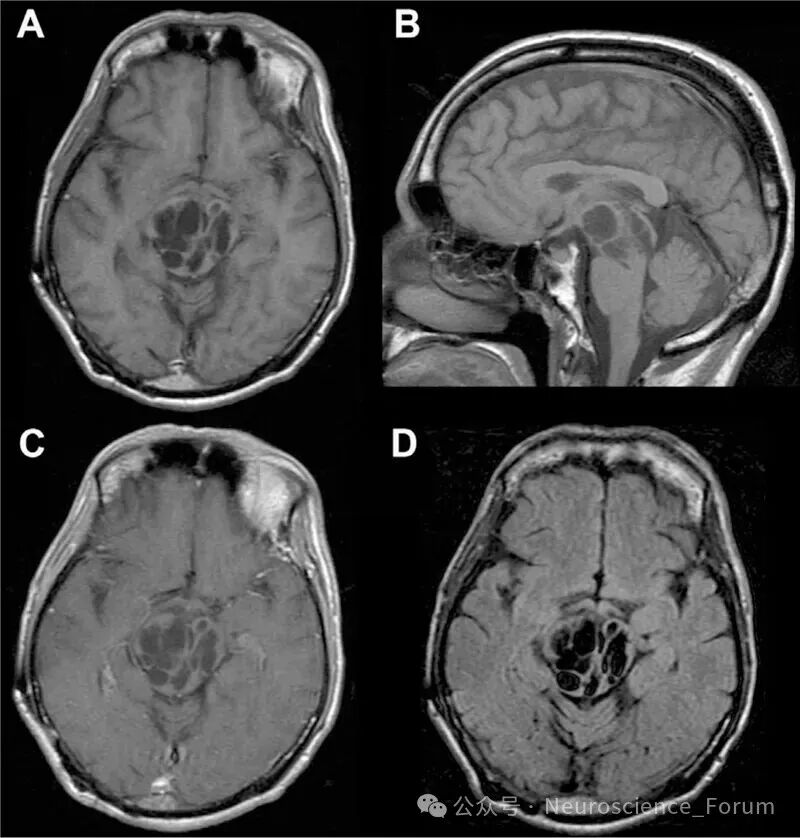
CT常常能显示Ⅰ型和部分Ⅱ型血管周围间隙,而MRI能显示所有类型。血管周围间隙的非典型表现为Ⅱ型血管间隙扩大,呈簇状聚集在一侧大脑半球或其内的某个区域。极少数血管周围间隙可以显著扩大,产生占位效应,呈不规则囊状结构,最常见于Ⅲ型。
在所有MRI序列(T1、T2、FLAIR等)中,信号强度与脑脊液相似,但实际测量时信号略低于脑脊液。DWI(弥散加权成像)上无弥散受限,因VR间隙为相通的腔隙。增强扫描无强化,与周围脑实质信号对比明显。大多数VR间隙无占位效应,但巨大VR间隙(>5毫米)可能压迫周围组织,需与囊性肿瘤等鉴别。目前EPVS形成的病理生理机制复杂,驱动因素包括血管搏动、呼吸运动、睡眠觉醒周期、脑部淋巴系统和AQP4等;其与认知功能障碍、抑郁症相关。最新研究显示PVS改变传统上与心血管危险因素和衰老相关,但也可能在阿尔茨海默病(AD)中起直接作用。EPVS被认为是脑小血管病(CSVD)的一个关键特征,已成为阿尔茨海默病(AD)和其他神经退行性疾病的血管因素的一个有希望的生物标志物。
参考文献
-
Ong JJH, Leow YJ, Qiu B, Tanato P, Zailan FZ, Sandhu GK, Kandiah N. Association of Enlarged Perivascular Spaces With Early Serum and Neuroimaging Biomarkers of Alzheimer Disease Pathology. Neurology. 2025 Sep 23;105(6):e213836. doi: 10.1212/WNL.0000000000213836.
-
Rudie JD, Rauschecker AM, Nabavizadeh SA, Mohan S. Neuroimaging of Dilated Perivascular Spaces: From Benign and Pathologic Causes to Mimics. J Neuroimaging. 2018 Mar;28(2):139-149. doi: 10.1111/jon.12493.
-
Mudalige D, Guan DX, McLeod GA, Smith EE, Ganesh A, Ismail Z. The cross-pal associations between enlarged perivascular spaces and mild behavioral impairment in dementia-free older adults. J Alzheimers Dis. 2025 Sep 12:13872877251372566. doi: 10.1177/13872877251372566.
-
Giraud M, Yun DH, Munting LP, Chung K, Bacskai BJ, Greenberg SM, Frosch MP, Goriely A, van Veluw SJ, Lorthois S. CAA-related enlarged perivascular spaces are associated with abnormal angioarchitecture in human brain tissue: A key role for white matter atrophy? J Cereb Blood Flow Metab. 2025 Sep 8:271678X251369256. doi: 10.1177/0271678X251369256.
-
Leone R, Kobeleva X, Rowe B, Choupan J, Ringman JM, Barisano G. Alterations in MRI-visible perivascular spaces precede dementia diagnosis by 18 years in autosomal dominant Alzheimer's disease. Alzheimers Dement. 2025 Aug;21(8):e70588. doi: 10.1002/alz.70588.


