首次通过Cas9对Rpe65基因的治疗性修正,为治疗先天性失明提供新方法
时间:2019-11-11 17:43:22 热度:37.1℃ 作者:网络
先天性黑蒙症(Leber’s congenital amaurosis,LCA),是发生最早、最严重的遗传性视网膜病变, 出生时或出生后一年内双眼锥杆细胞功能完全丧失,导致婴幼儿先天性盲。先天性黑蒙症占遗传性视网膜病变的5%以上,是导致儿童先天性盲的主要疾病(占10%-20%),多呈常染色体隐性遗传。
在引起先天性黑蒙症的基因中,发生突变最多的是CEP290、GUCY2D、CRB1、RPE65等基因。特别是,约6%的先天性黑蒙症病例是由RPE65基因突变引起的。2017年12月,美国食品药物管理局(FDA)批准了Spark公司AAV基因疗法,这是一种一次性基因疗法,通过AAV病毒载体,将正确的RPE65基因递送到视网膜细胞,用于治疗因双拷贝RPE65基因突变所致视力丧失但保留有足够数量的存活视网膜细胞的儿童和成人患者,恢复和改善视力,该疗法售价高达85万美元/年。
2019年1月,基因编辑大神张锋创立的Editas Medicine公司发表研究称,其开发的编号为EDIT-101的CRISPR/Cas9基因疗法,可恢复Leber先天性黑蒙症10型的视力。2019年7月25 日,Editas Medicine公司和艾尔建(Allergan)联合宣布:正式启动CRISPR疗法AGN-151587 (EDIT-101)的I/II期临床试验。
然而,迄今为止,除了2017年12月获得美国(FDA)批准的Spark公司的AAV基因疗法外,还没有发现针对先天性黑蒙症的实质性治疗或治愈方法。由于这项批准的基因治疗方法不能完全纠正突变序列,且在使用AAV时,AAV的载物量有一定的限制
(约4.8 kb),因此,在基因治疗领域,还存在着有待于更广泛的临床应用的需求。
2019年10月30日,韩国韩东国际大学(Handong Global University)和首尔国立大学医学院的研究人员在Science Advances杂志发表了题为:
CRISPR-Cas9–mediated therapeutic editing of Rpe65 ameliorates the disease phenotypes in a mouse model of Leber congenital amaurosis 的研究论文。
在该研究中,研究人员通过视网膜下注射携带CRISPR-Cas9和供体DNA的AAV病毒在rd12小鼠
(人类先天性黑蒙症模型)
中对Rpe65中疾病相关的无义突变进行了CRISPR-Cas9介导的首次治疗性校正,并改善了视网膜功能,为开发先天性黑蒙症的治疗提供了新的视角。

CRISPR-Cas9技术在短短五年内风靡全球实验室, 成为了生物科学领域最炙手可热的研究工具, 可分别通过同源定向修复(HDR)或非同源末端连接(NHEJ)导致基因插入或突变、删除。虽然HDR的发生频率普遍低于NHEJ,但HDR永久纠正致病突变的能力对于治疗各种遗传疾病具有巨大的潜力。
CRISPR-Cas9介导的Rpe65的体外编辑
为了使用CRISPR-Cas9技术来治疗先天性黑蒙症,研究人员首先使用了来自rd12小鼠的胚胎成纤维细胞(MEFs)来筛选针对Rpe65外显子3的单导RNA (sgRNA)序列,并最终确定了一个优化的sgRNA序列TS4 sgRNA进一步研究,因为它可以在离提前终止密码子最近的位点上产生双链断裂(DSB),并导致高效的插入或删除(indel)率。
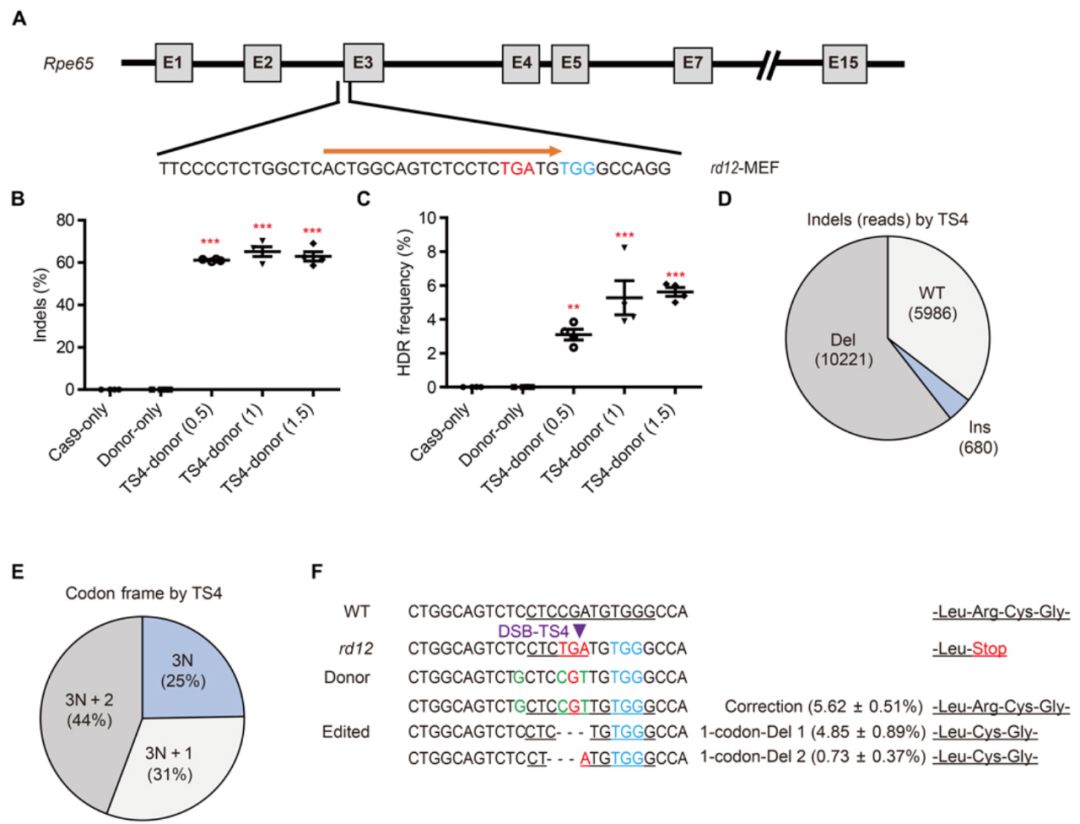
使用双AAV系统对Rpe65进行体内基因组编辑
为了评估CRISPR-Cas9介导的疾病模型中Rpe65无义突变编辑的治疗效果,研究人员更改了TS4中的一个核苷酸以设计TS4 rd12 sgRNA,该序列与rd12小鼠中Rpe65外显子3突变位点的序列完全匹配。将所有必需的编辑组件合并到两个单独的AAV中(AAV-SpCas9和AAV-TS4 rd12 sgRNA-Rpe65-供体,以下称为AAV-TS4 rd12-供体),并使用双AAV系统进行体内递送。研究人员通过改变其浓度来优化AAV组分的比例,以获得最大的基因组编辑结果,研究表明在视网膜下递送比在视网膜递送更有效,并且Cas9与sgRNA的比例对于优化编辑至关重要。
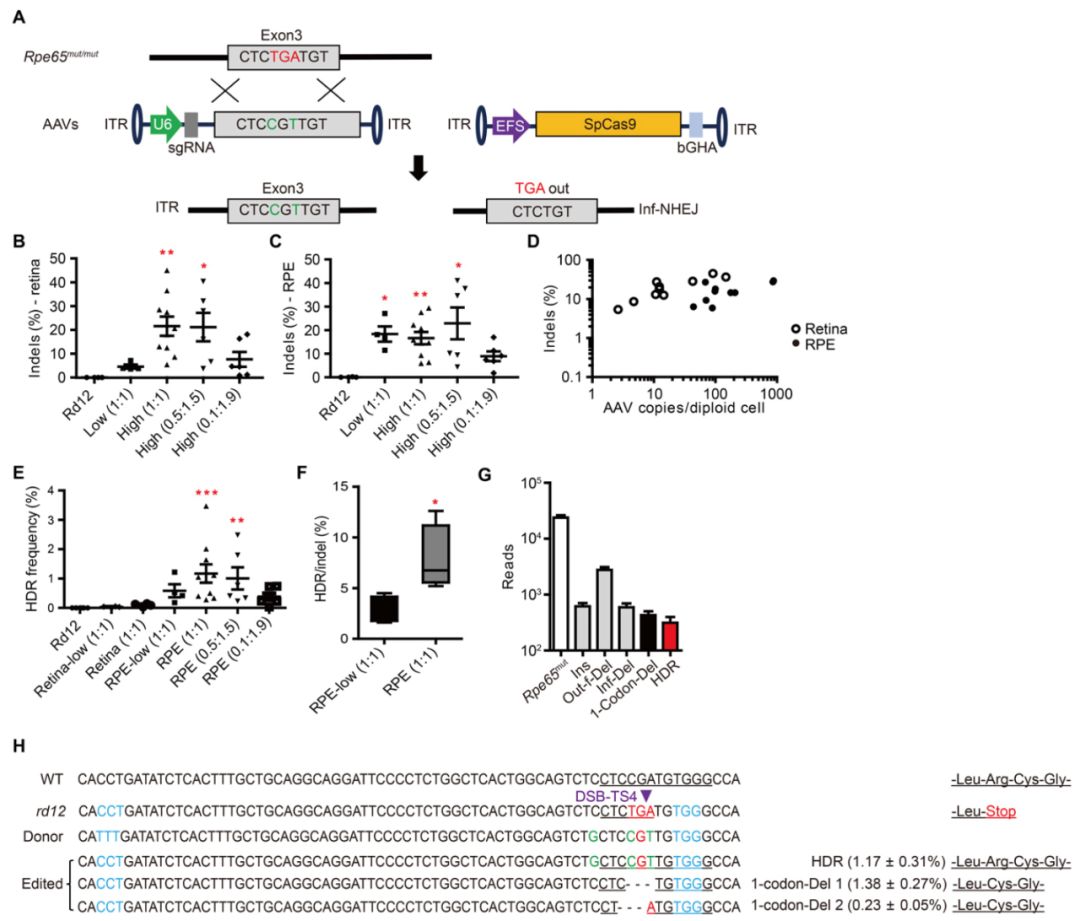
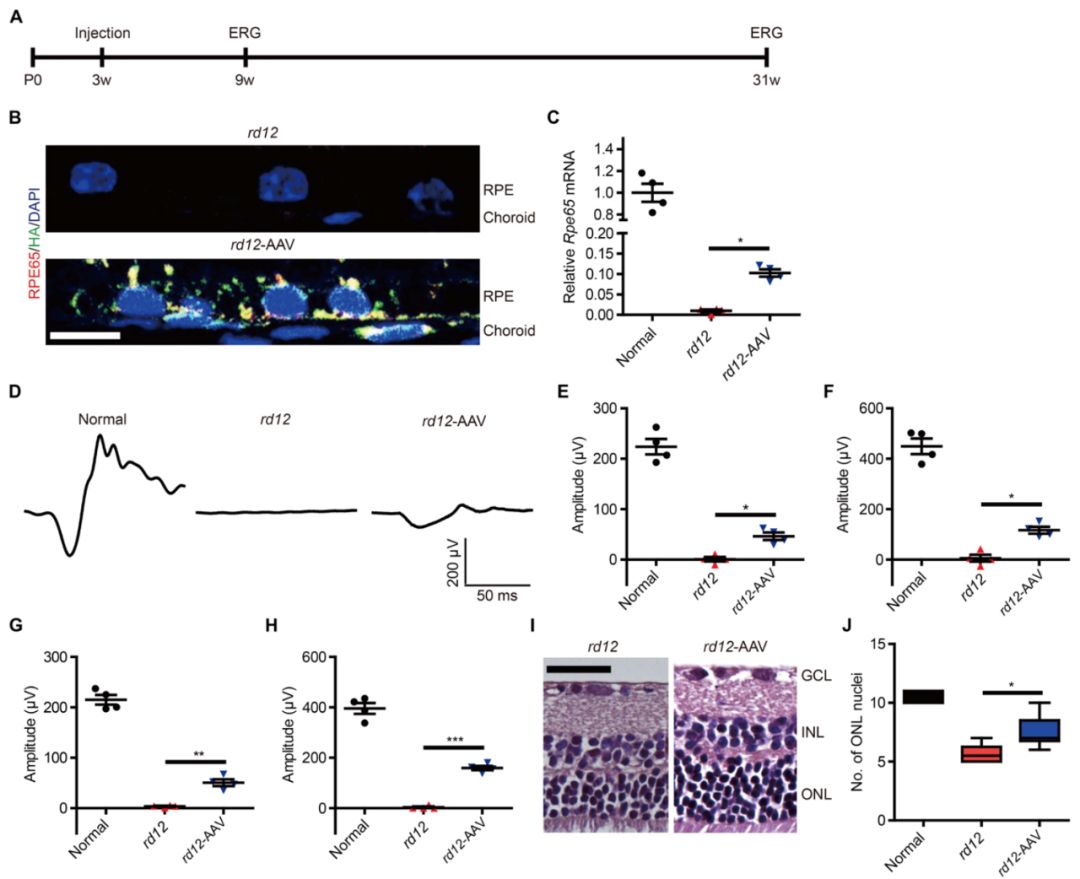
Rpe65校正的rd12小鼠视网膜功能恢复
为了研究HDR介导的Rpe65基因校正对rd12小鼠的治疗效果,研究人员在视网膜下注射AAV后6周和7个月进行黑暗适应后进行了视网膜电图检查。AAV处理导致注射后6周视网膜色素上皮细胞中Rpe65表达的恢复。此外,AAV处理导致注射后7个月视网膜色素上皮细胞中Rpe65基因表达的增加。在视网膜电图中,在视网膜下注射后6周,AAV处理的rd12小鼠在黑暗适应后,对亮刺激(0 dB)产生了明确的响应。初次注射后,电反应可维持7个月,并且视网膜电图a波和b波分别恢复到了野生型小鼠的21.2±4.1%和39.8±3.2%。这些功能恢复伴随着解剖学改变,其中HDR介导的Rpe65基因校正阻止了rd12视网膜外核层神经元细胞的丢失。
Rpe65特异性CRISPR-Cas9的全基因组脱靶分析
为了全局表征TS4 rd12 sgRNA 识别的潜在脱靶位点,研究人员使用rd12小鼠的基因组DNA 进行了Digenome-seq,这是全基因组的无偏脱检测方法。该分析显示了几个潜在的脱靶位点。随后,研究人员使用靶向深度测序验证了前29个Digenome-seq潜在脱靶位点。在rd12小鼠的视网膜中,6个基因组位点被证实是TS4rd12 sgRNA的活性靶点,这些所有活跃的脱靶位点均位于内含子或基因间区域。在随后的脱靶分析中,与TS4 rd12 sgRNA序列相差最多三个核苷酸的所有33个同源位点,在AAV处理的rd12小鼠的预测基因组位点上未观察到有意义的indel突变。此外,在这些小鼠中7个月内没有组织学扰动或肿瘤发生。

总的来说,该研究提供了一种基于CRISPR-Cas9的新方法来治疗先天性黑蒙症。该研究称,以前的报道均未在眼科疾病动物模型中显示体内HDR介导的校正。该研究的永久性基因组编辑治疗方法可以单独使用,也可以与基因治疗或蛋白质治疗一起使用,以治疗先天性黑蒙症。
论文链接:
https://advances.sciencemag.org/content/5/10/eaax1210


