JEADV:特应性皮炎小鼠模型中的微生物失调模拟人类微生物群的变化研究
时间:2022-03-04 10:28:08 热度:37.1℃ 作者:网络

皮肤是我们最大的器官,除了调节体温和水分外,它还保护我们免受不同环境因素的影响,是抵御有害微生物、毒素或其他潜在有害物质的第一道屏障。皮肤有自己的微生物群组成,它与皮肤细胞和免疫系统一起作为屏障防御的功能单位。
在健康条件下,人体皮肤微生物群主要由葡萄球菌、丙酸杆菌和棒状杆菌等细菌和放线菌组成。平衡的皮肤微生物群的破坏通常与皮肤疾病有关,如特应性皮炎(AD),其中金黄色葡萄球菌和其他致病微生物定植在皮肤上,普遍存在于健康的皮肤菌群中。皮肤微生物群的改变在AD中可能有不同的来源。高水平的细胞因子,如IL-4/IL-13,以及IL-33和TSLP抑制了抗菌肽(AMPs)人β防御素-2(HBD-2)和HBD-3的表达,这促进了致病微生物在皮肤上的定居。此外,微生物组组成的变化是由皮肤pH值的增加推动的,这在AD患者中是典型的,这降低了皮肤的抗菌力,并与显著降低相关。
由于特应性皮炎的异质性和复杂性,人们建立了几种小鼠模型来研究该病的不同方面。转基因或基因敲除小鼠被用来确定单个基因或信号通路的生物学相关性。此外,自发发生AD的小鼠有助于了解特定基因组突变在疾病发展中的作用。同样,维生素D、其类似物或恶唑酮诱导的小鼠AD模型已被广泛用于研究疾病进展的机制。钙磷三醇通过与角质形成细胞上表达的维生素D受体结合,诱导TSLP触发的炎症级联反应,特征如下。因此,干扰素-c和肿瘤坏死因子-α在角质形成细胞中的IL-33诱导中起关键作用,引起与人类AD.相当的皮肤炎症反应。但是,这些模型是否也复制了在人类特应性皮炎中观察到的皮肤微生物群移位尚不清楚。因此,我们调查了两种AD模型中诱导的表型改变是否导致了与人类AD相似的微生物区系改变。如果微生物群改变是这项研究的重点,这样的模型将适用于AD的翻译研究。
局部应用钙泊三醇或恶唑酮诱导小鼠AD。在类似AD样皮炎的诱导(包括IgE诱导)之后,对皮肤微生物群落进行了分析,并与人类AD进行了比较。
我们检测到患病皮肤微生物区系组成的关键差异。与钙泊三醇治疗相比,应用恶唑酮导致皮肤微生物区系发生显著变化,细菌丰富度急剧下降。此外,恶唑酮组葡萄球菌尤其是木糖葡萄球菌的扩张与AD关键指标pH、TEWL、IL-4、TSLP和IL-33呈正相关。
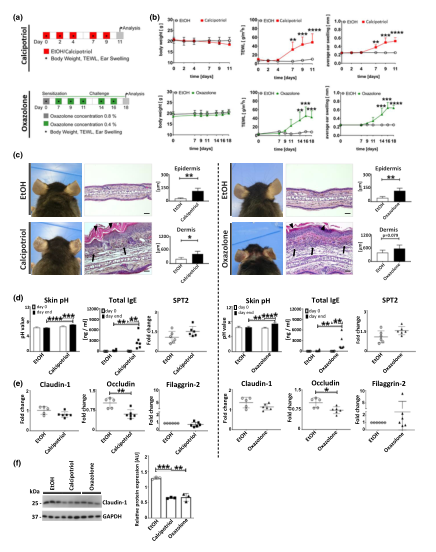
图1 两种AD小鼠模型的表型特征。(A)实验装置:骨化三醇(红色)和恶唑酮(绿色)。Etoh担任车辆控制员。(B)体重(左)、TEWL(中)和耳朵肿胀(右)。(C)钙泊三醇(左)或恶唑酮(右)治疗后小鼠耳朵的视觉表现(左)、组织学(H&E,中)和表皮和真皮的大小(右);箭头,炎症细胞;箭头,角化不全。比例尺=50µm。(D)左、中:皮肤pH值和血清总IgE在第0天和末期(钙泊三醇第11天和恶唑酮第18天),右侧:丝氨酸棕榈酰转移酶(SPT)表达值归一化为GAPDH。(E)分析与GAPDH/b-actin归一化的屏障基因claudin-1、occludin和filaggrin-2的表达水平。(F)对各实验组(n=3,左)的claudin-1进行Western blot,并将条带强度归一化为GAPDH(右)。数据显示至少两个有代表性的实验中的一个,并表示为平均值?SD.N=6/组。(B)具有Bonferroni后测的双向和(d和f)单因素方差分析;(c和e)unpairedt-test.*P<0.05;**P<0.01;***P<0.001;****P<0.0001与Etoh或如上所述。TEWL,经皮失水。
在这篇文章中,我们表明:(A)研究AD的选择模型需要在适用的情况下表征皮肤微生物区系,以及(B)恶唑酮介导的混合Th1-Th2免疫反应触发微生物区系诱导的改变,这与人类AD的生物失调有相似之处,因此如果微生物群的改变是研究的重点,那么它代表了一个适合于AD翻译研究的模型。
文献来源:Amar Y, Schneider E, Köberle M,Microbial dysbiosis in a mouse model of atopic dermatitis mimics shifts in human microbiome and correlates with the key pro-inflammatory cytokines IL-4, IL-33 and TSLP.J Eur Acad Dermatol Venereol 2022 Jan 11;



