Cell:解析HIV病毒最新画像,推动艾滋病疫苗研发
时间:2022-03-04 10:28:07 热度:37.1℃ 作者:网络
艾滋病(AIDS)是一种由人类免疫缺陷病毒(HIV)感染所引起的、危害性极大的传染病,HIV会侵蚀破坏人体免疫系统,进而引发各种相关疾病。直至目前,艾滋病仍没有疫苗和特效药。因此,艾滋病也被称为“不治之症”,一旦染“艾”,则无法转寰,至今全世界也只有寥寥数人被治愈。
据联合国艾滋病规划署数据,2020年全球有约3800万人感染了HIV病毒。而中国国家卫健委指出,中国每年大约新增8万例艾滋病患者,其中青年学生和老年人群体的感染人数更是逐年增加。
由此看来,全世界艾滋病流行形势不容乐观,因此,探究HIV病毒的结构特征并以此开发疫苗和新的治疗途径是十分迫切和重要的。
近日,美国华盛顿大学和Scripps研究所的研究人员在 Cell 期刊发表了题为:Cryo-ETof Env on intact HIV virions reveals structural variation and positioning onthe Gag lattice 的研究论文。
该研究利用结构生物学领域开发的强大工具和技术,发现了有关人类免疫缺陷病毒(HIV)的新细节。这些发现使科学家更加关注病毒表面上下的基本结构,可能有助于设计和开发预防艾滋病的疫苗。

HIV-1病毒表面的包膜糖蛋白(Env)是一种重要的病毒进入蛋白机器,介导与宿主细胞受体的结合和随后的膜融合。Env被翻译为gp160蛋白的前体,三聚体化并裂解为gp120和gp41亚基,这两个亚基分别负责受体的结合和融合。
更重要的是,作为中和抗体的唯一目标,Env对疫苗设计工作也具有独特的重要性。最近对Env结构的深入研究主要来自于对三聚体外域的工程化、截断形式的研究,而其病毒膜环境中的Env结构的细节,包括其相对于其他病毒成分的组织,仍不清楚。
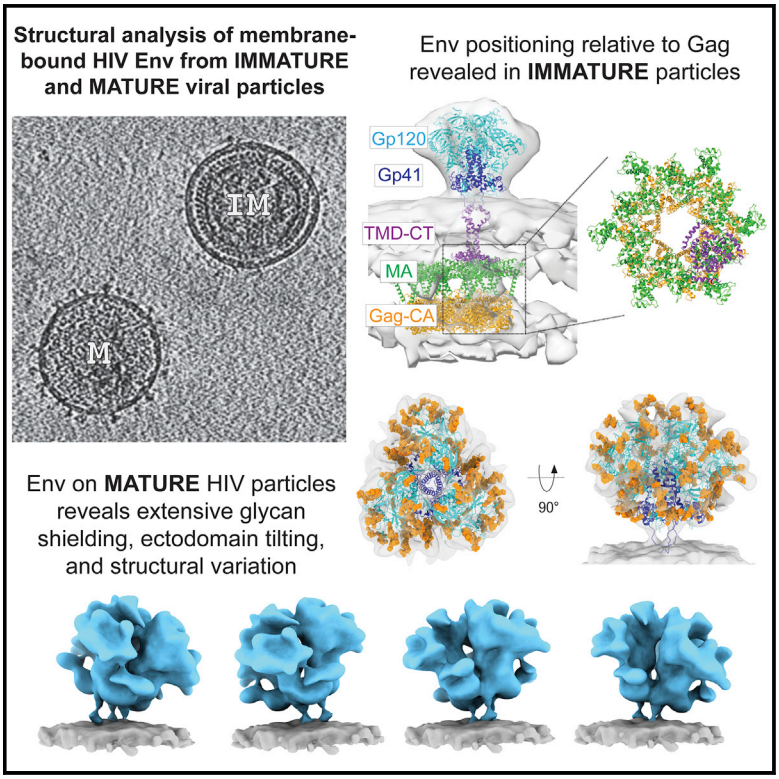
为了了解Env是如何在病毒颗粒上组装的,以及它在结构上与可溶三聚体有何不同,研究团队对未成熟和成熟的带有Gag的HIV-1类病毒样粒子(VLP)上的包膜糖蛋白进行了冷冻电子断层成像(cryo-ET),并进行了亚层析平均和结构质谱分析。

HIV类病毒样粒子(hVLP)的包膜蛋白(Env)的结构分析
这些详细的发现包括和病毒包膜“刺突”蛋白在整个病毒中的位置和3D视图的结构。在另一项关键进展中,科学家们对HIV-1病毒的聚糖屏障(蛋白质上的糖链结构,可以逃避人体免疫系统的攻击)有了新的认识。
该研究的通讯作者、华盛顿大学药学院副教授 Kelly Lee 说道:“我们正在研究整个病毒颗粒,以及表面的蛋白质如何与病毒的其余部分联系起来,通过观察完整的病毒结构,我们可以看到这种‘病毒的脸’的不同侧面是如何显示的,以及它们如何被免疫系统识别或隐藏。”
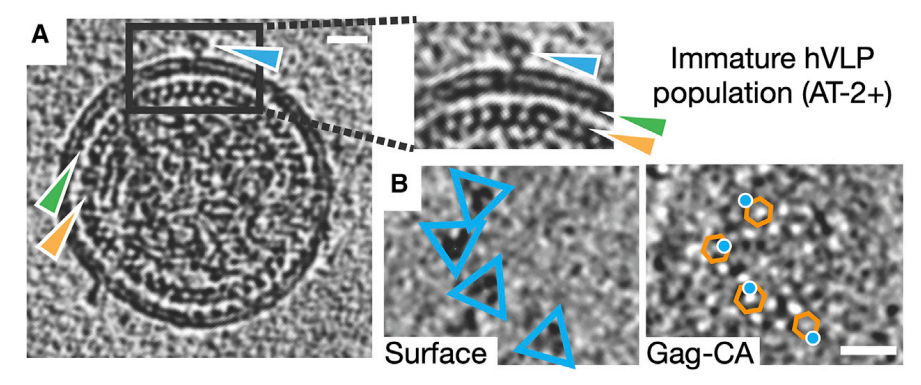
hVLP-Env在未成熟Gag晶格上的定位
这张完整的HIV-1病毒结构画像也让科学家们对包膜刺突蛋白在病毒表面的定位有了新的认识。这一发现推翻了以前关于HIV-1病毒各部分如何组装的模型,有助于研究人员将注意力集中到这两种蛋白质可能对接的相互作用上。这种交互需要进行更详细的解析,但至少当前的工作提供了HIV-1病毒组装的正确架构模型。
另一个以前没有观察到的发现是,支撑包膜蛋白的“柄”是灵活的,可以倾斜,这对免疫系统保护细胞免受感染的中和抗体来说,既是机遇也是挑战。与此同时,这些发现将推动HIV疫苗的设计和开发——当我们越来越清楚目标是什么时,就会激发创新,最终可能会导致疫苗的出现。

hVLP-Env的中心螺旋束(HR1-C)的构象变化
实际上,将HIV病毒的包膜作为疫苗开发的目标是特别困难的,因为这种病毒的刺突蛋白很少,而且用糖分子伪装它们,以逃避人体的免疫系统。所有这些特征增加了HIV刺突蛋白呈现给免疫系统的动态变异性。
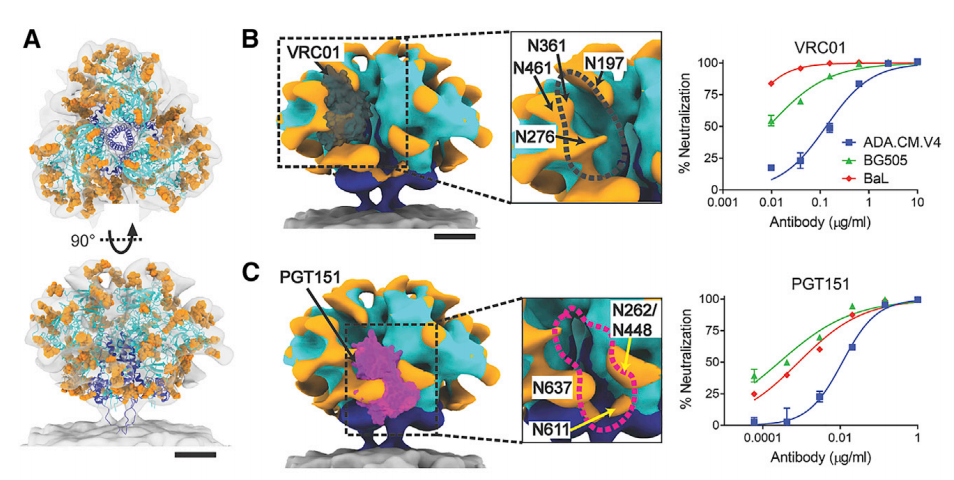
hVLP-Env中存在广泛的聚糖屏蔽
Kelly Lee 表示:“这是HIV疫苗研发人员从一开始就在努力解决的问题——HIV病毒会以极快的速度变异。每次它感染一个新的个体,最终会在这个个体中产生数千种不同的变异,如果在大规模人群中观察,它们会变异出更多。”
事实上,就在今年2月,荷兰发现了一种更致命的HIV病毒(详情:一种更严重、传播更快的HIV突变株已出现)幸运的是,尽管该病毒株是一种“高度致命的新变种”,但它仍然对现有的艾滋病治疗方案有反应。该研究的共同通讯作者 Michael Zwick 表示:“更致命HIV突变株的出现再次提醒我们,HIV病毒总是在变化,所以需要科学家们继续研究”
原始出处:
Vidya Mangala Prasad, et al. Cryo-ET of Env on intact HIV virions reveals structural variation and positioning on the Gag lattice. Cell, 2022.


