Nat Commun:将冷肿瘤转热,北大吴虹团队揭示前列腺癌免疫治疗新机制
时间:2022-01-15 10:16:27 热度:37.1℃ 作者:网络
前列腺癌是男性癌症死亡的主要原因之一,目前主要治疗方法是抗雄激素治疗,然而不少患者会进展为去势抵抗前列腺癌并发生转移(CRPC)。目前针对CRPC没有有效的治疗方法,包括免疫治疗。
2021年1月10日,北京大学生命科学学院吴虹课题组在 Nature Communications 期刊在线发表了题为:Overcoming resistance to immune checkpoint therapy in PTEN-null prostate cancer by intermittent anti-PI3Kα/β/δ treatment 的研究论文。
该研究发现新型PI3K抑制剂BAY1082439通过调节PTEN缺失的前列腺癌的免疫抑制通路和肿瘤免疫微环境,提高癌细胞对免疫检查点阻断疗法的响应,为前列腺癌患者获益于免疫治疗提供了临床前依据。
PTEN缺失导致的PI3K-AKT信号通路异常激活是前列腺癌最常见驱动因素。2018年,吴虹课题组与拜耳公司合作,证实同时靶向α,β和δ三个亚型的新型PI3K抑制剂BAY1082439可以抑制Pten缺失前列腺癌模型鼠的癌细胞增殖。
在这项最新研究中,吴虹课题组又进一步发现间隔性BAY1082439给药可通过抑制PI3K调控的免疫抑制通路而上调癌细胞抗原呈递和T细胞趋化因子表达,减少肿瘤中调节性T细胞介导的外源性免疫抑制,从而增加CD8+ T细胞对肿瘤的浸润及杀伤,保证后继抗PD-1免疫治疗的疗效。
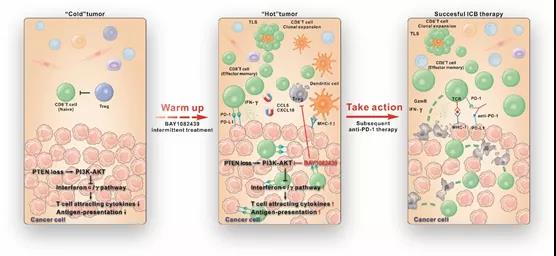
间隔性BAY1082439处理将“冷”肿瘤转化为“热”肿瘤从而促进ICT疗法疗效
左图:在PTEN缺失前列腺肿瘤中,癌细胞上调PI3K通路,抑制IFN通路、抗原呈递和T细胞趋化因子表达。同时肿瘤微环境中调节性T细胞抑制CD8+T细胞激活和增殖,造成“冷”肿瘤的状态。
中图:间隔性BAY1082439处理激活癌细胞的IFN通路并上调抗原呈递功能,同时抑制肿瘤微环境中调节性T细胞。吸收癌细胞抗原的树突状细胞迁移到肿瘤内三级淋巴结构(TLS)中,促进CD8+T细胞激活和克隆增殖。克隆增殖的CD8+T细胞被肿瘤细胞表达的T细胞趋化因子吸引,浸润到肿瘤中,使“冷”肿瘤转化为“热”肿瘤。浸润的CD8+T细胞上调自身PD-1表达并分泌IFNγ细胞因子,刺激肿瘤细胞表达PD-L1,削弱其免疫活性。
右图:在间隔BAY1082439处理后的“热肿瘤”中加入抗PD-1抗体可有效促进T细胞介导的肿瘤杀伤能力。
鉴于PI3K通路异常激活是癌症中最常见上调的信号通路,本研究也对其他肿瘤应用PI3K抑制剂靶向治疗和联合免疫治疗提供了临床前依据。
北京大学生命科学学院、北大-清华生命科学联合中心吴虹教授为本文通讯作者。北京大学生命科学学院PTN项目博士研究生戚志为第一作者;生命科学学院李程课题组博士研究生徐子晗提供了重要的生物信息学支持,吴虹课题组张留珍为小鼠实验提供了支持,吴虹课题组其他研究人员也有参与。前拜耳公司研究员刘宁姝也为论文提供了重要指导。这项研究得到了北京大学生命科学学院、生命科学联合中心,深圳湾实验室重点项目的资金支持及北京大学和清华大学生命科学学院仪器中心的技术支持。
原始出处:
Qi, Z., Xu, Z., Zhang, L. et al. Overcoming resistance to immune checkpoint therapy in PTEN-null prostate cancer by intermittent anti-PI3Kα/β/δ treatment. Nat Commun 13, 182 (2022). https://doi.org/10.1038/s41467-021-27833-0.


