Nat Med:打破认知!人类胎儿肠道中也存在分泌胰岛素的细胞
时间:2021-12-26 12:02:55 热度:37.1℃ 作者:网络
在此之前,人们认为在人体中制造胰岛素的独家“许可证”属于散布在胰腺中的β细胞。但是,由于糖尿病患者的β细胞可能变得稀少或功能失调,科学家们一直在寻找其他可能经诱导后制造这种重要的葡萄糖调节激素的细胞。在一项新的研究中,来自以色列魏茨曼科学研究所和美国耶鲁大学医学院的研究人员在一个意想不到的地方发现了制造胰岛素的细胞,即人类胎儿肠道。这一发现可能为未来开发潜在的糖尿病治疗方法开辟了新的方向。相关研究结果于2021年12月9日在线发表在Nature Medicine期刊上,论文标题为“Insulin is expressed by enteroendocrine cells during human fetal development”。
当胎儿在子宫中成长时,它的许多细胞在未来的命运还没有决定,在一段时间内保持不稳定的细胞身份。这对胎儿肠道中的细胞尤其如此:在中期妊娠期间,肠道已经完全形成,但当它仍在子宫内时,不需要吸收食物或防止感染。在这项新的研究中,魏茨曼科学研究所分子细胞生物学系的Shalev Itzkovitz教授及其团队与耶鲁大学医学院儿科医生Liza Konnikova教授及其团队联手,了解胎儿肠道细胞可能承担的不寻常的职责,比如承担胰岛素的产生。
在这项新的研究中,这些作者使用一种叫做单细胞RNA测序的先进技术构建了胎儿肠道细胞图谱。这种技术同时构建了数千个细胞的完整基因表达谱。然后,他们将这些图谱与新生儿肠道中的细胞图谱进行比较。他们特别关注肠道中的激素分泌细胞,它们只占所有肠道细胞的1%左右,但却极为重要,因为它们释放的激素在身体代谢中起着关键的调节作用。
事实上,这项比较研究发现一类称为K/L的胎儿肠道细胞在小肠中表达胰岛素基因。在此之前,这个基因只知道在胰腺β细胞中表达。新生儿的小肠也含有K/L类型的细胞,但与胎儿的肠道细胞相反,它们并不表达胰岛素。
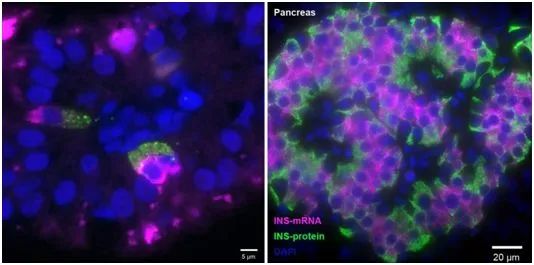
在小肠的FIKL细胞(上)和胰腺的β细胞(下)中,制造胰岛素的mRNA分子(洋红色)被发现更靠近细胞中心,而胰岛素本身(绿色)聚集在细胞外向的一面,从那里释放出来。图片来自Nature Medicine, 2021, doi:10.1038/s41591-021-01586-1。
这些作者将这类新发现的胎儿肠道细胞称为FIKL,其中F代表胎儿,而I代表胰岛素。这些细胞只占胎儿肠道中激素分泌细胞的大约2%,但是它们的数量相对较多,因为人类肠道的内壁覆盖了一个巨大的区域。
除了这个制造胰岛素的基因外,这些作者发现FIKL细胞还能表达支持这种激素活性的整个分子程序,包括感知葡萄糖的基因和确保胰岛素从细胞中释放的基因。此外,FIKL细胞被发现能大量制造胰岛素。就像在β细胞中一样,它们的胰岛素基因非常活跃,制造了数以万计的mRNA分子拷贝,这个数字远远高于人类基因组中每个基因一次大约10个拷贝的平均水平。然而,当对FIKL细胞内的RNA和其他分子进行成像时,他们发现了另一种与β细胞类似的行为:β细胞和FIKL细胞都以类似的方式排列,因此表达胰岛素的mRNA面向细胞的中心,而这种激素本身则积聚在细胞的外侧,从而有利于它的释放。
Itzkovitz说,“这些与胰腺β细胞的相似之处是有意义的,因为大约在妊娠的第五周,胰腺和小肠起源于生长中的胎儿的同一组织。”
为什么胎儿肠道含有制造胰岛素的细胞还没有得到澄清。这项研究中的细胞来自于一个胎儿组织库,其母亲的健康状况不明。怀孕有时会改变母亲的胰岛素和葡萄糖水平,所以有可能是为了应对母亲的妊娠期糖尿病而开启了胰岛素程序,以帮助胎儿应对母亲血液中的高葡萄糖水平。肠道产生的胰岛素也可能有局部作用,支持快速发育的肠道的生长。
是什么让这种胰岛素制造程序在出生时关闭,也是未知数。然而,据Itzkovitz的说法,关键问题是它是否能被重新打开。
Itzkovitz说,“也许有一天,这种休眠的胰岛素制造程序可以在糖尿病患者身上被唤醒。如果是这样的话,肠道内壁的细胞可以成为胰岛素的绝佳来源,因为它们会不断地被更新,这对制造胰岛素的β细胞不断地被免疫系统破坏的1型糖尿病患者来说将是一种特殊的优势。”
在2型糖尿病患者中,β细胞也经常丢失,因为它们在应对高血糖水平的压力下崩溃了。到目前为止,用细胞移植治疗糖尿病以替代β细胞损失的研究主要依赖于使用干细胞或对除β细胞之外的细胞进行基因改造来产生胰岛素。
Konnikova说,“我们发现的FIKL细胞的优势是,它们自然包含一种制造胰岛素的工作程序。如果我们能找到调节这一程序的线索,我们有朝一日可能会根据需要开启它。”
参考资料:
Adi Egozi et al. Insulin is expressed by enteroendocrine cells during human fetal development. Nature Medicine, 2021, doi:10.1038/s41591-021-01586-1.


