JCO丨肺癌20ins突变,Amivantamab后线治疗ORR高达40%
时间:2021-12-20 16:01:48 热度:37.1℃ 作者:网络
EGFR突变是NSCLC的主要致癌驱动因素,其中19del、L858R约占85%,Exon20ins突变是第三大突变类型(比例≤12%)。EGFRex20ins突变对现有的三代EGFR TKI敏感性都很差,响应率极低(0-9%),在这种情况下,即便预后较差,铂类化疗还是成为了EGFRex20ins突变型NSCLC患者的首选。 不久前,Amivantamab(JNJ-61186372)和Mobocertinib(TAK-788)这两款药物陆续获得美国FDA批准上市,EGFRex20ins突变型NSCLC治疗的局势逐渐明朗。今天,我们分享《临床肿瘤学杂志(JCO)》发表的Ⅰ期CHRYSALIS研究结果。


Mobocertinib (TAK-788)与Amivantamab的作用机制[1]
CHRYSALIS研究 CHRYSALIS研究:是一项首次在人体中进行的、开放标签、多中心、多队列的I期研究,评价Amivantamab 作为单一疗法或联合其他药物(Lazertinib)治疗晚期 NSCLC 患者的疗效、安全性和药代动力学。研究分为剂量递增和剂量扩展,剂量递增阶段确定最大耐受剂量和推荐II期剂量 (RP2D),剂量扩展阶段(6个队列,详见研究结果中图)在标准剂量的治疗下,评估Amivantamab的安全性、耐受性和抗肿瘤活性。 主要终点是剂量限制性毒性(DLT)和总体缓解率(ORR),次要终点是缓解持续时间(DoR)、临床获益率(CBR)、无进展生存期(PFS)和总生存期(OS)。 研究结果 试验人群 从2016年5月27日至2020年6月8日,研究共纳入362名患者,队列扩展阶段,共计258例患者接受II期推荐剂量治疗 (RP2D),即1050 mg(<80kg)或1400 mg(≥80kg),前4周每周给药1次,然后从第 5 周开始每 2 周一次。【为减轻输液相关反应,首次注射分别在第一天和第二天完成推荐剂量的注射,并且需要预防性用药】,疗效每6周进行一次评估。其中Exon20ins队列【队列D】可进行疗效评估的患者共81例,既往均接受过含铂化疗,中位年龄为62岁,有40例(49)为亚洲人,18 名患者 (22%) 既往有过脑转移,中位治疗线数为二线,其中20 人 (25%) 接受过 EGFR TKI 治疗,37 人 (46%) 接受过免疫治疗。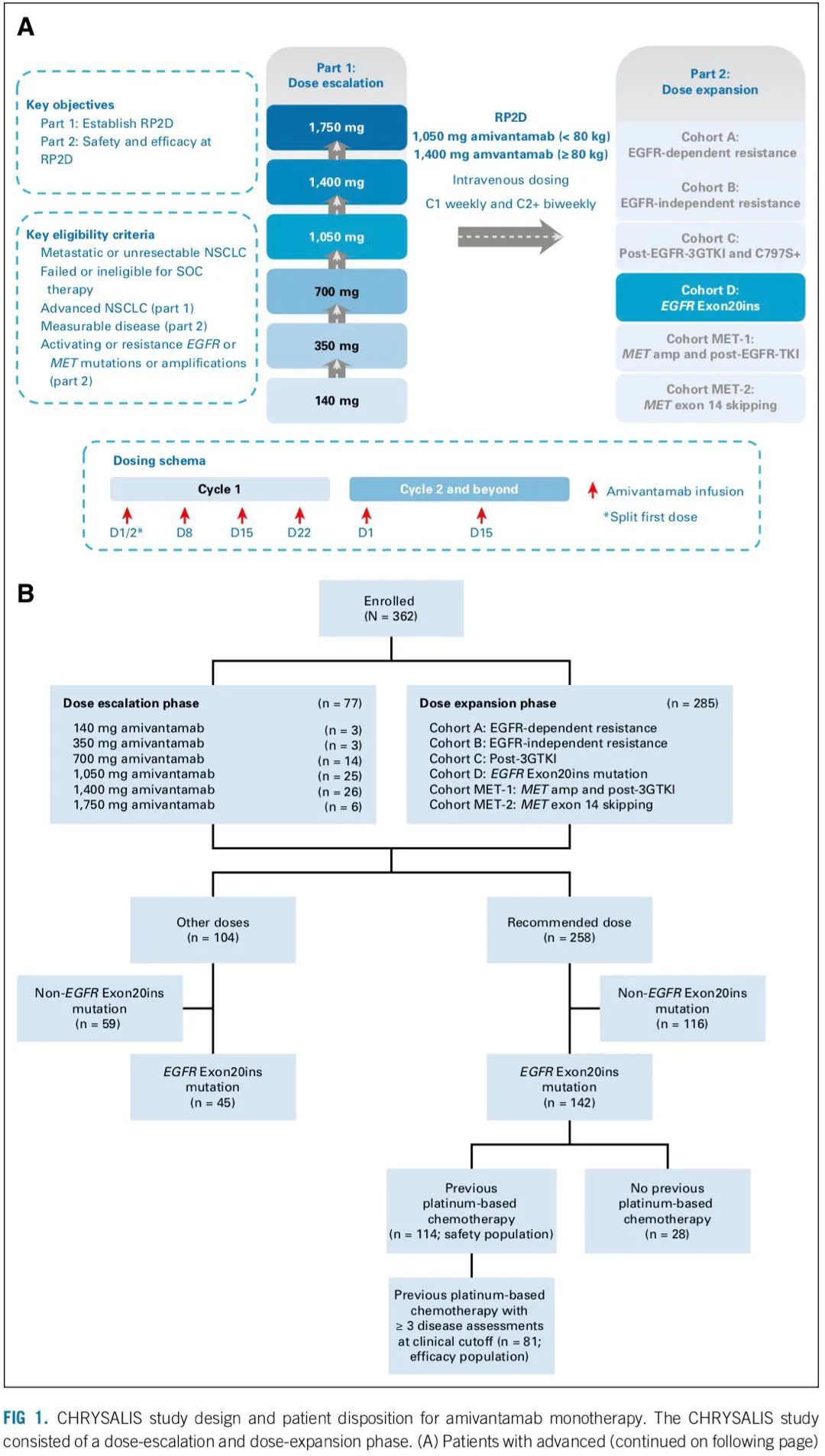
研究设计及入组流程图
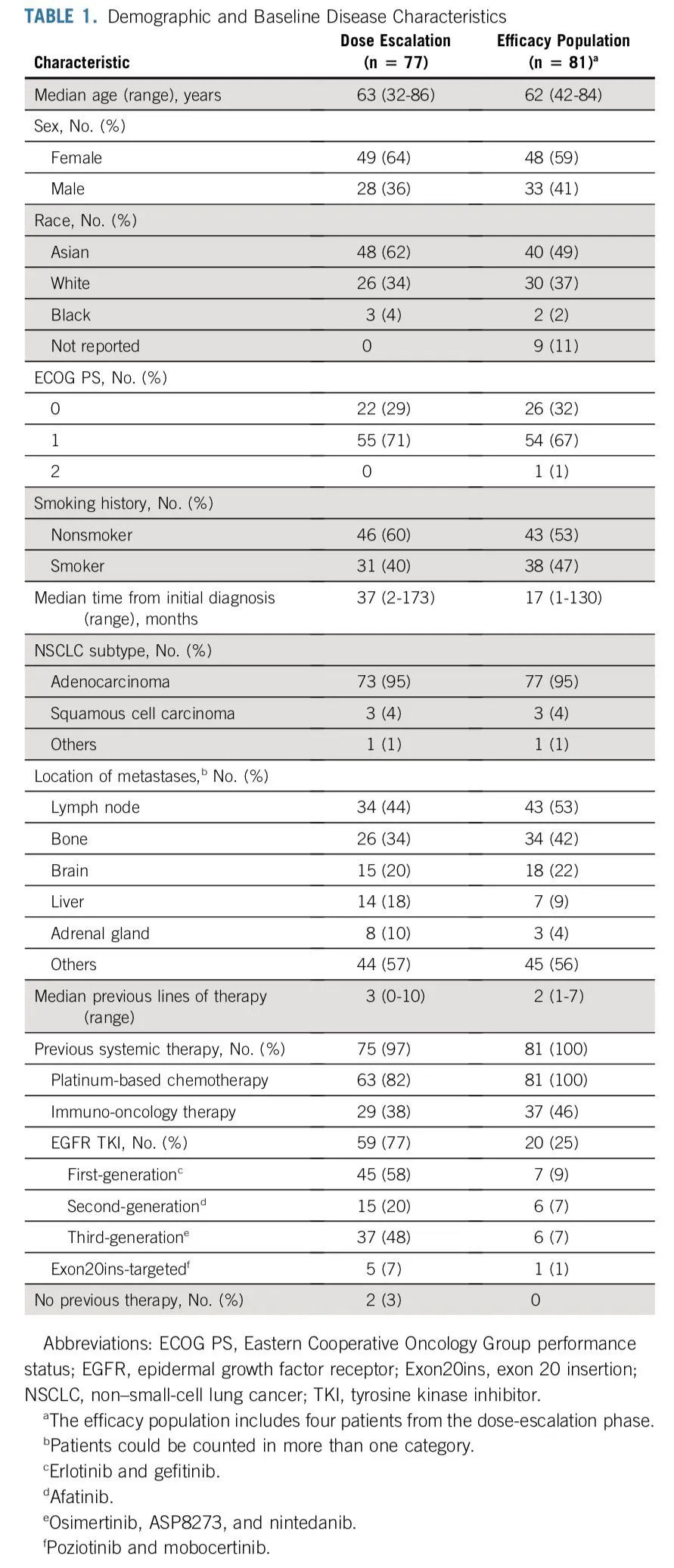
基线特征
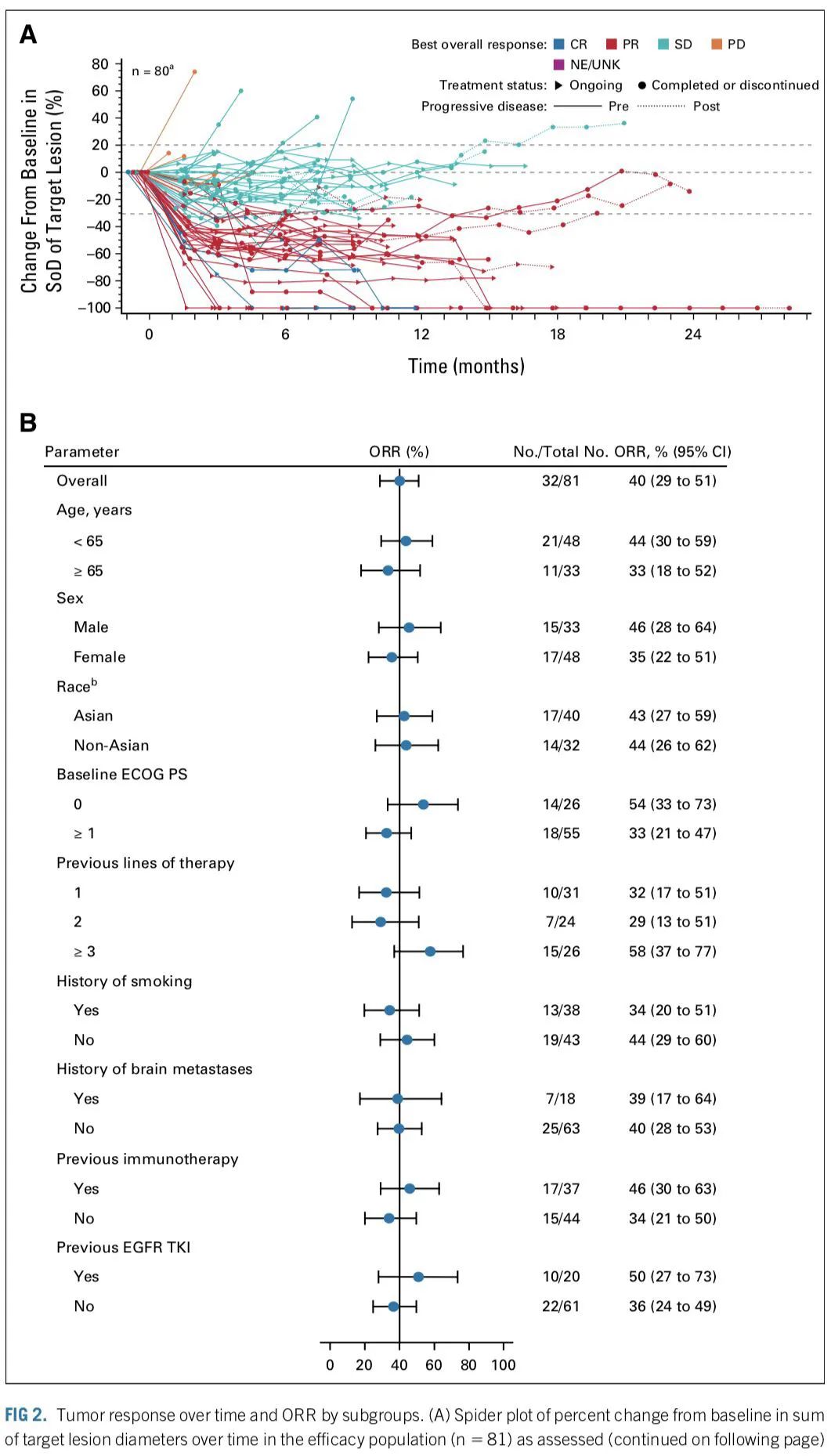
药代动力学、药效学和免疫原性 给予Amivantamab 1750 mg治疗后,未观察到最大耐受剂量;综合安全性、药代动力学和药效数据,后续推荐给药剂量为1050 mg(<80kg)或1400 mg(≥80kg)。Amivantamab 抗体发生率低,未观察到抗体滴度水平对 Amivantamab 的药代动力学参数、临床活性或安全性的明显影响。 有效性在疗效分析集中,中位随访时间为9.7个月时,独立评审委员会(BICR)评估的客观缓解率(ORR)为40%(32/81)。包括3例确认的完全缓解(CR)和29例部分缓解(PR)。中位缓解持续时间(DOR)为11.1个月,75%的患者在第一次疗效评估时即观察到客观响应,临床获益率74%,所有临床亚组患者均观察到了客观响应。
 BICR评估的ORR
BICR评估的ORR
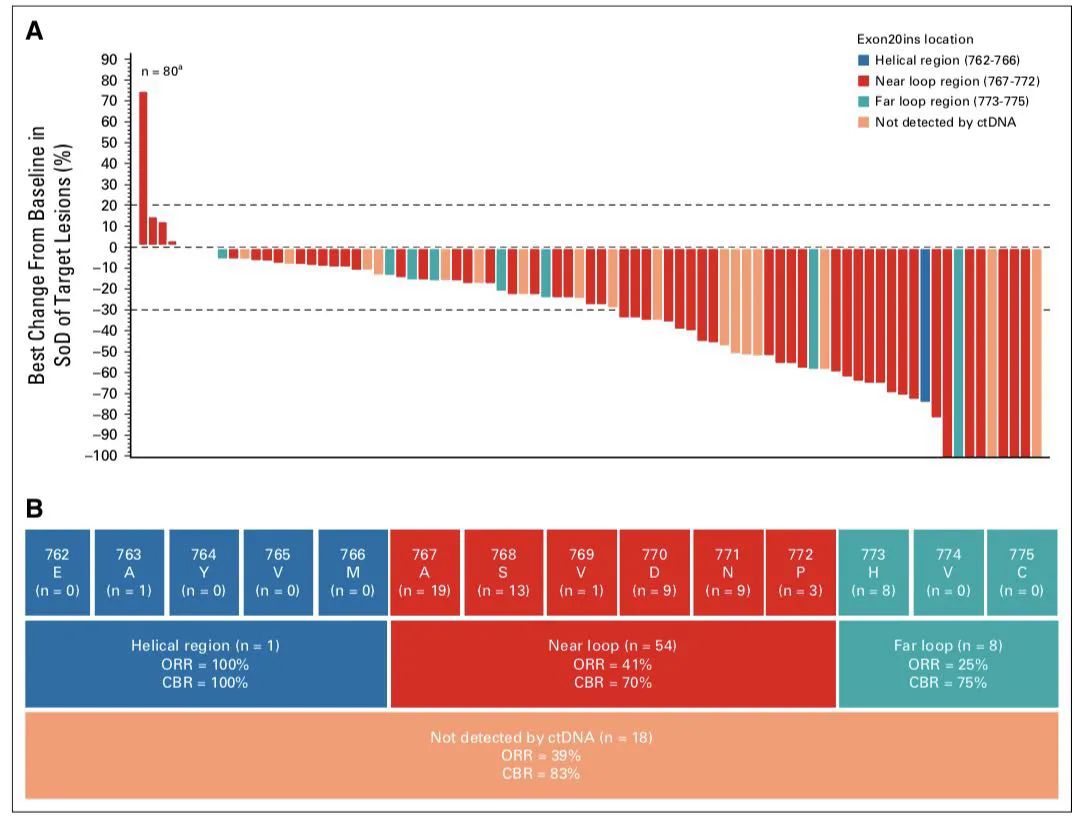 疗效瀑布图及不同类型应答情况
疗效瀑布图及不同类型应答情况
 PFS和OS:数据统计时,共计47例(58%)患者出现进展或死亡;中位 PFS 为 8.3 个月(95% CI,6.5 至 10.9)。中位 OS 为 22.8 个月(95% CI,14.6 至未达到),尽管有 23 人死亡,但该终点仍不成熟。
PFS和OS:数据统计时,共计47例(58%)患者出现进展或死亡;中位 PFS 为 8.3 个月(95% CI,6.5 至 10.9)。中位 OS 为 22.8 个月(95% CI,14.6 至未达到),尽管有 23 人死亡,但该终点仍不成熟。
疗效人群中的81例患者均有ctDNA或肿瘤样本提交中央实验室进行检测,其中63例具有可检测的ctDNA,共检测出25种不同的Exon20ins变异类型。在20号外显子的螺旋区、近环和远环区域内有插入的患者中均观察到抗肿瘤反应。
安全性中位随访时间为 5.1个月时,114位接受过铂类化疗的EGFRex20ins突变型NSCLC患者,在接受Amivantamab标准剂量治疗后,分别有13%和4%的患者(n=15,n=5)因治疗相关不良反应而剂量减少和停药治疗,没有人发生5级治疗相关不良事件。
与 EGFR 抑制相关的不良事件包括:98 例 (86%) 皮疹(包括痤疮样皮炎)、51 例 (45%) 甲沟炎、24 例 (21%) 口腔炎、19 例 (17%) 瘙痒和 14 例(12%)腹泻。与 MET 抑制相关的不良事件包括:31 (27%) 和 21 (18%) 例低白蛋白血症和外周水肿。5例 (4%) 间质性肺病(包括肺炎)。另外,虽然首次注射已经分为两天进行,仍有66%的患者在第一天和第二天时报告了输液相关不良反应,但这在后期治疗中几乎没有再现(0.09%,n=1)。
≥3级以上不良事件发生40例(35%),最常见的包括低钾血症(5%)和皮疹、肺栓塞、腹泻和中性粒细胞减少症(各4%)。≥3级治疗相关的3级不良事件发生18例(16%),最常见的包括皮疹(4%)和输液相关反应、中性粒细胞减少症(各3%)。严重不良反应发生率为30%【最常见的是肺栓塞(3%)和背痛(3%)】。
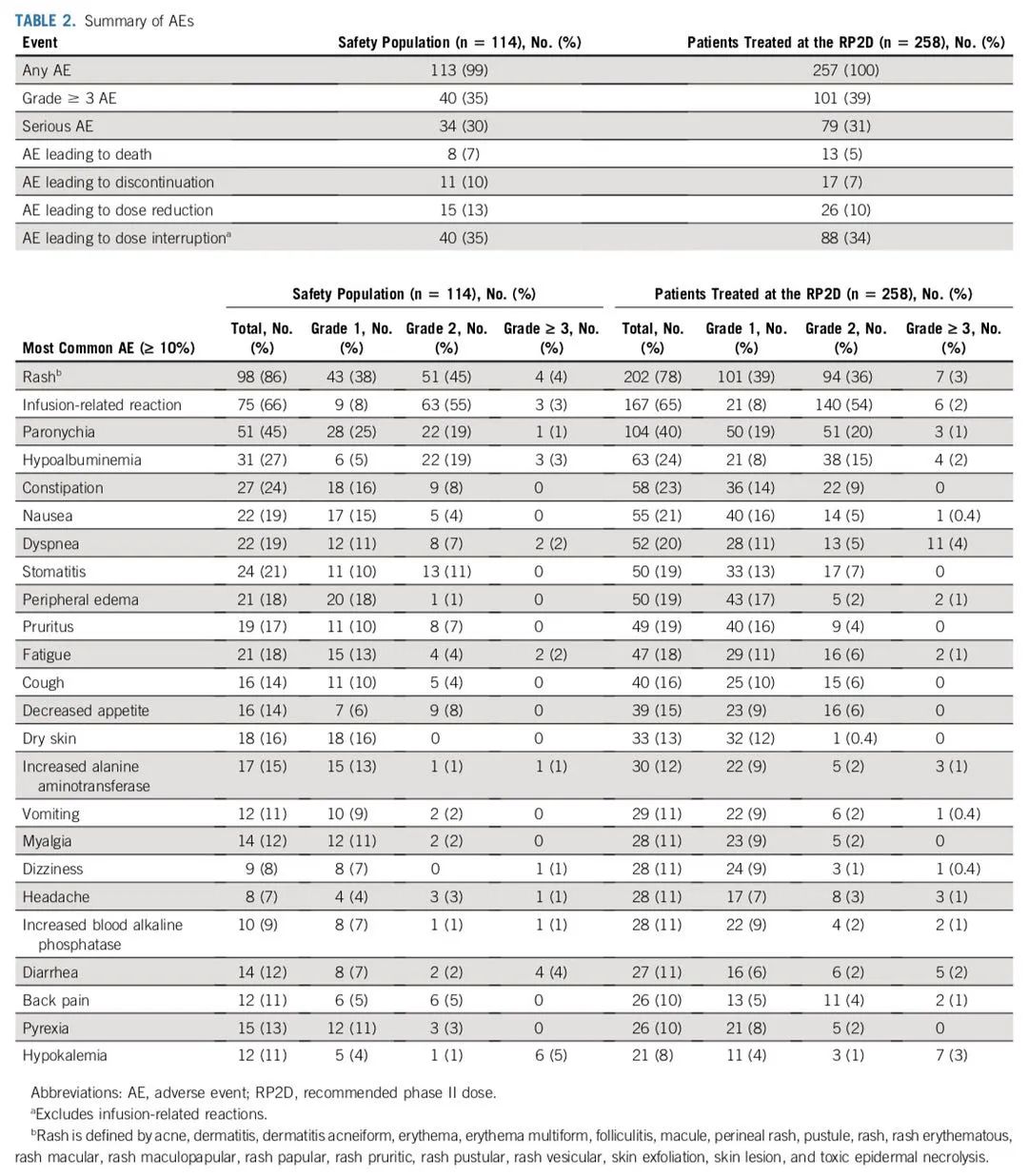
安全性汇总
小 结1. 整体而言,Amivantamab通过其新的作用机制,在既往接受含铂化疗进展后的EGFR Exon20ins突变NSCLC患者中具有稳定和持久的反应,并且具有可接受的安全性。
2. 基于此项试验数据,今年5月份时Amivantamab经由FDA获批了这一适应证。这是第一个获得 FDA 批准,用于铂类化疗后或正在化疗的EGFRex20ins突变型NSCLC患者治疗的药物。
参考文献
[1]Köhler J, Jänne PA. Amivantamab: Treating EGFR Exon 20-Mutant Cancers With Bispecific Antibody-Mediated Receptor Degradation. J Clin Oncol. 2021 Oct 20;39(30):3403-3406. doi: 10.1200/JCO.21.01494.
[2]Park K, Haura EB, Leighl NB, et al. Amivantamab in EGFR Exon 20 Insertion-Mutated Non-Small-Cell Lung Cancer Progressing on Platinum Chemotherapy: Initial Results From the CHRYSALIS Phase I Study. J Clin Oncol. 2021 Aug 2:JCO2100662. doi: 10.1200/JCO.21.00662.


