Nature:新型CAR-T疗法,有望靶向治疗各种类型癌症
时间:2021-11-11 23:02:14 热度:37.1℃ 作者:网络
以CAR-T为代表的的癌症免疫治疗的发展,为白血病等血液类癌症带来了治愈的希望,但该方法在治疗实体瘤方面尚未取得实质性突破,部分原因是许多实体瘤缺乏肿瘤特异性靶点。在这些癌症中,大多数负责肿瘤生长和存活的蛋白质深埋于肿瘤细胞的细胞质甚至细胞核中,而不在细胞表面。
神经母细胞瘤是儿童最常见的颅外实体肿瘤,又称为儿童癌症之王。这种癌症几乎没有出现基因突变,而是由表观遗传失调所驱动,因此缺少进行免疫治疗的靶点,而放疗、化疗、手术等常规治疗手段后,往往会复发。
2021年11月3日,美国费城儿童医院和英国伦敦大学学院的研究团队联合在 Nature 期刊上发表了题为:Cross-HLA targeting of intracellular oncoproteins with peptide-centric CARs 的研究论文。
该研究利用大型数据集和先进的算法,识别出了神经母细胞瘤免疫肽组富含源自对肿瘤发生至关重要的蛋白肽,并重点针对人类白细胞抗原(HLA)-A*24:02上发现的未突变的肽——QYNPIRTTF,该肽源自神经母细胞瘤依赖性基因和核心转录调节因子PHOX2B,并且可以被“以肽为中心”的嵌合抗原受体(PC-CAR)进行靶向治疗。
PC-CAR是一种新型工程化T细胞,可以刺激免疫反应,从而根除体内肿瘤。这些发现为通过免疫疗法治疗更广泛的癌症,以及将每种疗法应用于更大比例的人群打开了大门。

首先,研究团队通过对8种神经母细胞瘤细胞来源的异种移植物(CDX)和患者来源的异种移植物(PDX)进行免疫肽组学检测,利用三种公共数据集筛选,鉴定出了13个肽,这些肽来源于神经母细胞瘤中表达的9个独特基因。
然后,依据相同的方法,他们从8例高危神经母细胞瘤原发肿瘤中鉴定出了56个肽。为了选择那些具有最高潜力的肽作为假定的免疫治疗靶点,他们根据pMHC结合亲和力、HLA等位基因频率、亲本基因的差异表达程度、MHC相对于其他肽的相对丰度对肽进行了优先排序,确定了PHOX2B 是神经母细胞瘤的高度特异性肿瘤抗原,是治疗靶向的理想候选。
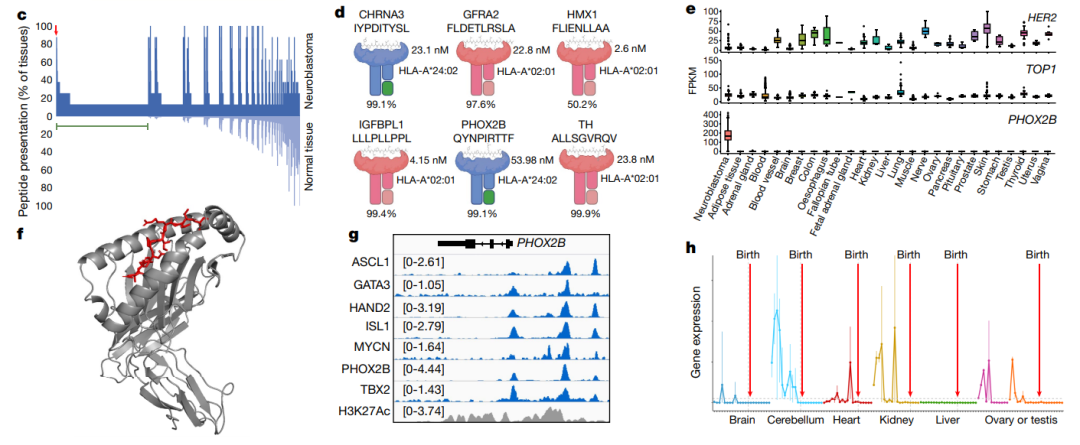
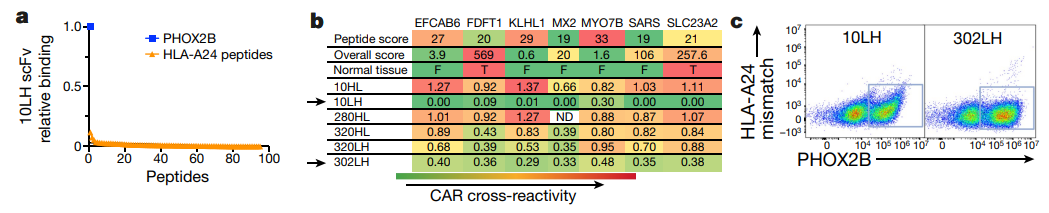
使用合成的以肽为中心的受体可能诱导免疫原性惰性pMHCs产生免疫原性,同时由于在多个筛选中未发现高亲和力T细胞受体(TCR),研究团队继续开发基于单链抗体的CAR,而不是PHOX2B的工程化TCR。
为了筛选PHOX2B肽特异性克隆,他们采用了蛋白质显示平台ReD,可通过流式细胞术在渗透性细菌细胞中选择pMHC结合单链抗体。ReD产生了25个单链抗体结合物。为了避免正常组织与pMHC的交叉反应,他们开发了一种名为sCRAP的算法来预测潜在的交叉反应,确定了特异性最高的克隆10LH。细胞实验证明了sCRAP在预先识别非靶向效应、有效筛选其功能后果和识别与肿瘤靶点具有高度选择性结合的分子方面的有效性。
最后,研究团队使用免疫缺陷小鼠皮下移植神经母细胞瘤模型测试了10LH的靶向杀伤潜力。10LH转导的CAR-T细胞(10LH-PC-CAR)处理的模型小鼠显示出完全的肿瘤反应,他们还观察到CAR治疗诱导肿瘤中MHC的大量上调。这种上调可能是由于有效IFN-γ释放,表明该疗法可以在低抗原密度下激活T细胞,从而启动前馈级联反应,增加MHC和抗原呈递。
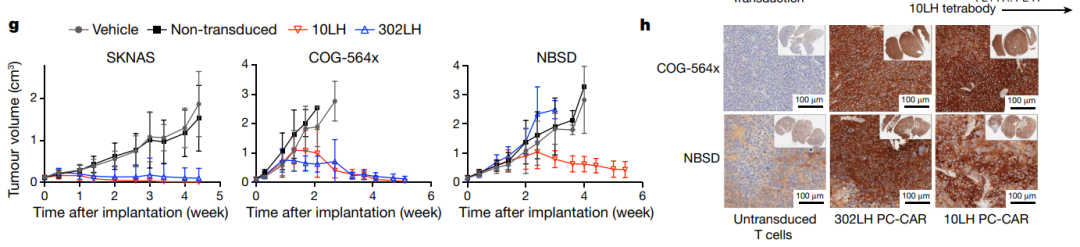
综上,该研究提出了一种识别来源于非突变癌蛋白的肿瘤特异性抗原的方法,针对这些肿瘤自身肽构建“以肽为中心”的嵌合抗原受体(PC-CAR),能够有效刺激免疫系统,在神经母细胞瘤小鼠模型上显示了优异的效果,完全清除了小鼠体内肿瘤。
这些发现表明,以肽为中心的CAR可能极大地扩展免疫治疗靶点库,为通过免疫疗法治疗更广泛的癌症,以及将每种疗法应用于更大比例的人群打开了大门。
原文链接:
https://www.nature.com/articles/s41586-021-04061-6


