Front Oncol:PD1抑制剂penpulimab联合安罗替尼一线治疗中国不可切除肝细胞癌(uHCC)患者的疗效和安全性
时间:2021-11-09 22:01:53 热度:37.1℃ 作者:网络
原发性肝癌是全球第四大癌症死亡原因,5年生存率仅为12-20%。肝细胞癌(Hepatocellular carcinoma, HCC)是肝癌的主要组织学亚型,约占肝癌的80%。III期随机试验IMbrave150证实, atezolizumab联合bevacizumab治疗的患者OS (19.2 vs. 13.4个月;HR,0.66;95% CI, 0.52 0.85)和无进展生存期(PFS) (6.9 vs. 4.3个月;HR,0.65;95% CI, 0.53 0.81)明显较索拉非尼治疗患者延长。因此,免疫治疗联合抗血管生成治疗已成为HCC一线治疗首选的标准治疗方案。中国人民解放军总医院团队开展了一项研究,旨在评价人源化抗PD-1 IgG1抗体penpulimab联合安罗替尼一线治疗中国不可切除肝细胞癌(uHCC)患者的疗效和安全性。相关结果发表在Frontiers in Oncology杂志上。

AK-105-203 (ClinicalTrials.gov, NCT04172571)是一项开放标签的多中心Ib/II期试验,纳入了组织学或细胞学证实为uHCC、既往无全身治疗、年龄18 - 75岁、BCLC B期(不适合局部治疗)或C期、Child Pugh评分≤7、ECOG≤1的患者。患者接受penpulmab [200 mg静脉(静脉)+口服安罗替尼(8 mg/天,服用2周/休息1周)。主要终点为客观缓解率(ORR)。次要终点包括安全性、疾病控制率(DCR)、无进展生存期(PFS)、治疗至进展时间(TTP)、缓解持续时间(DoR)和总生存期(OS)。
2019年1月24日至12月13日期间,在中国8个中心筛查了41例患者,最终纳入31例患者,29例纳入疗效分析队列。数据库截止时,所有患者的中位随访时间为14.7个月(范围为1.4-22.1),疗效分析队列的中位随访时间分别为15.2个月(范围为3.7-22.1)。根据RECIST 1.1版标准,ORR为31.0% (95% CI, 15.3-50.8)。在应答者中,6例患者在3个月内达到PR, DoRs范围为2.8+ ~ 15.9+个月。DCR为82.8% (95% CI, 64.2-94.2)。
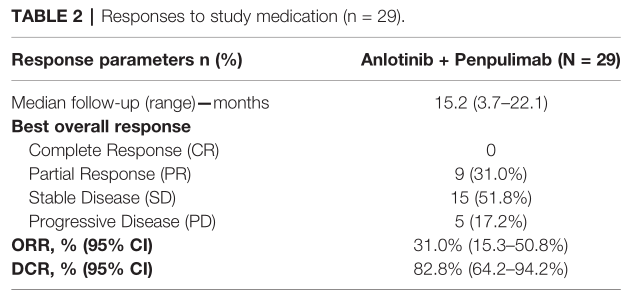
疗效评估
研究人员评估的中位无进展生存期(PFS)为8.8个月(95% CI, 4.0-12.3),12个月PFS率为33.7% (95% CI, 16.3-52.1)。31例患者中位TTP为8.8个月(95% CI, 4.0-12.9), 12个月时TTP率为37.2% (95% CI, 18.0-56.5)。中位OS尚未达到,估计的6个月和12个月OS率分别为93.2% (95% CI, 75.5-98.3)和69.0% (95% CI, 48.9-82.5)。
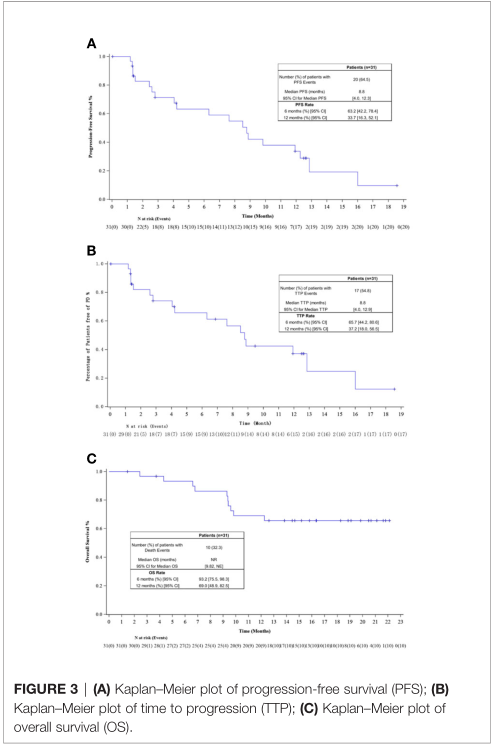
PFS、TTP和OS
96.8%(30/31)的患者报告了至少一次TEAE(治疗相关不良事件);19.4%(6/31)的患者报告了严重的AEs。19.4%(6/31)患者出现≥3级或以上TEAE,包括高血压[2(6.5%)]、皮疹[1(3.2%)]、全身皮疹[1(3.2%)]、胸痛[1(3.2%)]、周围肿胀[1(3.2%)]和肝脏破裂[1(3.2%)]。6.5%(2/31)的患者出现3级或更高的免疫相关AEs。
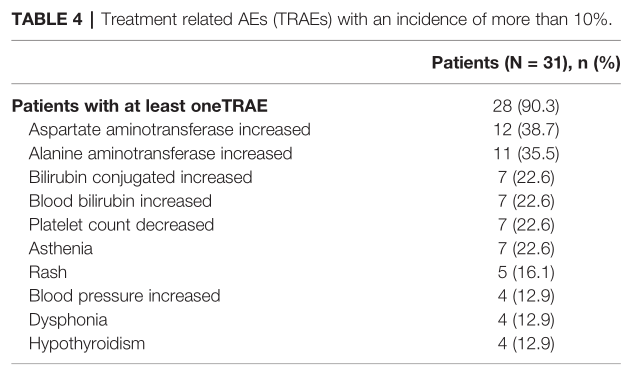
不良反应
综上,研究表明,Penpulimab + 安罗替尼作为uHCC患者的一线治疗具有良好的抗肿瘤活性和安全性。
原始出处:
Han C, Ye S, Hu C, Shen L, Qin Q, Bai Y, Yang S, Bai C, Zang A, Jiao S and Bai L (2021) Clinical Activity and Safety of Penpulimab (Anti-PD-1) With Anlotinib as First-Line Therapy for Unresectable Hepatocellular Carcinoma: An Open-Label, Multicenter, Phase Ib/II Trial (AK105-203). Front. Oncol. 11:684867. doi: 10.3389/fonc.2021.684867


