美国FDA批准 Cyltezo(阿达木单抗-adbm)作为第一个可与Humira互换的生物仿制药
时间:2021-10-18 22:01:22 热度:37.1℃ 作者:网络
勃林格殷格翰今天宣布,美国食品和药品监督管理局 (FDA) 批准了Cyltezo(阿达木单抗-adbm)的补充生物制剂许可申请(sBLA),使Cyltezo作为第一个与Humira(阿达木单抗)可互换的生物仿制药。FDA最初于2017年批准Cyltezo用于治疗多种慢性炎症性疾病,最新批准将其指定为可用于所有Humira的适应症。
勃林格殷格翰医药和法规事务高级副总裁Thomas Seck说:“我们很自豪能够成为推动生物仿制药进步并提供第一个也是唯一一个与Humira互换的生物仿制药的公司。这是一个真正的里程碑,Cyltezo的可互换性状态加强了为美国医疗保健系统的质量和可持续性做出贡献的目标”。
生物仿制药是一种生物药物,其开发与批准的参考生物制剂高度相似,在安全性、效力和纯度方面没有临床意义的差异。可互换生物仿制药必须首先满足FDA对生物仿制药的高标准。然后,为了实现可互换性,FDA要求对患者进行多重替代的额外临床研究,称为可互换性研究。这种类型的研究显示了患者在多次从参考产品到可互换生物仿制药候选产品之间来回切换时的表现。
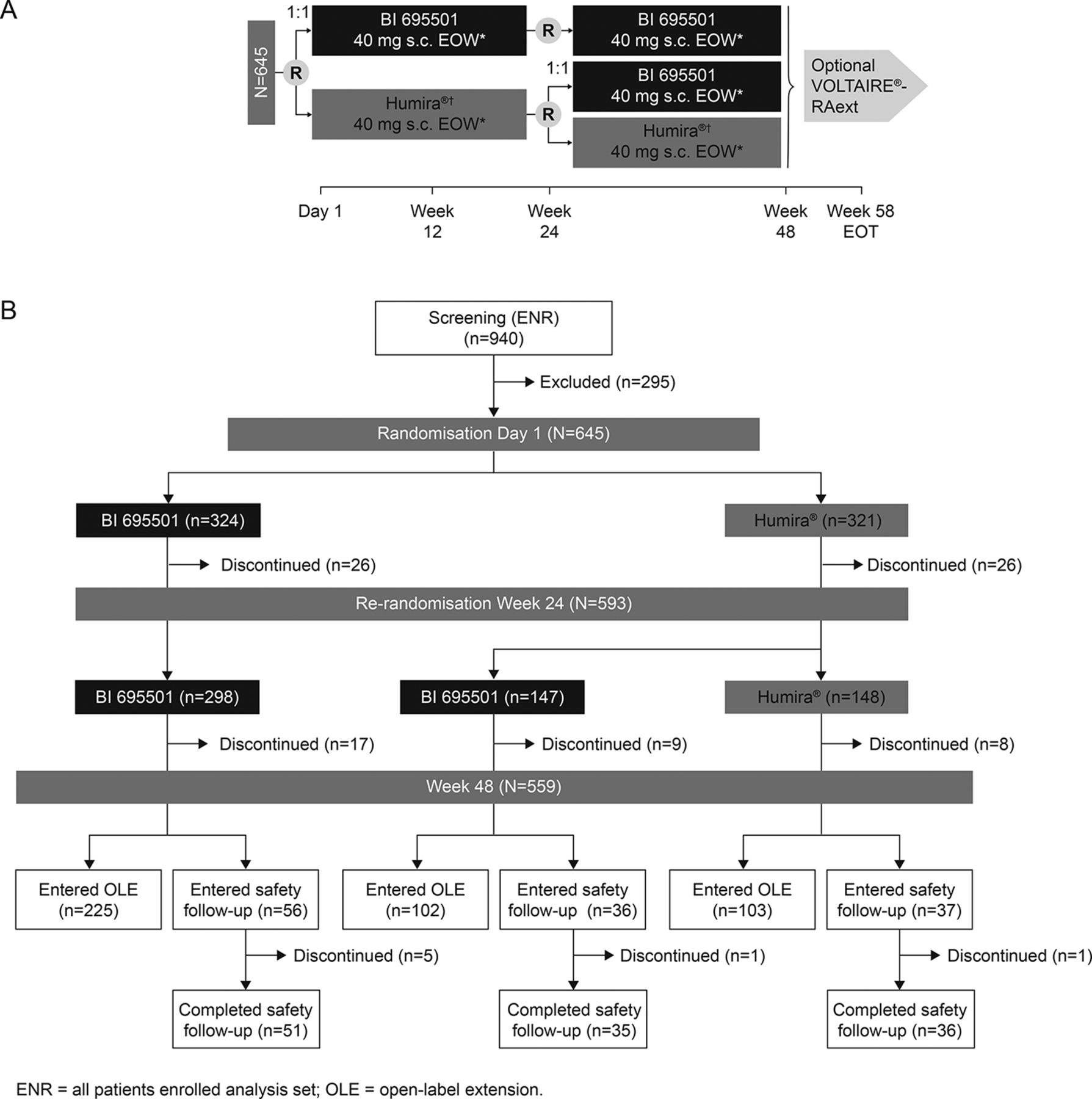
对可互换性的批准得到了勃林格殷格翰 III 期随机VOLTAIRE-X临床试验的积极数据的支持,这标志着FDA首次批准此类研究。VOLTAIRE-X试验研究了Humira和Cyltezo之间多次切换的效果。这项额外的研究表明Cyltezo与Humira等效,在转换治疗组和连续治疗组之间的药代动力学、功效、免疫原性和安全性方面没有显著差异,这项结果已经发表在美国皮肤病学会2021年会议上。
原始出处:
https://www.firstwordpharma.com/node/1871815?tsid=4


