人造子宫来了,未来女性也不用亲自怀孕了?
时间:2021-10-09 10:01:54 热度:37.1℃ 作者:网络
早产儿是指胎龄小于37周的新生儿。近年来中国早产儿的发病率呈上升趋势,约为7%。早产儿的存活率与胎龄有关,胎龄越小,体重越轻,死亡率越高。出生时体重不足1500克的婴儿死亡率约占新生儿期死亡总数的50%,伴发后遗症的可能性也相对较大。
如何提高早产儿存活率减少并发症是急需解决的问题。另外对于患有子宫疾患的女性,怀孕生子成了奢望。
如果在体外能够模拟子宫内环境使胚胎发育,将会同时解决以上两大问题。
科学家们提出了人造子宫的设想,人造子宫是通过模拟哺乳动物子宫和卵生动物卵的条件,使受精卵在人造环境下发育,从而摆脱对母体的需求。
目前已经取得一定进展,未来人造子宫应用的路还有多远呢?
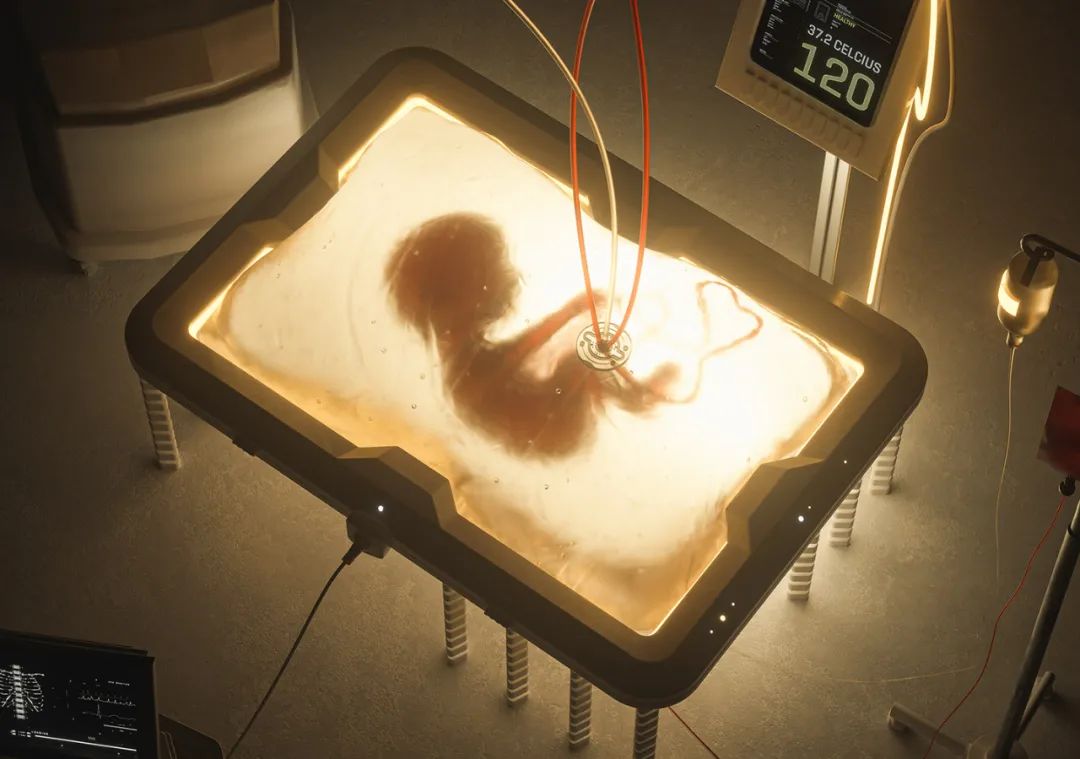
来源:neo.life
人造子宫已在羊身上实现
早在1923年,霍尔丹在剑桥大学举行的一次讲座中首次对人造子宫进行深入探讨后,各国科学家就开始研究胚胎脱离母体生长的可能性。
1954年,伊曼纽尔·格林伯格首次设计了人造子宫的装置并申请了专利。设计包括一个用来放置充满羊水的胎儿的水箱、一个连接到脐带的机器、血泵、一个人造肾脏和一个热水器。这仅仅是一个粗糙的设想。

1987年,日本顺天堂大学教授桑原义典(Yoshinori Kuwabara)开发了一种宫外胎儿孵化系统EUFI(Extrauterine Fetal Incubation System)。宫外胎儿孵化系统有与母山羊体内相似的人造羊水环境,在前期实验的基础上研究人员将培养时间成功延长至三周直到山羊足月。但因山羊胎儿在活动时会夹住或拉出导管,因此桑原用肌肉松弛剂使它们瘫痪,但是松弛剂让胎儿无法正常呼吸,当研究人员在四周后移除呼吸机时,山羊在数小时内死亡。
2017年,费城儿童医院的阿南·弗雷克(Alan Flake)团队在《自然通讯》杂志上发表了开发的“人造子宫”动物试验,成功将发育到中期(相当于人类妊娠周期22-24 周)的早产山羊胎儿在“人造子宫”中维持了4周撑过危险期顺利存活。弗雷克同样将胎龄更小的羊(105 至 108天)在体外成功培育了4周(最终因动物协议的限制而停止)。

这种人造子宫确切地说是一种用特殊材质制成的生物袋,生物袋模拟母羊子宫,其中充满了羊水,在生物袋外部配置机器胎盘,机器胎盘的血管与早产小羊的脐带连通。
人造子宫接有专门管道,每天注入定量羊水,以确保生活在其中的早产羊羔如同悬浮在母体的子宫环境内。含有养料和氧气的新鲜血液不断输送到羊羔体内,羊羔的心脏也将含有二氧化碳和其他代谢物质的陈旧血液挤压到机器胎盘中,机器胎盘将血液更新之后再回输到羊羔体内。
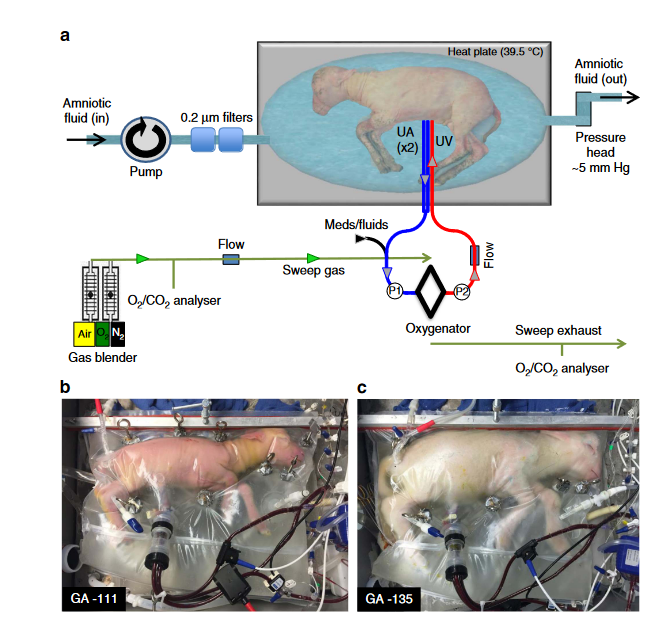
在人造子宫孕育期间,这些早产羊羔全部正常发育,血压和其他健康指标稳定,没有其他并发症。有一部分生下的小羊生长超过一年,经过各项指标检测,结果也与正常生殖的小羊没有什么差异。这项技术如果能够应用于人类,将会极大提高早产儿的生存机会。
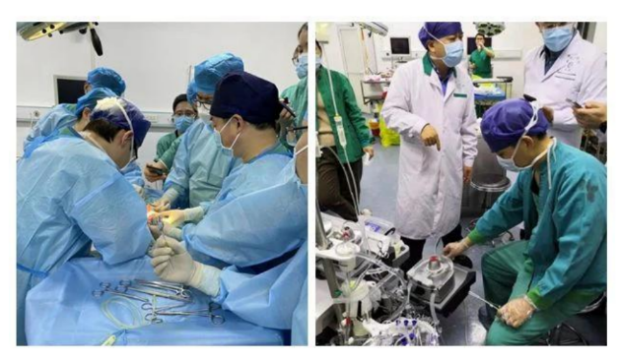
我国也在进行人造子宫的尝试。2020年12月,郑州大学第一附属医院首次取得人造子宫胎羊体外培育的成功,该项研究是由胸外科、产科以及体外支持中心ECMO团队联合推进的。这项研究填补了我国在体外培育的空白。
人造子宫,见证小鼠胚胎早期完整发育
2021年3月《自然》杂志发布以色列魏茨曼科学研究所最新研究,该研究利用“人造子宫”,成功培育出数百只小老鼠,且小鼠所有器官发育指标都正常。
这项研究有什么 “过人”之处?
前述研究仅限于实验室环境下的早期胚胎分裂、短期发育,或待器官形成后从子宫中取出胎儿并在实验室中继续生长。而这次研究所关注的是“胚胎早期完整发育”,见证其如何发育成生命体。
研究团队从母鼠体内提取出孕育只有7.5天、出现内细胞团分化、形成外胚层和原始内胚层的胚胎,此时胚胎仅由250个细胞组成。将胚胎置入“人造子宫”环境中,“人造子宫”包含保温箱、营养物质和通风系统等部分。看似简单的构想和操作,从概念到成功运转耗时7年。

这一技术同时也为研究胚胎发育打开新的大门,该技术能避免子宫内部成像限制,使研究者直接观察胚胎发育过程,或可应用于受精卵移植、流产等研究。
3D打印子宫是否可行呢? 上述人造子宫可以模拟子宫内环境,但毕竟是生物袋,那么真正的组织型人造子宫是否能够实现呢? 与之前依托机械的模式完全不同,2001年,康奈尔大学妇产科刘洪清教授体外重新构建出“子宫”这个器官。 先共同培养受精的人类卵子与子宫内膜细胞,使子宫内膜细胞先在胶原蛋白基质中生长,让细胞形成类似于子宫内膜组织的多层栓塞,最终筑造出一个由胶原质和软骨素构成的,可以被生物分解的子宫形状的支架,然后在上面“播种”子宫内膜细胞,当稳定后将用作支架的物质分解掉,构建了三维的“人造子宫”。 由于美国法律规定体外受精的胚胎发育不能超过14天,最后实验在第6天就终止了。但这是首次实现子宫内膜的体外重建。据《科学》杂志公布,美国卡内基-梅隆大学科学家已经利用3D生物打印机,用人体胶原蛋白为原料,成功打印出了可正常工作的心脏组织,其精细度可达20微米。打印出来的心脏组织可以嵌入活体细胞和毛细血管,并且开始跳动,泵出血液。
并且,深圳先进技术研究院也在2017申请了 “3D打印人造子宫内膜及其制备方法和应用”的专利。该发明涉及生物技术领域,具体涉及3D打印技术制备的人造子宫内膜。通过3D生物打印技术,将生物相容性支架与子宫内膜基质细胞/上皮细胞制成具有生物活性的人造子宫内膜。
可见,3D打印子宫或许在未来可以实现。 
虽然人造子宫已经取得不错的进展,但从技术层面看,人造子宫现在还非常不成熟,类似“卵化器”,只能在孕育的最后阶段,发挥子宫的部分功能,提高早产的存活几率,这些并不足以支撑整个生育过程。
其次,胎儿在母体生长发育的过程中,不仅仅是营养获取、激素调节,可能还有情感交流等,母体外的胚胎和正常生育的胚胎究竟有什么不同,目前人类还知之甚少。
和其他人造器官相比,人造子宫面临更多的伦理争议。人造子宫是解决早产儿存活率的问题,给不孕女性提供生育可能?还是用来方便不想“亲自”孕育的女性?
技术的使用不当,也可能引发种种不可预期的社会问题。技术的进步,应当始终服务于人类的福祉。我们还需要更多的时间进行伦理学上的思考及辩论。
参考文献
1.Nat Commun. 2017 Apr 25;8:15112.An extra-uterine system to physiologically support the extreme premature lamb
2.Ann Biomed Eng. 2017 Jul;45(7):1746-1757.3D Cell Culturing and Possibilities for Myometrial Tissue Engineering
3.Nature. 2021 May;593(7857):119-124.Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis


