智飞生物重组新冠疫苗获印尼EUA,针对变异毒株有效性仍有待更多真实世界数据
时间:2021-10-08 11:01:25 热度:37.1℃ 作者:网络

10月7日,印度尼西亚药物和食品监管机构(BPOM)授予智飞生物重组新冠疫苗紧急用途许可证(EUA)。这是智飞生物在海外获得的第二个EUA。第一个海外EUA是乌兹别克斯坦3月1日授予的。
智飞生物该款重组新冠疫苗ZF2001是由中科院微生物所高福院士团队与安徽智飞龙科马生物制药有限公司联合研发的新冠病毒重组蛋白亚单位疫苗,即将病毒的关键抗原蛋白用体外重组的方式表达后制备成疫苗。主要是针对新冠病毒S蛋白上的受体结合结构域(RBD区)进行疫苗研发。在高福院士团队的带领下,将两个新冠病毒RBD串联表达出二聚体蛋白,制备成重组蛋白亚单位疫苗,作为我国重点布局的五条疫苗路线之一,重组亚单位新冠疫苗拥有自主知识产权,由微生物所高福院士和严景华研究员团队研发,戴连攀研究员是成果主要完成人之一。
去年10月30日,中科院微生物所已顺利完成Ⅰ/Ⅱ期临床试验揭盲,揭盲数据显示,临床试验结果符合预期,疫苗显示出了很好的安全性和免疫原性。数据显示,ZF2001具有良好的耐受性,没有与疫苗相关的严重不良事件。 在第0、30和60天进行免疫活性检测中,中和抗体的血清转化率为93-100%,GMT超过了恢复期血清样品的大小。
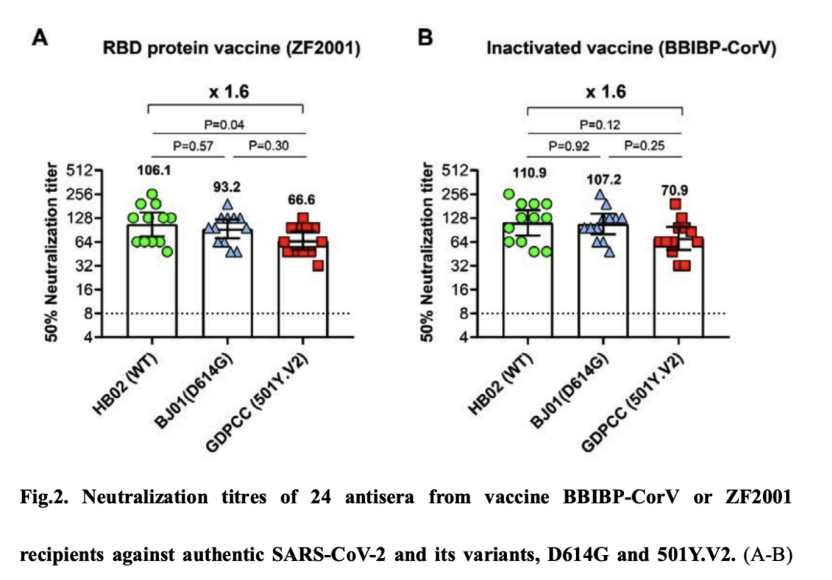
今年2月初,中国疾病预防控制中心高福团队在bioRxiv发布正在开展3期临床试验的国产重组蛋白亚单位新冠疫苗和批准上市的国产灭活新冠疫苗(北京生物制品研究所等联合开发的BBIBP-CorV灭活新冠疫苗)对南非新变种(501Y.V2)的保护效果。结果显示,虽然这两种疫苗接种者血清对南非新变种的中和效果稍有下降,但是依然保留大部分中和活性,提示这两种疫苗对南非新变种依然有保护效果。
 doi: https://doi.org/10.1101/2021.02.01.429069
doi: https://doi.org/10.1101/2021.02.01.429069
文章称,研究者为每种疫苗选择了12个来自临床试验参与者的血清样本,无论是ZF2001还是BBIBP-corV受试者的12份血清样本都基本保留了南非变异毒株的中和作用。与它们和新冠病毒毒株WT或D614G的滴度相比,几何平均滴度(GMTs)下降幅度均是1.6倍。令人鼓舞的是,减少量明显少于以前报道的康复患者血清(超过10倍)或来自mRNA疫苗接受者体内的抗体血清(超过6倍)的减少量。
8月27日晚间,智飞生物发布公告称,与中科院微生物所合作研发的重组新型冠状病毒疫苗获得Ⅲ期临床试验关键性数据。Ⅲ期临床试验关键数据结果证明,重组新型冠状病毒疫苗(CHO细胞)在符合本临床试验方案的人群中具有很好的安全性和防病效果。
截止到本次数据分析日,实际共入组28500人,其中疫苗组14251例、安慰剂组14249例。共监测到全程接种后的主要终点病例数221例,对于任何严重程度的COVID-19的保护效力为81.76%,达到WHO要求的新冠疫苗有效性标准。其中对于COVID-19重症及以上病例、死亡病例的保护效力均为100%。
目前已完成大部分主要终点病例的基因分型,初步分析结果显示:对Alpha变异株的保护效力为92.93%;对Delta变异株的保护效力为77.54%。
本研究安全性数据结果显示:总体不良事件/反应的发生率,疫苗组与安慰剂组无显著差异,安全性良好。已完成的Ⅲ期临床试验关键数据结果证明,重组新型冠状病毒疫苗(CHO细胞)在符合本临床试验方案的人群中具有很好的安全性和防病效果。
对比全球主要获批上市和紧急使用新冠疫苗的III期临床数据,智飞生物重组新冠疫苗的综合保护率居前,且是唯一对野生株和主要变异株完成完整三期临床试验的新冠疫苗。
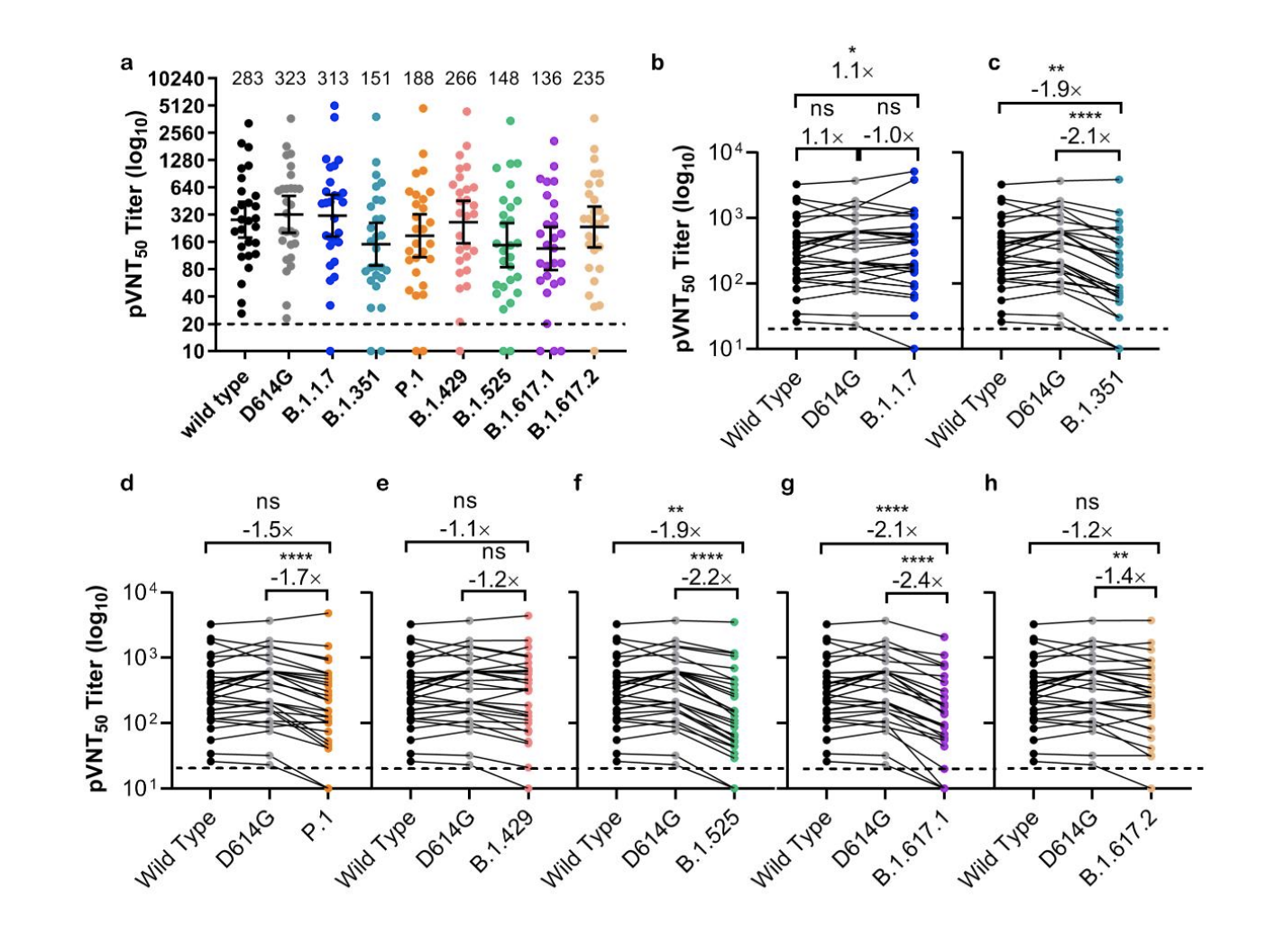
ZF2001中和三种SARS-CoV-2变异假病毒血清样本抗体滴度水平。
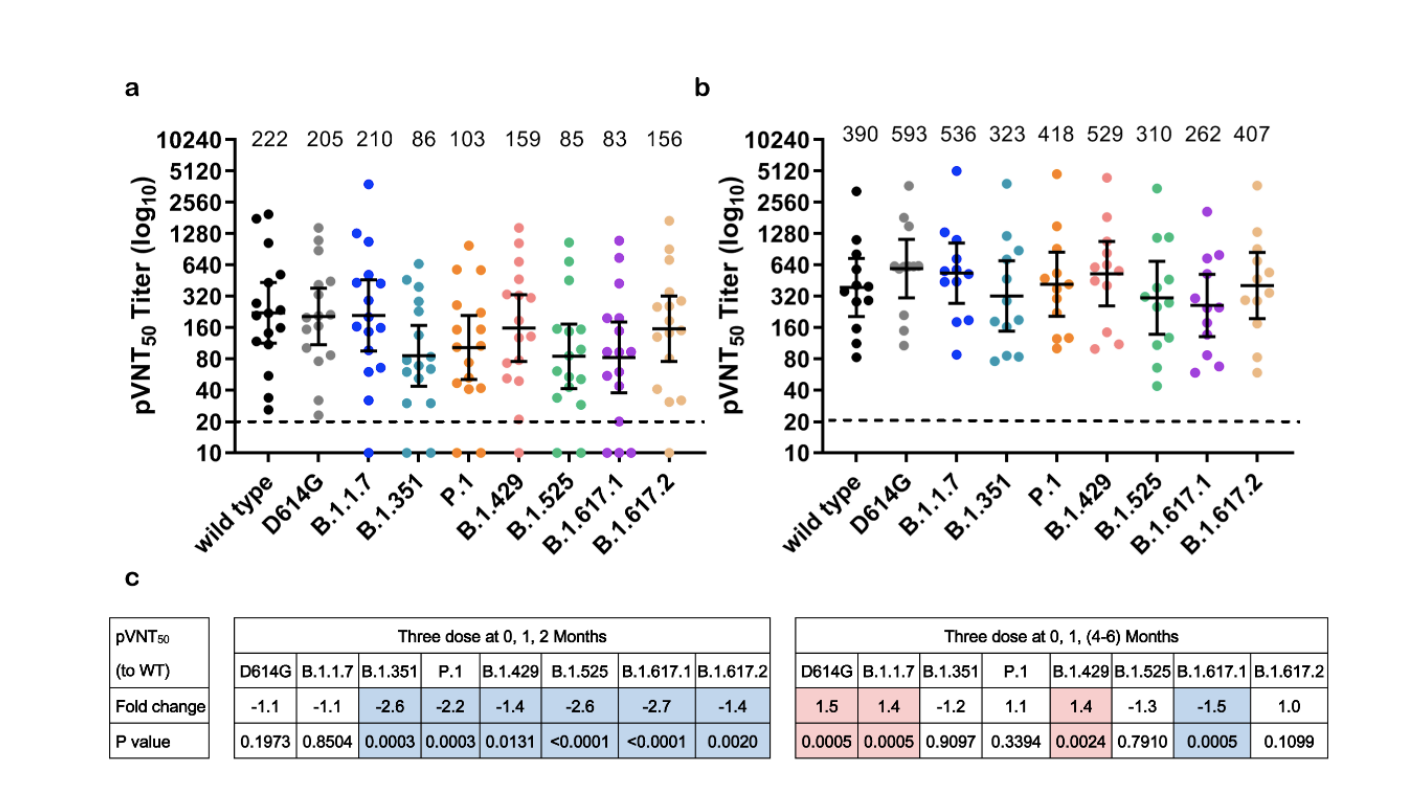
接受三剂ZF2001受测者血清样本抗体水平
7月15日,智飞生物与中国科学院微生物研究所在预发表平台bioRxiv上曾发表实验结果称,以模拟Delta变体颗粒进行测试,与早先出现的病毒颗粒相比,接种过智飞三剂疫苗者的血清样本显示其中和抗体降低了1.2倍。科研人员指出,仍需要来自临床试验或实际使用的数据来确定疫苗对病毒变体的防护力。该研究采用了28名受测者样本。试验结果也发现,施打第二剂和第三剂疫苗的间隔时间较长者,对新冠病毒变体的活性更大。
但研究人员指出,这些新出现的变种对 ZF2001的高度敏感性疫苗支持当前的大规模免疫接种机会,以建立群体免疫。然而,针对这些变异的疫苗有效性仍然必须通过3期临床验证试验和真实世界的证据。


