PLoS One:新型结直肠癌诊断和预后生物标志物,绝了!
时间:2021-09-19 20:31:33 热度:37.1℃ 作者:网络
结肠直肠癌 (CRC) 是最常见的癌症,是全世界癌症相关死亡的主要原因之一。各种肿瘤抑制基因的基因突变和表达水平变化,包括腺瘤多聚体大肠杆菌(APC)、肿瘤蛋白53(TP53)和BRAST Cancer基因(BRCA1)长期以来一直被认为是CRC的一个重要原因,通过各种调控途径影响CRC的发展、进展和转移。
生物标志物筛选技术的进步极大地帮助临床发现可靠的新型诊断和预后生物标志物,用于CRC的早期检测和治疗。然而,由于可用诊断和预后生物标志物的异质性特异性,CRC在不同种族、不同癌症阶段、性别、年龄组和体重的患者中的复发和转移仍未完全解决,仍然是临床治疗的主要挑战难点之一。
近来,微阵列技术在科学家中非常流行,因为它能够筛选出数以千计的不同表达的信使RNA(mRNA)、微RNA和长非编码RNA(lncRNA),它们在疾病的发展中起着重要的作用。此外,该技术还有助于对关键基因进行深入分析,以探索潜在的分子靶点和诊断生物标志物。而本研究旨在研究一种新型CRC生物标志物系统,能广泛应用于CRC患者,并有助克服异质特异性的难题。

在本研究中,研究人员进行了基于 PubMed 的搜索,以确定所有利用基于 GEO 的 CRC 微阵列表达数据集来探索中心基因的研究。总共进行了21项研究,确定了哪些集体利用了来自GEO的30多个CRC微阵列表达数据集。我们从每项研究中提取了所有已识别的中心基因,并将它们汇集在一起,从 31 个微阵列数据集中挑选了 210 个集线器基因,其中包含 3128 个 CRC 和 877 个正常样本。然后,我们进行了路径丰富和PPI网络建设和分析提取的集线器基因,以确定少数更密切的CRC相关基因(真正的中心基因)及其基础通路。我们进一步对真实中心基因进行了表达分析和验证,旨在识别基因变化,最终确定真正的中心基因。
KEGG通路富集分析显示,所有提取的210个中心基因在各种通路中都得到了显著的丰富,包括"Chemokine信号通路","癌症通路","细胞循环","PI3K-Akt信号通路",以及细胞因子-细胞因子受体相互作用通路。此外,提取的210个集线器基因的PPI网络说明了其功能连接的概况,其中前6个真实集线器基因被选为CXCL12、CXCL8、AGT、GNB1、GNG4和CXCL1。KEGG对6个真实中心基因的通路分析表明,这些基因在通路中显著丰富(p<0.05),包括"Chemokine信号通路"、"癌症通路"和"细胞因子-细胞因子受体相互作用"。
炎症是肿瘤微环境的重要组成部分,也是癌症的标志之一。Chemokine家族是一个小型、分泌和结构相关的细胞因子家族,在炎症和免疫力方面起着至关重要的作用,他们也是癌症相关炎症的关键调解人,直接影响癌细胞增殖和转移。
已识别的真正的中心基因CXCL12,能与CXCR4结合,CXCR4是一种G蛋白耦合受体(GPCR),并被公认为与癌症转移有关的一个因子。CXCL12 通常由库普费尔斯和肝脏内皮细胞分泌,这是 CRC 转移最常见的部位。此前,各种研究表明,CXCR4的过度表达与CRC中生存和肝转移不良有关。CXCR7 是 CRC 细胞中与 CXCL12 相互作用的另一种受体。在本研究中证明了不同临床病理特征(包括不同种族、癌症阶段、性别、年龄组和体重)的COAD患者,与正常对照组相比,CXCL12在mRNA水平上的异常显著下调(p<0.05)。研究结果还显示,与对照组相比,COAD患者的转化水平对CXCL12的下行调节。CXCL12下调节与其促进甲基化状态和基因改变的相关性。鉴于研究结果,显著超甲基化(p<0.05)是CXCL12在COAD中降低调节的可能原因,而不是在分析样本中观察到的基因变化(0.2%)。综合起来,我们的数据表明,CXCL12作为不同种族、癌症阶段、性别、年龄组和体重的CRC患者中一种新型的潜在诊断生物标志物的下调节。
真正的中心基因CXCL8,也被称为中性粒细胞活化因子(NAF),和白细胞介素8(IL-8),是第一个被确定为白细胞化疗吸引剂的化疗诱因。CXCL8 通过与 (GPCR) 受体 CXCR1相互作用,控制在平衡和炎症期间的白细胞转运。本次研究概括了CXCL8在COAD患者中MRNA表达显著高于正常对照组,这些患者具有不同的临床病理特征,包括不同的种族、癌症阶段、性别、年龄组和体重。并显示,CXCL8在COAD患者的转化水平处于上行水平。进一步发现,与对照组相比,CXCL8在COAD患者群体中明显超甲基化,在COAD样本中也进行了最小比例(0.6%)的基因改变。总的来说,CXCL8作为不同种族、癌症阶段、性别、年龄组和体重的CRC患者的一种新型潜在诊断生物标志物。
真正的中心基因ATG(血管紧张素)是肾上血管紧张素系统(RAS)的重要组成部分,它是血压的有力调节器。ATG 是血管紧张素 II (A-II) 的前体,主要以肝细胞生产。在目前的研究中,观察到ATG在mRNA水平上显著(p<0.05);与正常对照相比,不同临床病理特征(包括不同种族、癌症阶段、性别、年龄组和体重)的MRNA水平表现较高。与此相反,本研究的结果还报告了与对照组相比,COAD患者在翻译水平上AGT的表达水平较低。AGT mRNA 与翻译水平之间的这种反向相关性表明,翻译后修改存在缺陷,这可能会减少 AGT 蛋白质的半衰期,并导致其减少。研究结果进一步表明,与对照组相比,COAD患者群体中的AGT甲基化程度明显超高,在COAD样本中也进行了少量(2.2%)的基因改变。关于AGT mRNA表达与超甲基化之间的正相关关系,我们建议进一步深入研究,探讨促进甲基化水平在AGT表达调节中的明确作用。
总的来说,ATG作为不同种族、癌症阶段、性别、年龄组和体重的CRC患者中一种新型的潜在诊断生物标志物的向上调节。
G+ 的真正集线器基因 GNB1 编码1,这是瓜氨酸核苷酸-结合蛋白的β(β)亚单位,与G蛋白亚单位形成异质复合物,α和γ。G+子单元与 G+子单元连接,形成 G+复合体,激活 RAS 通路,这是负责维持细胞增殖、细胞粘附和细胞迁移的信号通路。在本研究中观察到与正常对照相比,不同临床病理特征(包括不同种族、癌症阶段、性别、年龄组和体重)的COAD患者GNB1 mRNA显著(p<0.05)的上升调节。
研究结果还显示,与对照组相比,COAD患者的翻译水平对GNB1的下行调节。GNB1 mRNA 与翻译水平之间的这种反向相关性表明,翻译后修改机制存在异常,可能会减少 GNB1 蛋白质的半衰期,并导致其减少。我们进一步发现,与对照组相比,GNB1在COAD患者群体中明显超甲基化,在COAD样本中也以最小比例(1.4%)进行了基因改变。关于意外的超甲基化,我们的发现挑战了甲基化的经典概念,因此,需要做进一步的工作,以获得一个更详细的观察GNB1在COAD中表达和甲基化之间的相关性。综合起来,结果表明,GNB1的上升调节可以被认为是针对在不同种族,癌症阶段,性别,年龄组和体重的CRC患者,一种新的潜在诊断生物标志物。
真正的集线器基因GNG4编码为G蛋白修剪器的γ子单元,它可能作为RAS通路的正调节器,负责维持细胞增殖、细胞粘附和细胞迁移。目前的研究表明,不同种族、癌症阶段、性别、年龄组和体重的CRC患者在mRNA水平上明显(p<0.05)过度表达。这项研究的结果还表明,GNG4在COAD患者的转化水平相对于对照组的向上调节。进一步报告说,GNG4在COAD患者群体中比对照组明显超甲基化,而且在COAD样本中也进行了少量(1%)的基因改变。GNG4 过度表达和超甲基化场景挑战了超甲基化始终与下调节相关的经典观点。总之,本次研究结果表明,GNG4作为不同种族、癌症阶段、性别、年龄组和体重的CRC患者的一种新型潜在诊断生物标志物,具有新的潜质。
真正的中心基因Chemokine(C-X-C图案)配体1(CXCL1),也被称为GRO-α,属于G蛋白耦合受体家族,它特别与CXC化疗细胞素受体2结合,后者激活细胞增殖中的RAS(Rat肉瘤)通路。这项研究确定了不同种族、癌症阶段、性别、年龄组和体重的COAD患者中CXCL1 mRNA的显著(p<0.05)上升调节。此外还表明,与对照组相比,COAD患者的转化水平对CXCL1的调节水平有所提高。CXCL1表达与甲基化状态的相关性分析揭示了预期显著(p<0.05)负相关,从而强化了二甲基化在CXCL1上行调节中的作用。最后,CXCL1基因改变分析结果表明,CXCL1表达不太可能是基因改变的影响,因为改变注意到在极小比例(0.4%)的COAD患者。总的来说,CXCL1作为不同种族、癌症阶段、性别、年龄组和体重的CRC患者的一种新型潜在诊断生物标志物而提高调节。真实中心基因之间的相声细节涉及背景中通往 Crc 的路径。
 在细胞水平上,CXCL1、CXCL8 或 CXCL12 与 GPCR(CXCR1、CXCR2 或 CXCR4)结合并激活 G 蛋白。在这项研究中,GPCR配体(CXCL1和CXCL8)和G蛋白亚单位(β和γ)的上调节应该共同向上调节各种下游路径。另一方面,β和γ G蛋白亚单位在这项研究中进一步向上调节Rho-GTPase家族和Raf-1/MAP/Erk信号级联。
在细胞水平上,CXCL1、CXCL8 或 CXCL12 与 GPCR(CXCR1、CXCR2 或 CXCR4)结合并激活 G 蛋白。在这项研究中,GPCR配体(CXCL1和CXCL8)和G蛋白亚单位(β和γ)的上调节应该共同向上调节各种下游路径。另一方面,β和γ G蛋白亚单位在这项研究中进一步向上调节Rho-GTPase家族和Raf-1/MAP/Erk信号级联。
对真实中心基因的OS生存分析表明,GNG4的高表达是良好的预后生物标志物,而CXCL12、CXCL8、AGT、GNB1和CXCL1是预测COAD患者操作系统持续时间的不良预后生物标志物。
为了进一步阐明CRC肿瘤中真实中心基因的基本机制,本研究进行了真实中心基因表达与CD8+T免疫细胞在COAD中的渗透之间的相关性分析。 CD8+ T 免疫细胞渗透被用作诊断标记,用于早期检测喉鳞状细胞癌缩写为 LSCC。本次结果表明,CXCL12、GNB1 和 CXCL1 和 CD8+ T 免疫细胞的 mRNA 表达水平与 C8+ T 免疫细胞的渗透之间存在显著正相关(p>0.05),而 CXCL8、AGT 和 GNG4 的 mRNA 表达和 CD8+ T 免疫细胞的渗透之间则存在显著的负相关性(p>0.05)。综合起来,这些相关性通过调节CD8+T免疫细胞的渗透,揭示了了CRC肿瘤中真实中心基因的新方面,这些相关性可能会为治疗CRC患者带来新的方向。
miRNA 是负责植物和动物中 mRNA 降解和翻译的小型非编码RNA分子 (+22 核苷酸)。在 CRC 中,发现报告 miR-1-3p 中的表达方式存在差异。鉴于本研究的结果,我们推测,四个真正的中心基因(CXCL8、CXCL12、CXCL1和GNB1)作为mir-1-3p的产生和下调节,可能导致这些基因作为不同轴(mir-1-3p/CXCL8或CXCL12、CXCL1和GNB1)在CRC的发病机制中向上调节。这项研究是首次报告mir-1-3p与CXCL8、CXCL12、CXCL1和GNB1在CRC中的肿瘤作用的研究。此外,我们还发现了各种药物可用于通过调节真实中心基因的表达来治疗CRC。
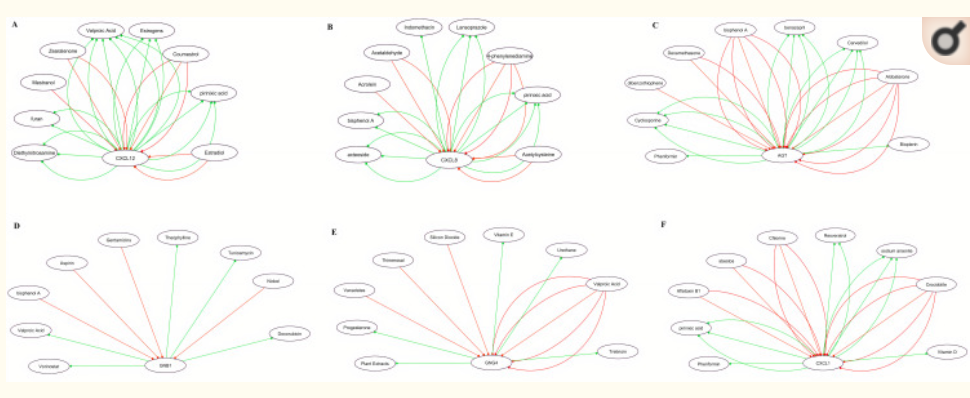
识别真实集线基因的真正集线器基因-药物相互作用网络
面板 A-F 表示 CTD 中可用的化疗药物,可降低或增加真实中心基因的表达水平。(A) CXCL12真正的中心基因药物网络:(B) CXCL8真正的中心基因药物网络:(C) AGT真正的中心基因药物网络:(D) GNB1真正的中心基因药物网络:(E) GNG4真正的中心基因药物网络:(F) CXCL1 真正的中心基因药物网络。红箭表示可以增加真实中心基因表达水平的化疗药物,而绿色箭头表示可能降低真实中心基因表达水平的化疗药物。化疗药物和网络中真正的中心基因之间的箭头数量代表了文献中先前研究的支持数量。
总之,我们已经确定了一个由六个不同表达的真实中心基因(中心基因的集线基因)小组,包括CXCL12、CXCL8、AGT、GNB1、GNG4和CXCL1,以及它们潜在的分子通路,这些基因可以作为不同种族、癌症阶段、性别、年龄组的CRC患者的可能诊断和预后生物标志物,或有助于克服异质性特异性障碍。然而,在临床应用之前,需要开展广泛的生物调查,特别是针对本研究中使用的表达数据集中代表性不足的人群。


