从阿尔法到拉姆达变异株,新冠病毒的演变已露出马脚!
时间:2021-08-21 14:02:07 热度:37.1℃ 作者:网络
疫情爆发以来,新冠病毒已经实现了数轮的“环球旅行”,突变进程十分迅速。
新冠病毒下一步的进化方向是什么?我们应该如何破局?
来源:知乎
首先,我们回顾一下几种主要变异株的前世今生:
Alpha变异株:最早于去年9月在英国被发现,去年底迅速蔓延,在今年4月成为全球主要的流行株。
Beta变异株:最早于去年5月在南非出现,与其它变种相比,它的存在感较低。
Gamma变异株:去年11月在巴西出现,并成为南美洲主要的流行株。
Delta变异株:最早去年10月在印度出现,是目前全球和国内最重要的流行株。
Lambda变异株:最早于去年8月在秘鲁被发现,目前增长势头强劲。
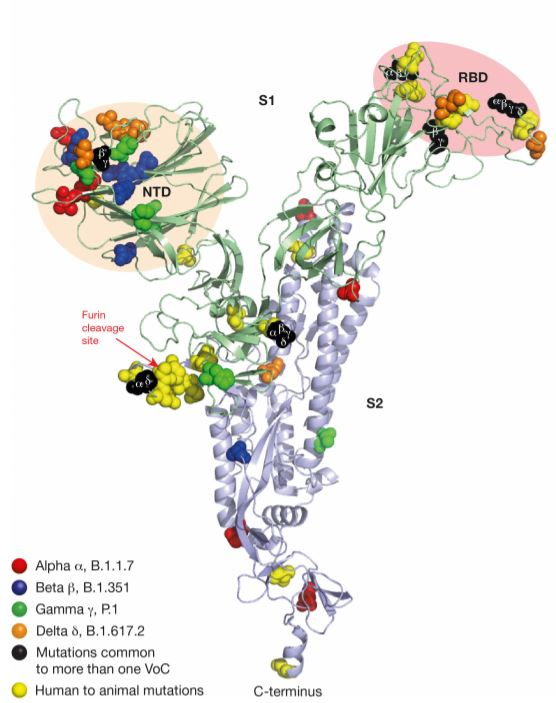
新冠病毒变异株。doi: 10.1038/s41586-021-03792-w.
这几个主要变种的特点也不尽相同。
Alpha变异株的突变让它与靶细胞表面受体更容易结合,从而传染性大大增强。研究发现,它比原始毒株的传染性高50%左右。
Beta和Gamma株的突出特点是具有免疫逃逸的本领。也就是说,这两种毒株可以导致疫苗效力下降,药物治疗困难,既往感染者出现再次感染。
Delta和Lambda株则具有“双突变”特点,同时具有了高传染性和免疫逃逸的能力。其中Delta株比Alpha株的传染性还要高60%左右,患者的检出时间缩短,转阴时间延长,表明其复制速度大大增加。
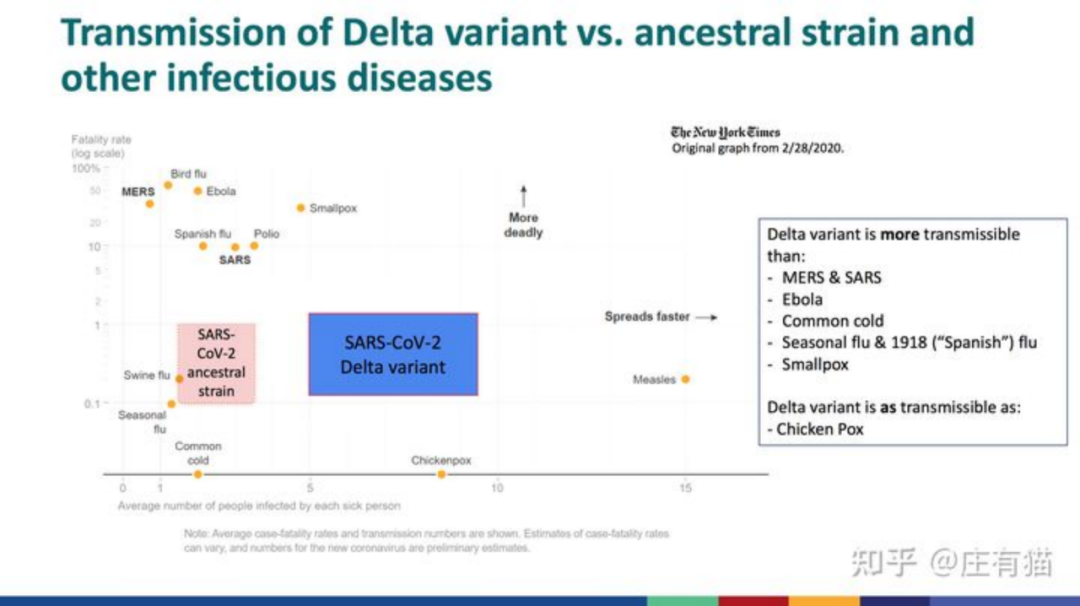
来源:CDC
疫情大流行之初,全球免疫接种比例很低,此时新冠病毒面临的主要问题不是逃避免疫攻击,而是如何更快地传播,因此,当时主要的流行株以高传播力为主。
随着疫苗的普及和治疗手段的丰富,病毒面临的主要困难变成了如何逃避人体免疫系统,此时Beta和Gamma株的优势突显。
但逃避免疫就意味着需要改变其致病的关键成分,例如S蛋白。这个改变会导致与人体细胞结合的能力减弱,因此它们没有像Alpha那样具有传染性。历史上也有相似一幕:上世纪90年代,HIV曾出现过抗药株,但同时病毒的复制能力也下降。
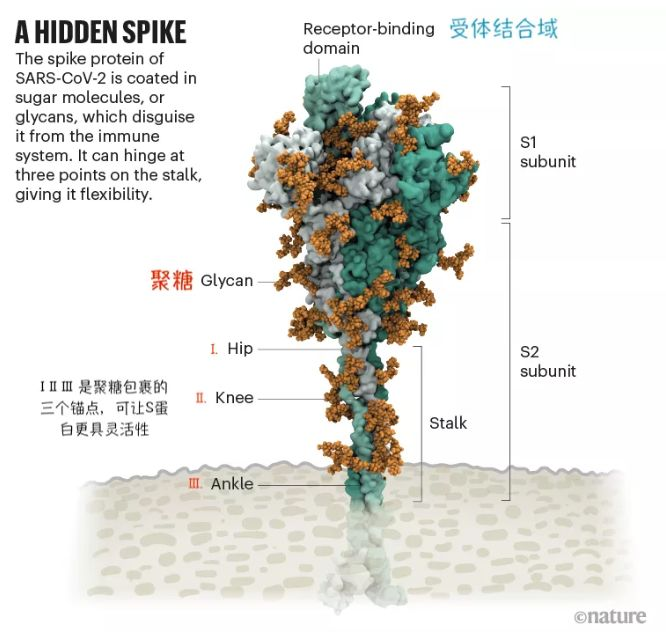
S蛋白结构。来源:知乎
而在印度和秘鲁,疫苗接种率差强人意,同时卫生条件不佳。这种环境就导致病毒既面临一定的免疫压力,但压力并非巨大,同时也有广泛传播的机会,于是双突变的“毒王”Delta和Lambda逐渐流行。
双突变是病毒突变的一次飞跃。在医疗落后地区,疫苗不仅没有成为杀灭病毒的工具,反而成了病毒练兵的帮凶。接种率的不足导致病毒有足够时间在人群中积累有益突变,或者多种突变株同时感染,交媾出新型子代,兼具了免疫逃逸和高传播能力。
但它是如何在保持传染性的同时,还能够有效地绕过我们的免疫防御系统呢?过去我们认为,病毒进入细胞就像一把钥匙开一把锁,钥匙的变异可以逃避监控系统,但也会降低开锁成功率。冠状病毒则不同,现有的证据已经表明,它可以利用多种钥匙去开同一把锁!

来源:微博
由此可以看出,冠状病毒是一种突变适应能力极强的病毒。随着疫苗的广泛普及,可以预见,“逃避免疫”会是新冠病毒未来演变的主要方向,重要性甚至超过传播能力。
既然病毒会产生更强的抗免疫变种,疫苗接种的意义何在呢?
首先,疫苗可以产生多克隆反应。疫苗产生的不是一种类型的抗体,而是多种抗体。
当一种类型的抗体因病毒突变而保护作用降低,另一种抗体的作用可能就会显现。
辉瑞和Moderna的疫苗使人体中产生了大量针对SARS病毒的抗体,而SARS病毒与新冠病毒的差异远大于各变异株之间的差异。这有力说明了新冠疫苗诱导的体液免疫是广谱的。

来源:网易
其次,抗体介导的体液免疫也仅仅是疫苗的部分作用,更重要的是疫苗可以激活细胞免疫。
学界认为,冠状病毒有能力突破抗体屏障,但突破T细胞屏障几乎不可能,除非像HIV那样直接寄生在T细胞里面。
因此关键在于,疫苗接种后的细胞免疫可以维持多久。其实,细胞免疫的持久性往往高于体液免疫。研究发现,新冠病毒感染后7个月,抗体免疫应答下降,但T细胞免疫仍持续。近20年前感染SARS病毒的人仍然具有识别该病毒的T细胞!
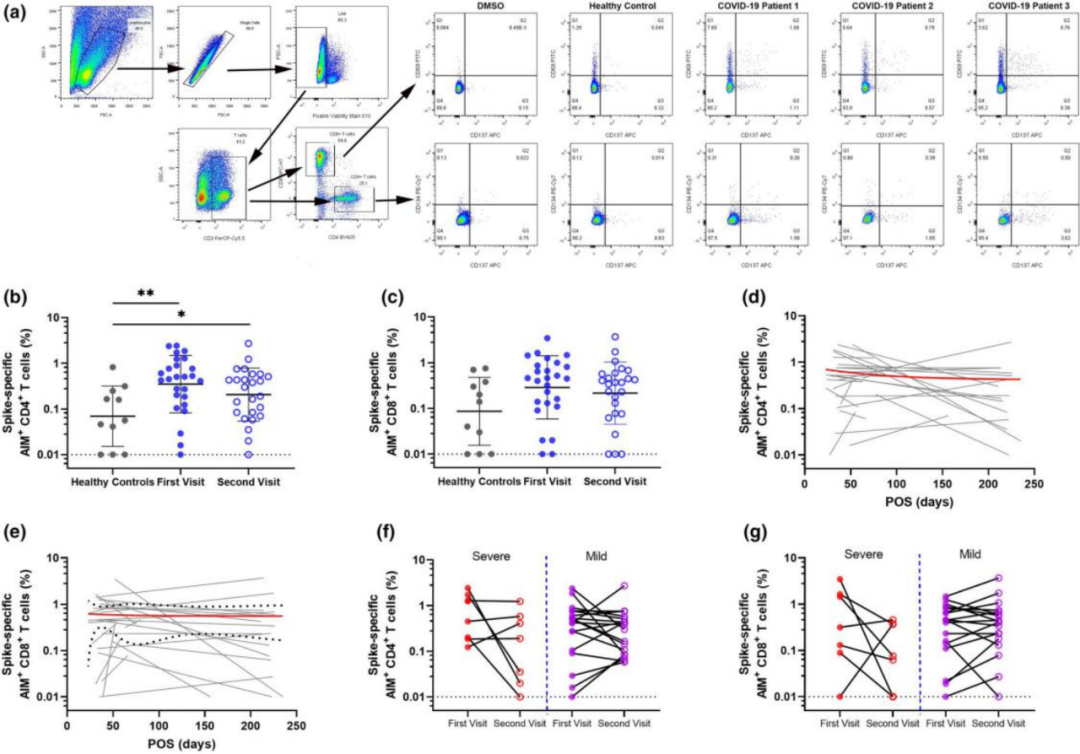
T细胞免疫持续存在。doi: 10.1002/cti2.1319. eCollection 2021.
但目前对疫苗效果的评价还局限在体液免疫水平。正如钟南山院士所说,疫苗如何通过细胞免疫发挥作用是未来非常重要的研究课题。这对研发可以更有效地激活细胞免疫的疫苗来说至关重要,也是我们破局的法宝。
但无论疫苗如何发挥作用,基础都是全民接种。在接种率不足的社会中,未接种者成为了病毒的变异储存库,接种者反而会成为病毒突变试错的训练场,这会让疫苗“助纣为虐”,Delta变异株正是前车之鉴。只有全民接种才能让病毒没有足够的时间完成进化。
尽管病毒进一步变异可能不可避免,疫苗依然是我们最有效的武器,对新变种我们应该提高警惕,但大可不必悲观。
参考文献
1、Amalio Telenti, et al. After the pandemic: perspectives on the future trajectory of COVID-19. Nature. 2021. doi: 10.1038/s41586-021-03792-w.
2、Anthony T DiPiazza, et al. T cell immunity to SARS-CoV-2 following natural infection and vaccination. Biochem Biophys Res Commun. 2021. doi: 10.1016/j.bbrc.2020.10.060.


