顾宁院士/徐标/何泓良团队《ACS Nano》:PSC包覆的普鲁士蓝纳米酶有效治疗心肌缺血再灌注损伤
时间:2025-02-08 12:08:40 热度:37.1℃ 作者:网络
心血管疾病是危害人类健康最严重的疾病之一,具有高发病率和死亡率的急性心肌梗塞就是最突出的表现。心肌缺血时,心肌组织大面积受损,心肌细胞坏死、凋亡,由于心肌细胞增殖能力低下,心肌组织受损区域无法有效再生和修复。1发生急性心肌梗死时,及时把握短暂的治疗时间窗口进行再灌注治疗,例如经皮冠状动脉介入(PCI)治疗,重开闭塞或狭窄的心外膜冠状动脉,恢复缺血组织中的冠状动脉血流,有效避免心肌细胞死亡,是首选治疗策略。2然而,再灌注治疗的疗效往往由于再灌注导致的过量活性氧(ROS)引起的氧化应激损伤和炎性反应而大打折扣,这就是所谓的缺血再灌注损伤。这种损伤可能发展为慢性心力衰竭,5年死亡率超过50%。3同时缺血再灌注损伤还会导致PCI术后预后较差,据统计,急性心肌梗死病人进行PCI后,大约有60-70%的病人仍然存在心肌缺血再灌注损伤介导的冠状微血管阻塞(MVO),4这严重影响病人的生活质量。心肌缺血再灌注损伤的发病机制十分复杂,目前研究较多的机制包括氧化应激、炎症浸润和钙超载。就损伤机制而言,ROS清除和抗心肌炎症是心肌缺血再灌注损伤的首选治疗策略。目前有许多传统的抗氧化和抗炎药物5-8被开发用于心肌缺血再灌注损伤的治疗,但由于心脏组织独特的生理构造和血流动力学,传统药物很难在心肌组织进行长时间的驻留而达到有效的治疗浓度,往往需要大剂量给药,因此治疗效果和安全性并不让人满意。去开发更好的用于心肌缺血再灌注损伤治疗的策略是迫切需要的。与传统药物相比,纳米药物的潜在的渗透与保留(EPR)效应可以使其在受损心肌因血管泄露而聚集在心肌组织,9同时纳米药物可以增强靶向性、精确控制释放,提高难溶性药物的溶解度和吸收率,降低药物不良反应,提高生物安全性。10因此,纳米药物可能是心肌缺血再灌注损伤治疗的一个有前景的策略。
普鲁士蓝是由Fe2+-CN-Fe3+混合价态的配位网络组成的一种金属有机骨架化合物,是历史悠久的古老的深蓝色颜料,也是人类使用安全性良好的材料。112003年,美国FDA正式批准可溶性普鲁士蓝用于重金属铊和铯中毒的救治,目前普鲁士蓝在世界卫生组织(WHO)官网上更新的一份应对“辐射和核紧急情况”的建议药物储备清单中。随着纳米科学和纳米技术的不断创新,普鲁士蓝纳米颗粒(PBNPs)表现出独特性能和优异生物相容性,广泛应用于生物医学领域。12普鲁士蓝纳米颗粒也是一种纳米酶,2016年,顾宁教授课题组发现PBNPs具有类过氧化氢酶(ACT)、类过氧化物酶(POD)和类超氧化物歧化酶(SOD)等多种类酶活性,具有高效的ROS清除能力。13很多心血管疾病,例如动脉粥样硬化,血栓、心梗、心肌缺血再灌注损伤和MVO等,其发生和ROS的过度形成有关,因此基于优异的类酶活性清除ROS以及良好的生物相容性和安全性,普鲁士蓝纳米酶对心血管疾病的治疗表现巨大潜力.14-16
近期,南京大学顾宁教授、南京大学附属鼓楼医院心内科徐标教授以及东南大学生物科学与医学工程学院何泓良教授等人联合开发了一种使用聚葡萄糖山梨醇羧甲基醚(PSC)包覆的普鲁士蓝纳米酶(PBNz@PSC),用于小鼠心肌缺血再灌注损伤的治疗。该研究不仅揭示了PBNz@PSC在心肌缺血再灌注损伤(MIRI)治疗中的多重作用机制,还为其在临床转化中的应用提供了全新的思路(图1)。

图1. PBNz@PSC用于心肌缺血再灌注损伤治疗的示意图。
本研究使用临床用于缺铁性贫血治疗的静脉补铁剂Ferumoxytol的表面包覆物PSC作为保护剂,合成了PSC包覆的普鲁士蓝纳米酶(PBNz@PSC)。首先PSC表面暴露的羧基与三价铁离子配位结合,随后与亚铁氰化钾配位聚合形成普鲁士蓝纳米酶。PSC的使用,使PBNz的结构更加稳定,具有良好的生物形容性和安全性。除此之外,PSC属于多糖,其末端的半羧醛羟基具有抗氧化应激的作用,使得PBNz@PSC具有增强的类SOD酶活。而PSC表面暴露的羧基,也为PBNz@PSC功能化修饰提供了基础。研究通过透射电子显微镜(TEM)、高分辨透射电镜(HRTEM)、X-射线衍射(XRD)和红外光谱等技术对其形貌和结构进行了详细表征(图2)。PBNz@PSC展现出多种类酶活性,包括过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活性,能够有效清除活性氧(ROS)和自由基,为后续的生物医学应用奠定了基础。
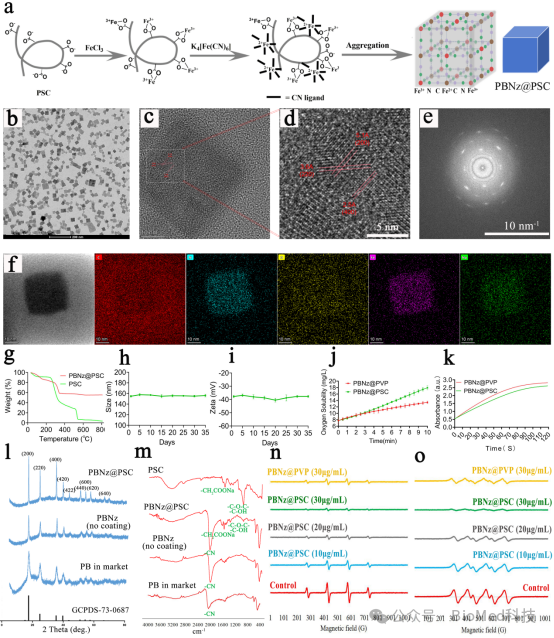
图2:PBNz@PSC的合成与表征,及类酶性质。
在细胞实验中,PBNz@PSC能够很好的被心肌细胞(HL-1)和巨噬细胞(RAW 264.7)所摄取,并具有良好的细胞安全性。除此之外,它表现出明显的细胞内ROS清除效果,并能够使促炎型M1巨噬细胞向抑炎型M2巨噬细胞极化,起到良好的抗炎作用。为了更好的在体外模拟心肌缺血再灌注损伤的病理环境,本研究使用HL-1细胞构建了缺氧、复氧(H/R)细胞模型,通过流式细胞术和荧光探针检测,研究发现PBNz@PSC能够显著降低缺氧/复氧(H/R)损伤模型细胞中的ROS水平,从而减轻氧化应激对细胞的损伤。此外,PBNz@PSC还能调控H/R损伤模型细胞中炎症因子的表达,降低IL-6、IL-1β和TNF-α等炎症因子的水平,抑制炎症反应,起到抗凋亡的作用(图3)。
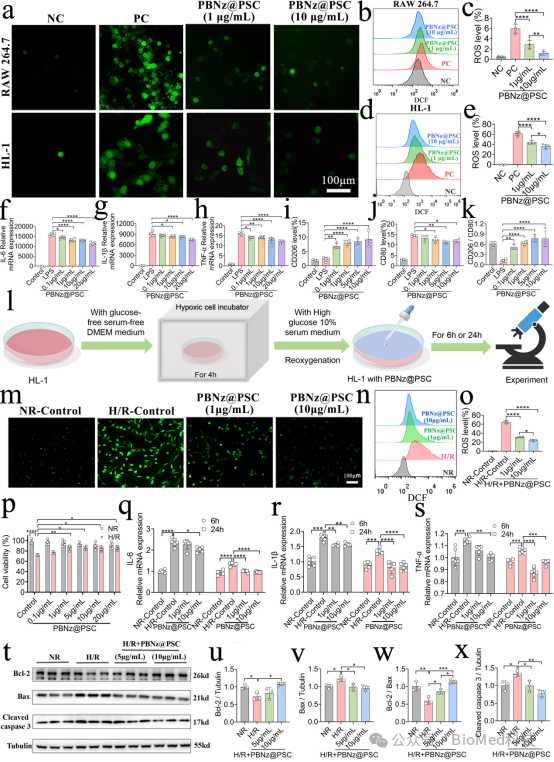
图3. PBNz@PSC对细胞中ROS清除、巨噬细胞极化、抗炎和抗凋亡的作用。
进一步,该研究构建了心肌缺血再灌注损伤的小鼠模型,将PBNz@PSC注射至模型小鼠体内后,研究发现PBNz@PSC可以通过EPR效应被动靶向至受损心肌,促进心肌组织中促炎型M1巨噬细胞向抗炎型M2巨噬细胞极化,起到很好的抗炎作用,有效挽救受损心肌。除此之外,PBNz@PSC还可以有效清除心肌组织中ROS,减少心肌凋亡,心肌梗死以及冠状微血管阻塞(MVO)的发生(图4)。经过14天的治疗后,PBNz@PSC能够减少心肌纤维化和心肌肥大,有效改善心功能(图5)。该研究在动物实验中,还选用临床上用于冠心病、心绞痛和心肌梗死治疗的丹参酮IIA磺酸钠注射液作为阳性药物进行对比,结果显示PBNz@PSC表现出更好的治疗效果,而两者协同使用治疗效果更佳。动物实验还显示PBNz@PSC不会改变重要器官(心、肝、脾、肺和肾)的组织学形态,对肝功能、肾功能、凝血指标及血清无机离子均无影响,具有良好的生物安全性。
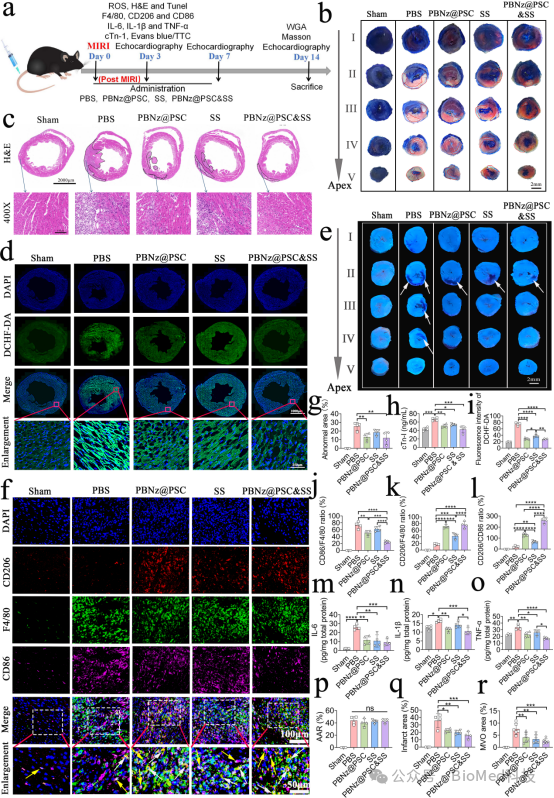
图4. PBNz@PSC体内治疗策略与治疗效果。
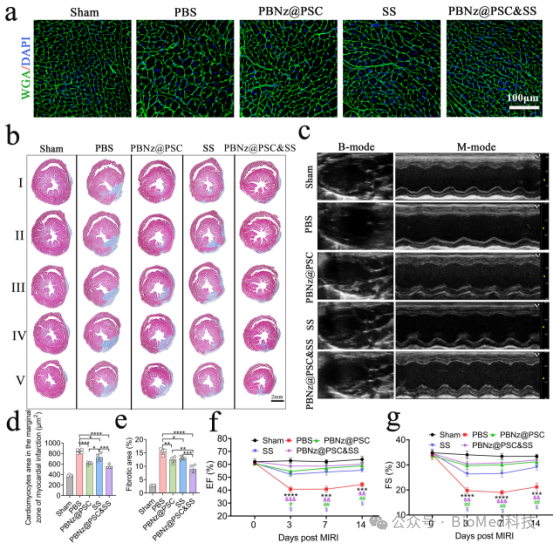
图5. 心肌缺血再灌注损伤模型小鼠经PBNz@PSC治疗14天后的治疗效果。
根据上述实验结果,PBNz@PSC对心肌缺血再灌注损伤表现出良好的治疗效果,为了弄清其潜在的治疗机制,该研究通过对不同治疗组小鼠受损心肌组织进行转录组基因测序分析,揭示了PBNz@PSC治疗心肌缺血再灌注损伤的潜在分子机制。模型小鼠经PBNz@PSC治疗后,心血管疾病、AMPK信号通路、脂质代谢、线粒体功能、氧化还原酶活性和细胞凋亡过程相关的异常基因得到显著逆转。此外,KEGG-GO富集弦图证实了这些关键功能和通路之间的互联互通,表明PBNz@PSC的心脏保护作用是通过多种机制的组合来介导的。其中,AMPK信号通路在心肌缺血再灌注损伤的治疗中起着至关重要的调控作用。它不仅是细胞内能量代谢的重要调节器,而且激活后还能通过抗氧化应激、内质网应激、抑制细胞凋亡、调节自噬、抗炎等心肌保护作用缓解心肌缺血再灌注损伤。随后结合在H/R损伤细胞模型和心肌缺血再灌注损伤的动物模型上进行的Western Blot实验,最终预测了PBNz@PSC可能的治疗机制(图6)。首先,注射PBNz@PSC后,EPR效应引导其通过受损的血管网络优先靶向并聚集在受损的心肌组织中。进入心肌细胞后,PBNz@PSC利用其类CAT和SOD酶活清除ROS,从而产生氧气以缓解梗死心肌内的缺氧。另一方面,PBNz@PSC可以激活AMPK信号通路,促进eNOS的表达,产生NO以舒张血管,并抑制NF-κB信号通路,下调促炎细胞因子(IL-6、IL-1β和TNF-α)的转录,发挥抗炎作用。此外,PBNz@PSC清除ROS产生的氧气和NF-κB通路的抑制导致HIF-1α表达降低,这进一步导致促炎因子iNOS表达降低,提供了额外的抗炎作用。这一系列相互关联的作用最终阻止了心肌细胞凋亡和坏死,成功挽救了受损的心肌。
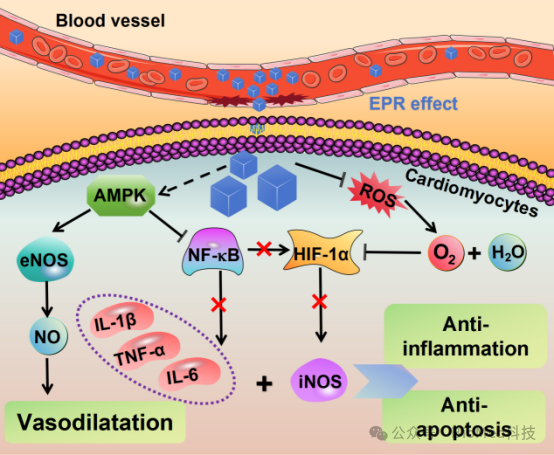
图6. PBNz@PSC治疗心肌缺血再灌注损伤的可能机制。
【结语】
PBNz@PSC的研究不仅为纳米酶在生物医学领域的应用提供了新的范例,也为心肌缺血再灌注损伤的治疗开辟了新的方向。随着研究的深入,PBNz@PSC有望成为新一代治疗心肌缺血再灌注损伤的有效工具,为患者带来福音。该工作以“Prussian Blue Nanozyme Featuring Enhanced Superoxide Dismutase-like Activity for Myocardial Ischemia Reperfusion Injury Treatment”为题目发表在ACS Nano杂志上,论文第一作者是东南大学生物科学与医学工程学院博士生龙朦朦,通讯作者为南京大学医学院顾宁教授、南京大学附属鼓楼医院心内科徐标教授和东南大学生物科学与医学工程学院何泓良教授。该研究感谢国家自然科学基金、科技部国家重点研发计划、江苏省前沿基础研究计划和南京市科技发展基金的资助。
参考文献:
1、Heusch, G.; Gersh, B. J., The pathophysiology of acute myocardial infarction and strategies of protection beyond reperfusion: a continual challenge. European Heart Journal 2017, 38 (11), 774-784.
2、Byrne, R. A.; Rossello, X.; Coughlan, J. J.; Barbato, E.; Berry, C.; Chieffo, A.; Claeys, M. J.; Dan, G. A.; Dweck, M. R.; Galbraith, M.; Gilard, M.; Hinterbuchner, L.; Jankowska, E. A.; Jüni, P.; Kimura, T.; Kunadian, V.; Leosdottir, M.; Lorusso, R.; Pedretti, R. F. E.; Rigopoulos, A. G.; Gimenez, M. R.; Thiele, H.; Vranckx, P.; Wassmann, S.; Wenger, N. K.; Ibanez, B.; Grp, E. S. C. S. D., 2023 ESC Guidelines for the management of acute coronary syndromes. European Heart Journal 2023, 44 (38), 3720-3826.
3、 Zhao, T. J.; Wu, W.; Sui, L. H.; Huang, Q.; Nan, Y. Y.; Liu, J. H.; Ai, K. L., Reactive oxygen species-based nanomaterials for the treatment of myocardial ischemia reperfusion injuries. Bioact Mater 2022, 7, 47-72.
4、 Galli, M.; Niccoli, G.; De Maria, G.; Brugaletta, S.; Montone, R. A.; Vergallo, R.; Benenati, S.; Magnani, G.; D'Amario, D.; Porto, I.; Burzotta, F.; Abbate, A.; Angiolillo, D. J.; Crea, F., Coronary microvascular obstruction and dysfunction in patients with acute myocardial infarction. Nat Rev Cardiol 2024, 21, 283-298.
5、Zhang, L. P.; Zhang, Y.; Yu, X. F.; Xu, H. L.; Sui, D. Y.; Zhao, X. Z., Alprostadil attenuates myocardial ischemia/reperfusion injury by promoting antioxidant activity and eNOS activation in rats. Acta Cir Bras 2018, 33 (12), 1067-1077.
6、Liang, S.; Ping, Z.; Ge, J., Coenzyme Q10 Regulates Antioxidative Stress and Autophagy in Acute Myocardial Ischemia-Reperfusion Injury. Oxid Med Cell Longev 2017, 2017, 9863181.
7、Fan, Q.; Tao, R.; Zhang, H.; Xie, H. Y.; Lu, L.; Wang, T.; Su, M.; Hu, J.; Zhang, Q.; Chen, Q. J.; Iwakura, Y.; Shen, W. F.; Zhang, R. Y.; Yan, X. X., Dectin-1 Contributes to Myocardial Ischemia/Reperfusion Injury by Regulating Macrophage Polarization and Neutrophil Infiltration. Circulation 2019, 139 (5), 663-678.
8、 Wallert, M.; Ziegler, M.; Wang, X. W.; Maluenda, A.; Xu, X. Q.; Yap, M. L.; Witt, R.; Giles, C.; Kluge, S.; Hortmann, M.; Zhang, J. X.; Meikle, P.; Lorkowski, S.; Peter, K., α-Tocopherol preserves cardiac function by reducing oxidative stress and inflammation in ischemia/reperfusion injury. Redox Biol 2019, 26, 101292.
9、 Yang, L.; Peng, J.; Shi, A.; Wang, X.; Li, J.; Su, Y.; Yin, K.; Zhao, L.; Zhao, Y., Myocardium-Targeted Micelle Nanomedicine That Salvages the Heart from Ischemia/Reperfusion Injury. ACS Applied Materials & Interfaces 2022, 14 (34), 38562-38574.
10、 Nguyen, M. M.; Carlini, A. S.; Chien, M. P.; Sonnenberg, S.; Luo, C. L.; Braden, R. L.; Osborn, K. G.; Li, Y. W.; Gianneschi, N. C.; Christman, K. L., Enzyme-Responsive Nanoparticles for Targeted Accumulation and Prolonged Retention in Heart Tissue after Myocardial Infarction. Adv Mater 2015, 27 (37), 5547-5552.
11、 Lu, K.; Zhu, X. Y.; Li, Y.; Gu, N., Progress in the preparation of Prussian blue-based nanomaterials for biomedical applications. J Mater Chem B 2023, 11 (24), 5272-5300.
12、 Wang, Y. H.; Liang, Z. H.; Liang, Z. Y.; Lv, W. F.; Chen, M.; Zhao, Y., Advancements of Prussian blue-based nanoplatforms in biomedical fields: Progress and perspectives. Journal of Controlled Release 2022, 351, 752-778.
13、 Zhang, W.; Hu, S. L.; Yin, J. J.; He, W. W.; Lu, W.; Ma, M.; Gu, N.; Zhang, Y., Prussian Blue Nanoparticles as Multienzyme Mimetics and Reactive Oxygen Species Scavengers. J Am Chem Soc 2016, 138 (18), 5860-5865.
14、 He, H. L.; Long, M. M.; Duan, Y. F.; Gu, N., Prussian blue nanozymes: progress, challenges, and opportunities. Nanoscale 2023, 15 (31), 12818-12839.
15、Zhang, W. L.; Wang, J. R.; Xie, Z. Y.; Zou, H. M.; Chen, Q. Q.; Xu, L.; Hu, L.; Fang, N.; Xu, J.; Zhou, J.; Liu, J.; Ran, H. T.; Wang, Z. G.; Zhang, Y.; Guo, D. J., Antithrombotic Therapy by Regulating the ROS-Mediated Thrombosis Microenvironment and Specific Nonpharmaceutical Thrombolysis Using Prussian Blue Nanodroplets. Small 2022, 18 (15), 2106252.
16、Feng, L. S.; Dou, C. R.; Xia, Y. G.; Li, B. H.; Zhao, M. Y.; El-Toni, A. M.; Atta, N. F.; Zheng, Y. Y.; Cai, X. J.; Wang, Y.; Cheng, Y. S.; Zhang, F., Enhancement of Nanozyme Permeation by Endovascular Interventional Treatment to Prevent Vascular Restenosis via Macrophage Polarization Modulation. Adv Funct Mater 2020, 30 (52), 2006581.
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c14445


