重磅!江中医突破性研究:黄芩素成功缓解急性呼吸窘迫综合征!
时间:2025-02-02 12:09:11 热度:37.1℃ 作者:网络
葡萄球菌肠毒素B(SEB)是一种超抗原,具有高度传染性,能引发致命的肺部炎症,暴露于SEB后,大量表达特异性Vβ特异性的T细胞被激活,容易导致大量细胞因子风暴和毒性反应,吸入SEB可引发急性肺损伤/急性呼吸窘迫综合征(ALI/ARDS),这是一种危及生命的疾病,其特征是严重的肺部炎症、促炎细胞因子的产生增加、氧合受损和肺屏障破裂。遗憾的是,目前尚无特异性和有效的药物能够保护SEB介导的肺部炎症细胞因子风暴。
诸多证据揭示,肠道微生物群能够通过肺-肠轴对肺部疾病的发展产生影响。呼吸系统与胃肠道上皮细胞的共同胚胎起源进一步强化了二者之间的联系。短链脂肪酸(SCFAs),作为肠道微生物的主要代谢产物,是宿主与微生物互惠共生关系中的关键因素。这些分子,包括乙酸、丁酸和丙酸,作为G蛋白偶联受体的配体,已被证实能够影响肠道微环境以及宿主的代谢过程。
黄芩素(5,6,7-三羟基黄酮,BAI)是一种从膳食中提取的黄芩类黄酮,在中国及东南亚地区传统上用作治疗炎症性疾病的辅助药物。有研究表明,BAI是口服黄芩发挥其清除肺部炎症作用的关键活性成分。广泛的研究已经探讨了BAI缓解肺部炎症的疗效及其作用机制。然而,与多数黄酮类化合物相似,BAI的口服生物利用度存在局限性。
日前,一篇名为“Baicalein ameliorates SEB-induced acute respiratory distress syndrome in a microbiota-dependent manner”的研究论文评估了BAI在ARDS小鼠中的治疗效果及其潜在机制。

图1 论文首页
BAI可抑制SEB诱导的肺细胞因子风暴的进展
首先,该研究对小鼠实施了双剂量SEB暴露实验。组织病理学结果显示,BAI能显著改善肺组织结构,使肺泡壁变薄,并减少炎症细胞的浸润。肺组织病理学的四级分级系统评估结果表明,无论是30或60 mg kg-1剂量的BAI均能有效改善肺组织损伤的进展(图2A)。
肺部与胃肠道疾病常伴随发生,慢性阻塞性肺病(COPD)患者并发炎症性肠病的几率是普通人群的2-3倍。基于此,研究进一步观察了结肠组织的病理切片。结果显示,模型组小鼠表现出严重的结肠炎症症状,包括黏膜上皮细胞脱落、坏死、杯状细胞减少以及炎性细胞浸润。然而,在接受BAI处理的小鼠中,这些症状得到了显著缓解(图2B)。
此外,研究还测量了肺细胞因子和趋化因子的丰度。与对照组相比,模型组SEB感染后血清和肺组织中促炎性细胞因子(IFN-γ、TNF-α)水平均有所升高,而抗炎因子(TGF-β)水平则降低(图2C)。BAI能显著降低促炎细胞因子的水平,并同时提高抗炎因子的水平。趋化因子CCL2和CCL5也呈现出相似的变化趋势(图2D)。值得注意的是,BAI展现出与阳性药物DXMS相当的显著抑制作用,这表明其能有效抑制细胞因子风暴。
肺湿/干重量比评估结果表明BAI治疗显著减轻了肺水肿(图2E)。脾脏和胸腺在协调免疫反应中扮演关键角色,BAI对它们具有保护作用(图2F)。同时,流式细胞分析证实,与SEB组相比,BAI组CD8和CD4 T细胞的积累百分比有所下降(图2G)。此外,给予BAI能有效降低SEB引起的白细胞和Gran水平的升高,同时提高红细胞和HGB水平(图2H)。这些综合结果强调了BAI在减轻SEB介导的肺部炎症和诱导肺部免疫止血方面的重要作用。
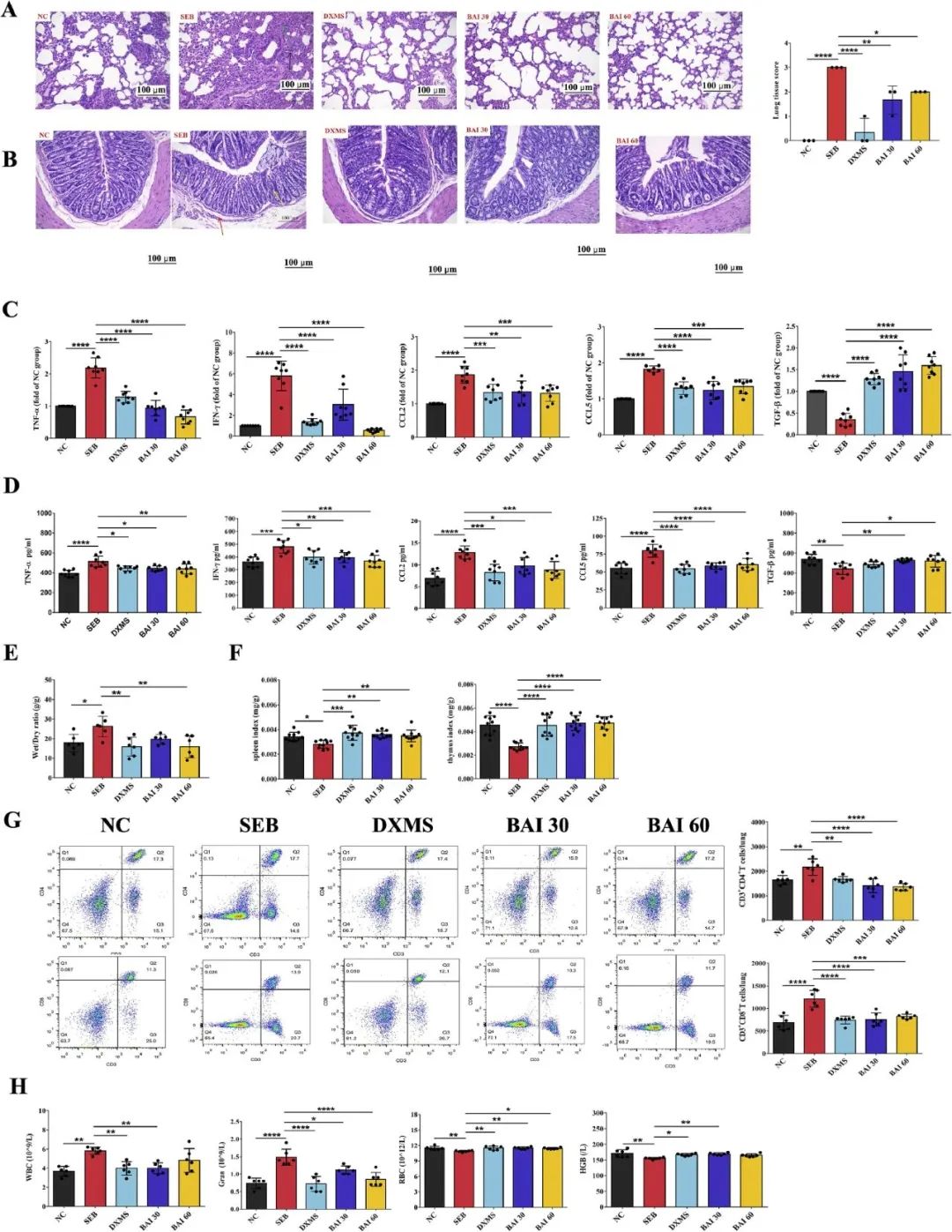
图2 BAI对ALI/ARDS相关症状和炎症的影响
BAI可恢复SEB对肺屏障功能的损害
气血屏障作为宿主的关键内部防线,主要由紧密连接蛋白构成,对于抵御病原体的侵袭发挥着至关重要的作用。在SEB暴露的小鼠体内,ZO-1、claudin和occludin-1的mRNA表达显著降低,而经过BAI处理的组别(30和60 mg/kg-1)则能够显著逆转这种降低(图3A)。
而气道黏液作为一道防御屏障,在保护呼吸道上皮免受外界环境影响方面扮演着至关重要的角色。研究结果显示,BAI导致MUC5b和MUC2的表达显著提升,同时抑制了MUC5ac的表达(图3B-D)。
总之,BAI对紧密连接蛋白和黏蛋白表达的调节作用,进而对改善肺屏障功能产生了积极的影响。
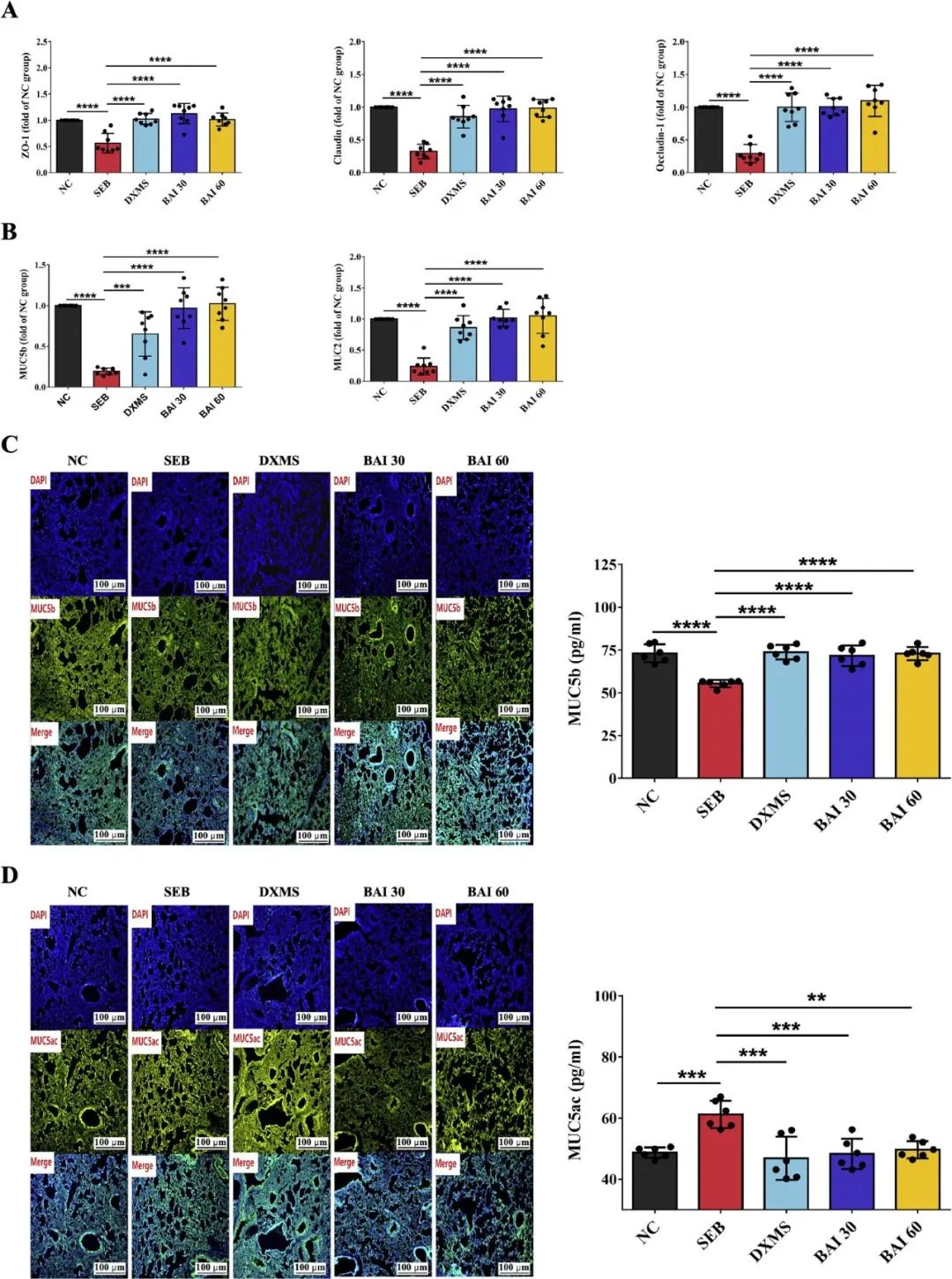
图3 BAI对ALI/ARDS中紧密连接蛋白和黏蛋白的影响
BAI增加SCFA的产生和FFAR2、FFAR3的表达
SCFA是肠道菌群的主要代谢产物,通过宿主-微生物代谢轴对宿主产生深远影响,激活或抑制信号通路,调节肠道乃至远端的多种代谢途径。为探究SCFA与肺部炎症之间的关联性,研究采用气相色谱-质谱联用(GC-MS)技术对粪便样本中的SCFA含量进行了测定。结果显示,丙酸是粪便样本中含量最高的SCFA。经BAI处理后,可恢复SEB引起的SCFA水平下降。尤其是,与SEB组相比,BAI处理后粪便中乙酸、丙酸、丁酸和戊酸的浓度均有显著提升(图4A)。
研究采用了定量实时聚合酶链反应(qRT-PCR)技术测定了肺组织中FFAR3和FFAR2的mRNA表达水平。与对照组(NC组)相比,SEB处理后FFAR3和FFAR2的表达显著下降(图4B)。然而,BAI治疗显著逆转了这种下降趋势。综上所述,BAI通过激活肺上皮细胞中的FFAR3和FFAR2受体,响应肠道微生物结构的改变和SCFA产量的增加,从而减轻肺部炎症。
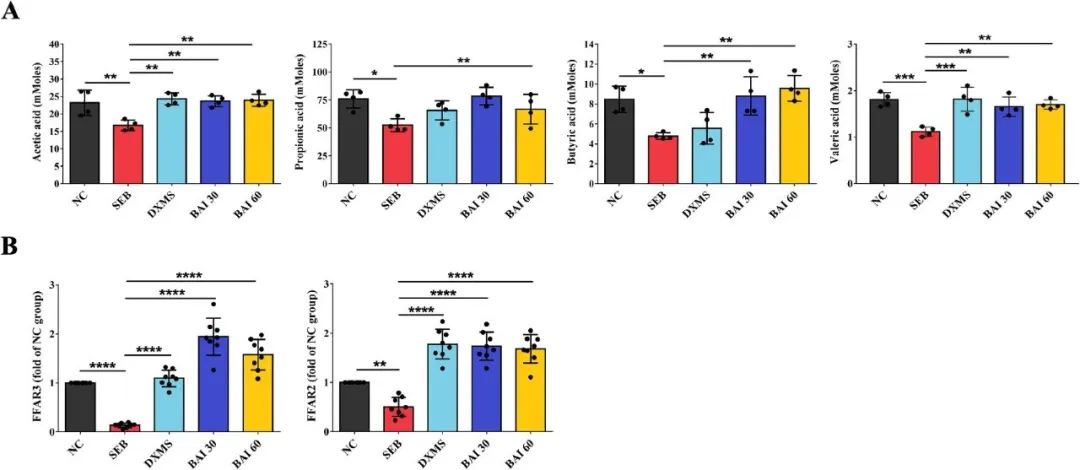
图4 BAI对ALI/ARDS中短链脂肪酸和FFAR的影响
BAI以肠道微生物群依赖的方式缓解ALI/ARDS
为了验证BAI对肺部炎症的保护作用是否依赖于肠道微生物的存在,研究对小鼠进行了为期四周的抗生素治疗(ABX),从而构建了一个假无菌模型(图5A)。在缺乏肠道微生物的情况下,BAI的治疗效果完全丧失。肺组织结构损伤、炎症因子(IL-6、IL-8和IL-1β)表达、肺干湿重量比、脏器指数以及SCFA水平方面,ABX+BAI组与SEB组之间未发现显著差异(图5B-F)。
结果表明,BAI通过依赖肠道微生物群的方式减轻了SEB诱发的ALI/ARDS。此外,肺组织中紧密连接蛋白(ZO-1、claudin和occludin-1)以及黏蛋白(MUC5b和MUC2)的mRNA表达水平也显示,抗生素干预阻碍了BAI治疗的改善作用(图5G-J)。总之,肠道微生物群在BAI的保护作用中扮演了不可或缺的角色,凸显了它们作为治疗靶点的重要性。
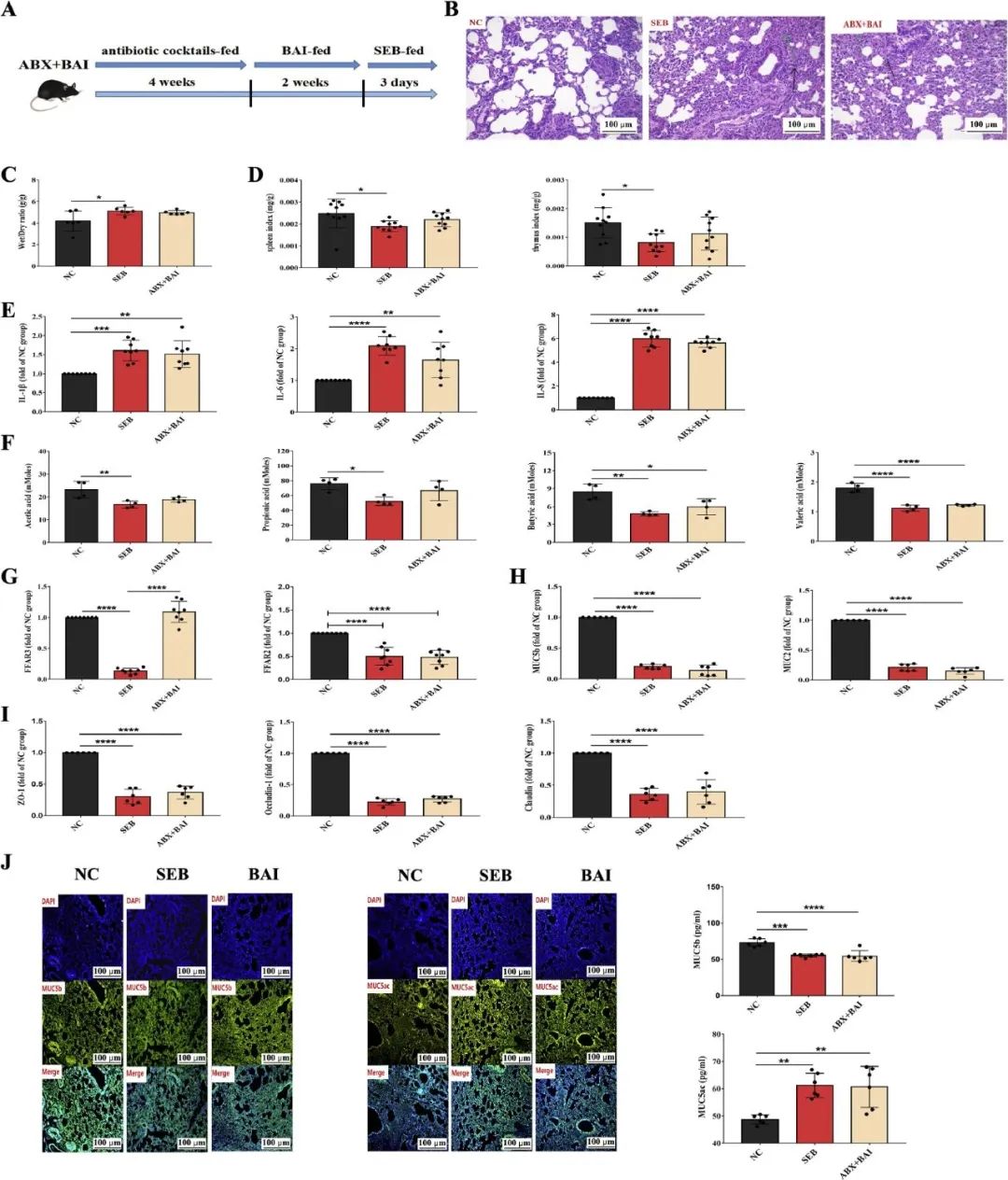
图5 BAI对抗生素鸡尾酒治疗的ALI/ARDS症状和炎症的影响
结论
该研究首次对BAI通过肠道微生物群依赖机制减轻ALI/ARDS的潜力进行了探讨,结果显示BAI的抗炎作用与其调节肠道微生物菌群失衡、恢复肺上皮的完整性、增强上皮细胞功能、提升SCFAs的产量以及上调FFAR2和FFAR3表达的能力紧密相关。
参考文献:
Hu T, Zhu Y, Zhou X, Ye M, Wang X, Lu C, Wang Y. Baicalein ameliorates SEB-induced acute respiratory distress syndrome in a microbiota-dependent manner. Phytomedicine. 2024 Dec;135:156049. doi: 10.1016/j.phymed.2024.156049


