JCI:单核细胞与间质巨噬细胞促进肺动脉高压
时间:2025-02-02 12:08:25 热度:37.1℃ 作者:网络

缺氧诱导的肺动脉高压(hypoxic PH)是一种常见的心血管疾病,由高海拔(HA)暴露和肺部疾病引起。研究证据表明,炎症在缺氧性 PH 的发病过程中起着重要作用,无论是在人体还是在实验动物模型中。骨髓(BM)来源的单核细胞和巨噬细胞(Mø)浸润肺血管和血管周围外膜区域,促进缺氧性 PH 中的肺血管重塑。这些单核细胞和 Mø 可能通过促炎性细胞因子和生长因子的表达,与肺血管细胞相互作用,从而促进疾病的发展。
间质巨噬细胞(IMs)是感知缺氧并驱动炎症性肺病变的关键细胞。在缺氧小鼠 PH 模型中,来源于骨髓的循环单核细胞被招募至肺部,并分化为 IMs。这些被招募的 IMs 表达基质细胞蛋白血小板反应蛋白-1(TSP-1),后者可激活 TGF-β,并通过 Rho 激酶依赖机制促进缺氧性 PH 的发生。
尽管 IMs 在 PH 的发病生物学中可能具有重要作用,但单核细胞在缺氧环境下被招募至肺部并导致 PH 的具体机制仍不清楚,包括相关的信号通路尚未明确,以及哪些单核细胞前体亚群最终分化为表达 TSP-1 的 IMs 仍未被定义。因此,我们的研究旨在阐明骨髓与肺部之间的炎症分子信号传导机制,我们推测这一过程发生在缺氧暴露的早期阶段。此外,我们还试图在最近描述的具有自我更新能力的驻留 IMs 背景下,进一步表征 TSP-1+ IMs,这些驻留 IMs 以叶酸受体 β(FOLR2)等细胞表面蛋白为标志。
在小鼠髓样细胞谱系中,最近被鉴定出的共同单核细胞祖细胞(cMoPs)来源于骨髓中的单核细胞和树突状细胞祖细胞(MDPs),它们可生成经典单核细胞。这些经典单核细胞以高表达淋巴细胞抗原 6c(Ly6c)和 CC 趋化因子受体-2(CCR2)为特征。随后,这些 Ly6c⁺⁺CCR2⁺ 经典单核细胞可转变为非经典单核细胞(Ly6c⁻CX3CR1⁺),其特征是 Ly6c 表达水平降低,而裂隙趋化因子受体(CX3CR1)表达增加。人类的单核细胞亚群也类似地通过 CD14 和 CD16 表达进行区分。研究表明,经典单核细胞主要负责在血管内巡逻并向炎症部位归巢,而非经典单核细胞则在维持血管稳态方面发挥作用。骨髓中单核细胞前体的增殖及其向血液和组织的迁移是一个高度受调控的过程。CCR2 是经典单核细胞迁移至炎症组织所必需的受体。在多种趋化因子中,单核细胞趋化蛋白-1(MCP-1,也称为 CCL2)对 CCR2 具有最高的亲和力。越来越多的证据表明,CCL2 在炎症性疾病中具有病理作用,包括促进单核细胞从血液中外渗,并在炎症组织中激活被招募的单核细胞。然而,关于 CCL2 在 PH 发生中的细胞来源及其作用的数据仍然有限且存在争议。
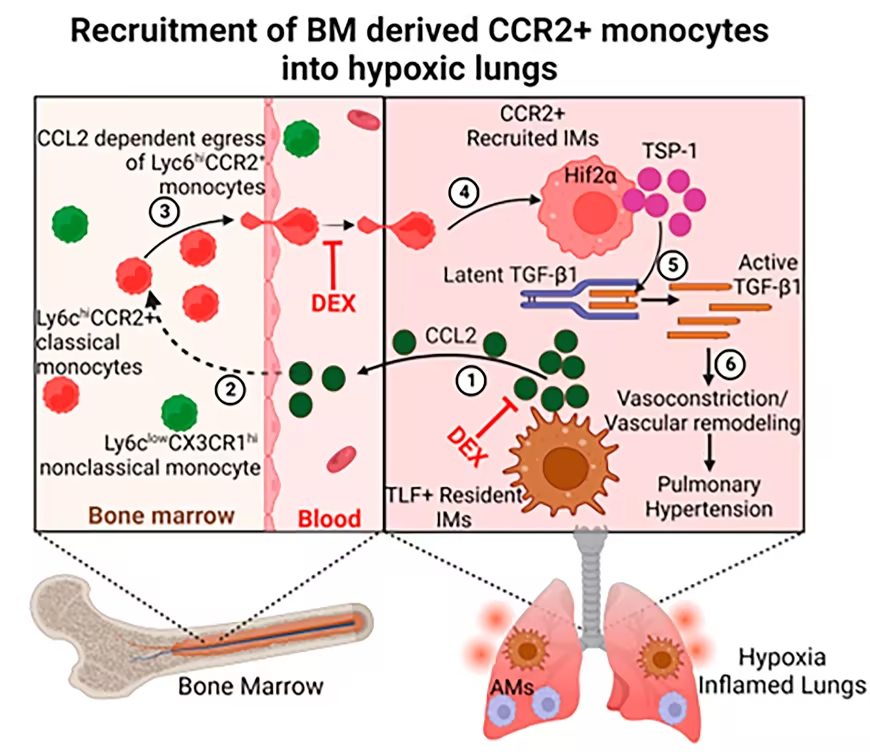
理解单核细胞和 Mø 信号传导的微妙平衡如何被破坏并导致缺氧性 PH,是当前研究中的一个关键知识空白,并具有重要的潜在临床意义。缺氧和高海拔诱导的炎症反应在临床上通过抗炎糖皮质激素地塞米松(DEX)的治疗得到了支持。DEX 被广泛用于治疗高海拔旅行者的急性缺氧性肺病,但其具体的临床获益机制尚不明确。临床前研究表明,DEX 通过减少血管平滑肌细胞增殖来改善和逆转实验性 PH,但这些研究使用的 DEX 剂量远高于临床使用剂量。虽然糖皮质激素也能抑制人类单核细胞和 Mø 的炎症细胞因子转录,并下调 CCL2 和 CCL7 等趋化因子的表达,但单核细胞和 Mø 这些趋化因子的表达是否以及如何影响 PH 仍然未知。因此,本研究通过整合人类和小鼠对缺氧的炎症反应,旨在阐明 DEX 预防性治疗如何通过抑制细胞因子表达及下游炎症免疫级联反应,提供对缺氧性 PH 的保护作用。
我们假设,在缺氧暴露后,骨髓中的 cMoPs 增殖并分化为经典单核细胞。这些经典单核细胞随后迁移至肺部,并分化为 TSP-1 产生的被招募肺 IMs,从而驱动 TGF-β 介导的 PH 发生。此外,我们还希望确定 DEX 预防性治疗是否通过调节 CCL2 梯度来影响经典单核细胞向肺部的募集,并通过抑制 TSP-1 和 TGF-β1 的表达来缓解缺氧性 PH,在小鼠模型和暴露于高海拔的人群中验证这一机制。
参考文献:Kumar R, Nolan K, Kassa B, Chanana N, Palmo T, Sharma K, Singh K, Mickael C, Fonseca Balladares D, Nilsson J, Prabhakar A, Mishra A, Lee MH, Sanders L, Kumar S, Molofsky AB, Stenmark KR, Sheppard D, Tuder RM, Gupta MD, Thinlas T, Pasha Q, Graham BB. Monocytes and interstitial macrophages contribute to hypoxic pulmonary hypertension. J Clin Invest. 2025 Jan 30:e176865. doi: 10.1172/JCI176865. Epub ahead of print. PMID: 39883518.


