Nature:工程化心肌:开启无需供体的心脏修复新时代
时间:2025-02-02 12:08:24 热度:37.1℃ 作者:网络
引言
心脏病仍然是全球范围内导致死亡和残疾的主要原因之一,尤其是心力衰竭(heart failure, HF),其治疗手段有限,许多患者最终只能依赖心脏移植。然而,供体心脏的严重短缺使得移植成为一项可望而不可及的治疗选择。因此,如何修复受损的心肌,恢复心脏的正常功能,成为了心血管医学领域最具挑战性的问题之一。近年来,随着再生医学(regenerative medicine)和生物工程技术(bioengineering)的快速发展,研究人员开始探索利用工程化心肌(engineered heart muscle, EHM)移植来修复衰竭的心脏,为心脏病患者带来新的希望。
1月29日Nature的研究报道“Engineered heart muscle allografts for heart repair in primates and humans”,通过诱导多能干细胞(induced pluripotent stem cells, iPSCs)分化出功能性心肌细胞(cardiomyocytes, CMs)和基质细胞(stromal cells, StCs),并利用这些细胞构建工程化心肌移植物(EHM allografts),成功在恒河猴(rhesus macaques)的慢性心力衰竭模型中实现了长期移植物存留,并显著增强了目标心室壁的收缩功能。更重要的是,该研究在大动物实验的基础上,还将这一创新疗法推进到了人类临床试验,成功在一名晚期心力衰竭患者中完成了首例移植,提供了直接的人体证据,证明EHM在心肌再生中的可行性和安全性。
这一突破性的研究不仅验证了EHM移植物能够在大动物和人类心脏中长期存活、增强心肌功能,而且表明其在适当的免疫抑制条件下不会引发严重的副作用,如心律失常(arrhythmia)或肿瘤生长(tumor growth),为未来的临床推广奠定了坚实的基础。这项研究的成功,不仅为心力衰竭患者提供了一种潜在的替代疗法,也象征着再生医学迈向临床应用的又一步跨越。未来,随着免疫耐受、血管化(vascularization)以及细胞成熟度等关键问题的进一步优化,EHM疗法有望成为心力衰竭治疗领域的一场革命。

心脏病治疗的新希望
心脏是人体的“发动机”,每分每秒都在为身体输送氧气和养分。然而,当心脏功能衰退,无法有效泵血时,就会导致心力衰竭(heart failure, HF)。据统计,全球约有超过6,400万名心力衰竭患者,每年仍在持续增长。心力衰竭不仅影响患者的生活质量,还显著提高了死亡率,即使在接受标准药物和器械治疗的情况下,五年生存率仍然较低。
当前的心力衰竭治疗手段主要包括药物治疗、机械辅助装置(如左心室辅助装置,LVADs)、心脏再同步治疗(CRT),以及在终末期患者中进行心脏移植(heart transplantation)。然而,这些方法各有局限。药物和机械装置只能缓解症状,无法真正修复受损的心肌组织。心脏移植虽然能够从根本上恢复心脏功能,但面临着两个核心问题:
-
供体短缺——每年全球只有极少数患者能够获得合适的供体心脏。
-
免疫排斥——即使成功移植,患者仍需终身服用免疫抑制药物,以降低移植物排斥的风险。
因此,研究人员一直在探索一种既能修复受损心肌、又能避免传统治疗弊端的创新疗法。
供体心脏短缺的困境:为什么我们需要新的解决方案?
心脏移植被认为是治疗终末期心力衰竭的“金标准”,但现实远比理想残酷。全球每年有数百万患者等待移植,但可供使用的心脏资源极度匮乏。例如,在美国,每年等待心脏移植的患者超过4,000人,但仅有约3,500例手术能够完成,而在其他国家,等待移植的时间可能更长,成功的概率也更低。即便幸运获得移植机会,供体心脏的质量、手术的复杂性以及术后免疫排斥等问题,仍然让移植患者面临巨大的挑战。
在这样的背景下,再生医学(regenerative medicine)被寄予厚望。研究人员设想,如果能够利用患者自身或其他来源的细胞,构建人工心肌组织,并将其移植到受损的心脏中,那么就可以绕过供体短缺的瓶颈,同时减少免疫排斥的风险。这种方法不仅能弥补传统心力衰竭治疗的不足,还可能彻底改变整个心血管治疗的格局。
再生医学与组织工程的崛起:人造心肌能否成为现实?
再生医学是一种利用细胞、基因或生物材料来修复或替换受损组织的前沿技术。在心血管领域,研究人员正尝试使用干细胞(stem cells)和组织工程技术(tissue engineering)来培育新生心肌,以填补心力衰竭患者的心脏损伤。其中,工程化心肌(Engineered Heart Muscle, EHM)成为了一项极具潜力的创新技术。
工程化心肌的核心理念是通过诱导多能干细胞(induced pluripotent stem cells, iPSCs),诱导其分化成心肌细胞(cardiomyocytes, CMs),再结合支持细胞(stromal cells, StCs)及生物支架,构建出类似天然心肌的“人造心脏组织”。这些组织不仅能像正常心肌那样跳动,还能被移植到患者心脏上,与宿主组织融合,从而修复受损区域。
工程化心肌(EHM):能否“重建”心脏?
工程化心肌(Engineered Heart Muscle, EHM)的基本理念是利用干细胞技术和组织工程,在实验室里制造具备自律跳动能力的心肌组织,并将其移植到患者心脏中,以恢复受损区域的功能。这项技术的突破,使得“用实验室培养的心肌来修补心脏”成为现实,而不再是科幻小说中的想象。
在该研究中,研究人员使用诱导多能干细胞(induced pluripotent stem cells, iPSCs),结合基质细胞(stromal cells, StCs)和生物材料,制造出可供移植的EHM。通过动物实验,他们证明了这些移植物不仅能够长期存活,还能与宿主心脏融合,并显著增强心肌收缩功能。
诱导多能干细胞(iPSCs):制造“个性化”心脏细胞的关键
EHM技术的成功,离不开诱导多能干细胞(iPSCs)的突破。iPSCs是一种由成熟体细胞(如皮肤或血液细胞)重编程而来的干细胞,它们可以分化为人体的各种细胞类型,包括心肌细胞(CMs)。这一技术的最大优势在于,它绕开了伦理争议,同时还可以制造“个性化”心肌组织,减少免疫排斥反应的风险。
在该研究中,研究人员采用了iPSCs来生成大量高质量的心肌细胞。这些细胞的特点包括:
-
节律性跳动:iPSCs衍生的心肌细胞能够自主产生电信号,使移植后的EHM能够真正发挥功能,而不仅仅是填补心脏的缺损。
-
同步收缩:通过优化细胞培养条件,这些心肌细胞可以像天然心脏组织那样协同收缩,增强心脏的泵血能力。
-
长期存活:实验表明,在恒河猴的心脏中,这些移植物不仅存活超过12周,还能持续增强心室收缩功能,提供了长期修复的可能性。
此外,研究人员发现,与传统的心肌修复手段相比,EHM技术在细胞存活率、组织整合性和功能恢复方面均表现更优。
组织工程如何让细胞变成“跳动的心肌”?
仅仅制造出心肌细胞是不够的,要让它们发挥作用,还需要借助组织工程技术(tissue engineering),让细胞形成类似天然心脏的结构,并具备相应的功能。EHM的构建涉及多个关键步骤:
细胞组合优化:在该研究中,研究人员发现,单独移植心肌细胞并不能有效改善心脏功能,因为这些细胞很难在宿主体内长期存活。因此,他们采用了心肌细胞(CMs)+基质细胞(StCs)的组合,借助基质细胞提供必要的生长因子和支持结构,显著提高了EHM的存活率和功能表现。
三维组织构建:研究人员利用先进的生物工程方法,使心肌细胞在生物支架(biomaterial scaffolds)或水凝胶(hydrogels)的支持下,形成三维组织结构。这种类似天然心肌的三维排列,使得EHM在移植后能够更好地与宿主心脏融合,并发挥功能。
电生理同步化:心脏的正常跳动依赖于心肌细胞的同步收缩,而如果移植的EHM不能与宿主心脏同步,则可能引发心律失常(arrhythmia)。研究人员通过调控离子通道蛋白的表达,使移植物能够快速适应宿主的电信号节律,从而避免心律失常的发生。
血管化(vascularization):心脏是一种高代谢器官,移植物必须能够迅速建立血液供应,否则将无法长期存活。在该研究中,研究人员观察到,在恒河猴模型中,移植的EHM能够与宿主心脏的血管网络建立连接,从而提供足够的营养和氧气,确保移植物的长期存活和功能发挥。
EHM:从实验室走向临床的关键突破
该研究的成果不仅验证了EHM的可行性,还在动物模型和首例人体实验中取得了成功。这表明,未来的心力衰竭治疗或许不再依赖供体心脏,而是可以通过“再生心脏组织”来直接修复受损区域。
然而,EHM要真正走向临床,还需要解决多个挑战:
-
提高细胞成熟度:目前实验室培养的心肌细胞在功能上仍与成年心肌细胞存在一定差距,如何让它们更接近真实心脏组织仍是研究热点。
-
优化血管化:确保移植物能迅速建立稳定的血液供应,提高长期存活率。
-
减少免疫排斥:尽管iPSCs来源的EHM可以个性化定制,但仍可能引发宿主的免疫反应,需要优化免疫抑制策略。
动物实验:让EHM真正“活”在心脏里
为何选择恒河猴?——从小鼠到灵长类动物的跨越
在再生医学研究中,研究人员往往会先在小鼠等啮齿类动物上进行初步实验,但小鼠的心脏生理、免疫系统以及心律调控机制与人类存在较大差异。因此,当EHM技术在小鼠实验中取得成功后,研究人员需要进一步验证其在更接近人类的动物模型中的有效性和安全性。
该研究选择了恒河猴(rhesus macaques)作为研究对象,这一决定基于以下几个重要因素:
-
与人类心脏的高度相似性:恒河猴的心脏解剖结构、心律调控方式以及血流动力学特征都更接近人类。
-
免疫系统的相似性:与小鼠相比,恒河猴的免疫反应更接近人类,使其成为研究异体细胞移植排斥反应的理想模型。
-
心力衰竭模型的稳定性:研究人员通过左前降支冠状动脉结扎(LAD ligation)诱导恒河猴发生慢性心力衰竭,从而模拟人类患者的病理状态。这种模型能够更准确地评估EHM移植物在受损心脏中的长期表现。
从小鼠到灵长类动物的跨越,不仅意味着EHM技术正在向临床应用迈进,也大幅提高了实验结果对人类的参考价值。
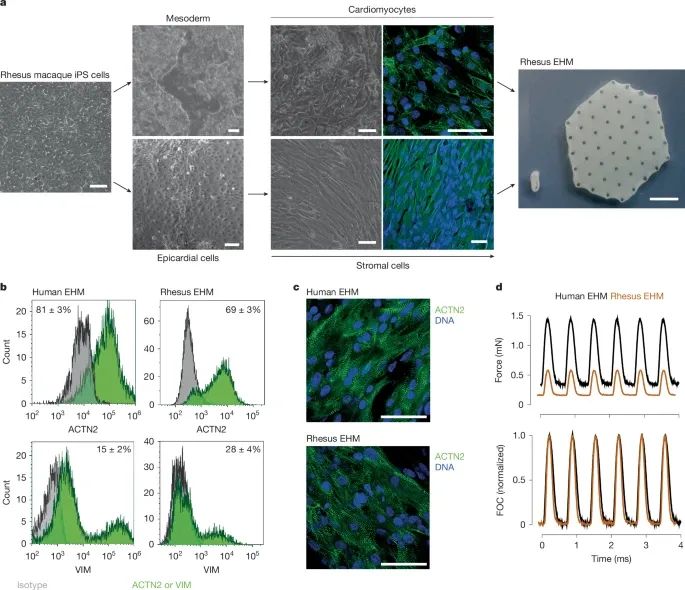
恒河猴EHM的配制与特性分析(Credit: Nature)
1. 恒河猴EHM的构建过程(a)
该部分描述了从恒河猴诱导多能干细胞(iPSCs)开始,如何分化生成心肌细胞(CMs)和基质细胞(StCs),并最终构建EHM。具体流程如下:
干细胞分化:研究人员首先使用中胚层诱导(mesoderm induction)策略,使恒河猴iPSCs向心肌细胞(CMs)和基质细胞(StCs)分化。第10天和第22天,研究人员使用免疫荧光染色检测心肌细胞中肌节肌动蛋白(sarcomeric actinin, ACTN2,绿色)的表达,确认其心肌表型。第20天,通过表皮-间充质转分化(epithelial-to-mesenchymal transition, EMT)诱导,促进基质细胞(StCs)的形成,并通过波形蛋白(vimentin, VIM,绿色)染色进一步确认。
EHM的构建:研究人员将分化后的心肌细胞(CMs)和基质细胞(StCs)嵌入I型牛胶原水凝胶(bovine collagen type I hydrogels),并铸造成特定形态的支架,以培养形成EHM。EHM的两种培养模式:环状EHM(450 µL体积):用于收缩功能测试,评估其生理特性。贴片状EHM(8 mL体积):用于恒河猴心脏移植实验,评估其在活体内的表现。
此外,该研究还采用相同的实验流程构建了人类EHM,以便在后续试验中进行比较分析。
2. EHM的细胞组成分析(b)
该部分使用流式细胞术(flow cytometry)对EHM的细胞成分进行了定量分析,比较了人类EHM(n=18)和恒河猴EHM(n=4)的细胞组成:心肌细胞(CMs):ACTN2+;基质细胞(StCs):VIM+/ACTN2−。结果发现:人类EHM和恒河猴EHM在细胞比例上具有一定相似性,但仍存在一定程度的变异。
3. EHM的组织结构分析(c)
研究人员进一步对EHM进行了整体免疫荧光染色(whole-mount staining),分别检测了人类EHM(n=1)和恒河猴EHM(n=3)中的心肌结构,染色指标包括:ACTN2(绿色):标记心肌细胞的肌节结构。DAPI(蓝色):标记细胞核。结果显示:无论是人类EHM还是恒河猴EHM,心肌细胞均形成了肌节排列的结构,表明其已初步具备心肌组织的生理特性。
4. EHM的功能性评估(d)
研究人员通过等长条件(isometric conditions)下的电场刺激(electrical field stimulation, 1.5 Hz),测定了EHM的收缩能力。实验结果表明:在电刺激下,EHM表现出明显的节律性收缩,表明其具备基本的心肌功能。
关键突破:EHM移植物如何长期存活?
让EHM真正“活”在心脏里,是该研究的核心挑战之一。心肌组织是高度依赖血液供应的活性组织,一旦缺乏足够的氧气和营养,移植物很容易坏死。此外,宿主的免疫系统也可能攻击移植细胞,导致移植物无法长期存活。
为了克服这些问题,研究人员采取了多层次优化策略,确保EHM在恒河猴心脏中能够长期存活并保持功能:
-
细胞组合优化:研究发现,单独移植心肌细胞(CMs)存活率较低,因此研究人员引入了基质细胞(StCs),通过提供生长因子和结构支持,显著提高了移植物的存活率。
-
免疫抑制方案:由于EHM来源于异体iPSCs,研究团队采用了一种标准免疫抑制方案(包括他克莫司[FK506]、霉酚酸酯[MMF]等),有效减少了宿主免疫系统对移植物的攻击,从而延长了移植物的存活时间。
-
血管化(vascularization):移植物必须迅速建立血管网络才能存活。研究发现,在移植后的几周内,EHM成功与宿主心脏的血管系统建立了连接,确保了细胞的持续供氧和营养供应。
实验数据显示,在恒河猴模型中,移植的EHM在超过12周的观察期内均能稳定存活,并且随着时间推移,移植物中的心肌细胞逐渐成熟,具备了更强的收缩能力。这一突破性结果表明,EHM不仅可以存活,还能够在宿主心脏中持续发挥作用。
能否真正修复心脏?——心肌收缩功能的显著改善
EHM长期存活的意义在于,它能否真正改善心脏功能。研究人员通过心脏磁共振成像(CMR)和超声心动图(echocardiography)对恒河猴进行评估,发现EHM移植后,受损心脏的收缩能力明显增强。
关键数据包括:
-
在移植后4周,EHM移植物区域的左心室收缩功能(left ventricular contraction)明显提升,相比对照组呈显著性差异。
-
通过压力-容积环分析(pressure-volume loop analysis),研究人员发现,移植EHM的恒河猴心室壁张力增强,提示心肌收缩能力有所恢复。
-
在实验结束时,EHM区域的心肌组织仍然保持活性跳动,并且与宿主心肌协同工作,这意味着移植物不仅仅是填充物,而是真正具备功能的心肌组织。
安全性评估:没有心律失常或肿瘤生长的发现
安全性是任何新型疗法进入临床前的关键考量。研究人员特别关注了心律失常(arrhythmia)和肿瘤生长(tumor formation)两个主要安全风险。
-
心律失常风险
由于移植物与宿主心肌的电信号传导可能存在不匹配,移植异体心肌细胞有可能导致心律失常,影响心脏的正常节律。然而,在该研究中: -
通过心电图(ECG)和Holter监测,研究团队未发现恒河猴在EHM移植后出现严重的心律失常。
-
研究人员还观察到,EHM在移植几周后,与宿主心肌建立了良好的电生理耦合,使其能与宿主心脏同步跳动。
-
肿瘤生长风险
由于iPSCs具有强大的增殖能力,部分干细胞疗法可能会诱发移植物异常增生或肿瘤形成。在该研究中,研究人员在移植超过12周后,对EHM区域进行了组织病理学分析(histopathological analysis),结果显示: -
未发现异常增生或肿瘤样组织,表明EHM细胞在移植后并未失控增殖。
-
组织切片分析显示,移植物中的细胞逐渐成熟,与宿主心肌形成稳定的细胞结构。
从动物到人类:首例EHM临床试验的里程碑
在工程化心肌(EHM)移植成功应用于恒河猴心力衰竭模型之后,研究人员迈出了更加大胆的一步——在人体中首次测试这一突破性疗法。对于全球数百万晚期心力衰竭患者而言,这次实验不仅是医学史上的重要里程碑,也象征着再生医学从实验室走向临床应用的重要转折点。
勇敢的尝试:晚期心力衰竭患者的EHM移植
在该研究中,研究团队选择了一名患有终末期心力衰竭的患者进行首例EHM移植手术。该患者已接受标准的心力衰竭治疗(包括药物、机械辅助装置等),但病情仍在持续恶化,传统治疗手段已无法逆转心脏功能衰退。对于这名患者而言,EHM移植是最后的希望。
手术过程中,医生将工程化心肌移植物精准植入患者左心室受损区域,并通过免疫抑制策略确保移植物能够存活。这是全球首例在人类心脏中植入实验室制造的“人造心肌”,标志着再生医学在心血管疾病治疗领域的重大突破。
尽管这一尝试充满未知,但它为数百万等待心脏移植的患者带来了全新的希望。如果EHM疗法能够成功,它将彻底改变心力衰竭的治疗模式,让患者不再依赖供体心脏,而是通过再生医学实现自体修复。
术后表现:移植物存活、心脏功能改善
EHM移植手术完成后,研究团队密切监测患者的术后恢复情况,重点关注移植物的存活情况、心脏功能的改善,以及潜在的副作用。
术后检查显示,EHM移植物在患者心脏内成功存活,并且:
-
心脏收缩能力有所提升:通过心脏超声和磁共振成像(CMR)监测,研究人员发现EHM区域的心肌收缩功能显著增强,提示移植物正在发挥作用。
-
移植物与宿主心脏整合良好:术后数周,EHM与宿主心肌逐渐融合,部分细胞开始与患者自身的心肌同步跳动,表明移植物具有一定的电生理适应性。
-
血管化进展良好:移植后,EHM逐步建立起血管网络,并与宿主血管系统连接,使细胞获得充足的氧气和营养,进一步增强了移植物的存活率。
最重要的是,患者在术后未出现严重并发症,如心律失常或免疫排斥反应,这表明EHM疗法具有良好的初步安全性。
挑战仍然存在:免疫抑制、血管化与细胞成熟度
尽管首例EHM临床试验取得了成功,但研究人员也发现了亟待解决的挑战,主要包括以下三个方面:
1. 免疫抑制:如何让移植物“被接受”?
尽管患者接受了标准免疫抑制治疗(如他克莫司[FK506]和霉酚酸酯[MMF]),以降低宿主免疫系统对EHM的攻击,但长期使用免疫抑制剂可能带来副作用,包括感染风险增加、肾功能损伤等。
研究人员正在探索个性化免疫耐受策略,例如:
-
个性化iPSCs来源的EHM:如果未来能够使用患者自身的iPSCs制造EHM,那么移植后可能无需免疫抑制。
-
基因工程改造的低免疫原性细胞:通过CRISPR等基因编辑技术降低EHM的免疫原性,从而减少免疫抑制需求。
如果免疫问题能够得到优化,EHM的应用前景将更为广阔。
2. 血管化:如何确保移植物长期存活?
尽管在该研究中,EHM移植物成功建立了初步的血管网络,但研究人员发现:
-
EHM区域的血流供应仍然低于正常心肌,可能限制其长期功能。
-
部分移植物区域的缺氧现象仍然存在,影响了心肌细胞的存活和成熟。
为了解决这些问题,研究人员正在研究增强EHM血管化的方法,例如:
-
在EHM中加入血管内皮细胞(vascular endothelial cells, VECs),加速血管生成。
-
使用生物支架或生长因子促进血管化,提高移植物的血流供应能力。
-
结合3D打印技术,提前构建具有完整血管网络的EHM,提高细胞存活率。
3. 细胞成熟度:如何让EHM更接近天然心肌?
目前实验室培养的心肌细胞仍然较为幼稚(immature),在功能和结构上与成人心肌细胞存在一定差距。研究人员观察到:
-
移植后的EHM收缩能力仍低于正常心肌,可能需要更长时间才能完全发挥作用。
-
心肌细胞的电生理特性仍需进一步优化,以确保它们能够无缝整合到宿主心脏中。
为此,研究人员正在探索:
-
延长EHM培养时间,让心肌细胞在体外充分成熟后再移植。
-
优化生物力学刺激(如电场、机械拉伸),促使细胞在培养过程中发育得更接近天然心肌。
-
通过基因编辑提升心肌细胞成熟度,使移植细胞更接近成年心肌。
当EHM细胞的成熟度提高后,移植效果将更加稳定,功能改善也将更显著。
EHM技术的进步,让“人造心肌”修复受损心脏从设想变成了现实。从实验室培养的心肌细胞,到恒河猴模型中的成功移植,再到全球首例人体EHM移植,这一研究正在推动医学进入一个细胞工程与再生医学结合的新纪元。
尽管前方仍有许多挑战需要克服,但EHM的成功标志着心脏病治疗模式的根本性变革。或许在不远的未来,心力衰竭将不再是绝症,而是可以通过工程化心肌移植真正逆转和治愈的疾病,让全球数百万患者重新燃起希望。
参考文献
Jebran AF, Seidler T, Tiburcy M, Daskalaki M, Kutschka I, Fujita B, Ensminger S, Bremmer F, Moussavi A, Yang H, Qin X, Mißbach S, Drummer C, Baraki H, Boretius S, Hasenauer C, Nette T, Kowallick J, Ritter CO, Lotz J, Didié M, Mietsch M, Meyer T, Kensah G, Krüger D, Sakib MS, Kaurani L, Fischer A, Dressel R, Rodriguez-Polo I, Stauske M, Diecke S, Maetz-Rensing K, Gruber-Dujardin E, Bleyer M, Petersen B, Roos C, Zhang L, Walter L, Kaulfuß S, Yigit G, Wollnik B, Levent E, Roshani B, Stahl-Henning C, Ströbel P, Legler T, Riggert J, Hellenkamp K, Voigt JU, Hasenfuß G, Hinkel R, Wu JC, Behr R, Zimmermann WH. Engineered heart muscle allografts for heart repair in primates and humans. Nature. 2025 Jan 29. doi: 10.1038/s41586-024-08463-0. Epub ahead of print. PMID: 39880949.


