西湖大学邱娜莎/浙江大学申有青ACS Nano:内质网靶向的聚合物-锰纳米复合物,可实现肿瘤免疫治疗
时间:2025-01-30 12:08:58 热度:37.1℃ 作者:网络
锰离子(Mn2+)是一种免疫激活剂,可增强cGAS和STING蛋白的激活。而STING信号激活和随后的免疫反应主要与内质网(ER)有关。因此,在亚细胞区室中Mn2+靶向ER将促进STING信号通路的激活。
有鉴于此,西湖大学邱娜莎和浙江大学申有青教授等人报告了通过Mn2+与两性离子聚合物聚[2-(N-氧化物-N,N-二甲氨基)甲基丙烯酸乙酯](OPDMA)络合来设计ER靶向的锰基纳米复合物(NC)。Mn/OPDMA纳米复合物(Mn/OPDMA NCs)可为肿瘤积聚维持长时间的血液循环,并引发吸附介导的细胞外渗和深度肿瘤穿透。值得注意的是,在肿瘤相关巨噬细胞中,Mn/OPDMA NC可以优先转移到其ER,显著增强cGAS STING通路激活,促进肿瘤相关巨噬细胞极化和IFN-β分泌。与游离Mn2+相比,Mn/OPDMA NCs降低了全身毒性,增加了肿瘤中的Mn含量,并促进了细胞内部化和ER转运,有效激活了STING途径,导致巨噬细胞复极、DC成熟,从而在结肠癌和肝细胞癌症模型中具有强大的抗肿瘤效力。这项研究为癌症免疫疗法提供了一种有效的金属离子输送策略。相关工作以“Endoplasmic Reticulum-Targeted Polymer-Manganese Nanocomplexes for Tumor Immunotherapy”为题发表在ACS Nano。

【文章要点】
在之前的工作中,作者报道了基于叔胺氧化物的聚合物,聚[2-(N-氧化物-N,N-二(m)乙氨基)甲基丙烯酸乙酯],OPDE(M)A。(Nature Biomedical Engineering (2021), 5 (9), 1019-1037)。这一两性离子聚合物对蛋白质具有防污性能,但可以结合细胞膜,延长血液循环并触发快速细胞内化。此外,一旦内化到细胞质中,OPDE(M)A可优先积聚在ER中。因此,作者推测OPDMA可能将Mn2+传递到ER,从而增强其cGAS STING激活和免疫治疗效果。幸运的是,在本研究中,作者就发现OPDMA可与Mn2+配位形成纳米复合物(Mn/OPDMA NCs)(图1)。
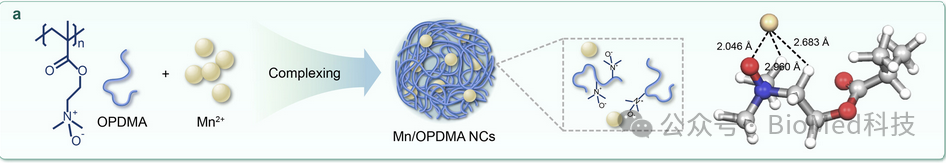
图1 Mn/OPDMA NCs
由于上述NC足够稳定,可以降低Mn2+毒性,在血液中循环并在肿瘤部位积聚以进行亚细胞递送,同时在ER中释放Mn2+以触发cGAS/STING通路,从而促进肿瘤相关巨噬细胞(TAM)的极化并增强抗肿瘤免疫反应(图2)。在小鼠结肠癌和肝细胞癌症模型中,与游离Mn2+治疗的小鼠相比,静脉注射Mn/OPDMA NCs有效地重塑了肿瘤免疫微环境,大大延缓了肿瘤生长2.4至5倍,并延长了小鼠的存活率。本研究展现了Mn2+的ER靶向递送能力,实现了强大的STING激活,从而在没有游离Mn2+毒性的情况下实现了有效的全身肿瘤抑制。
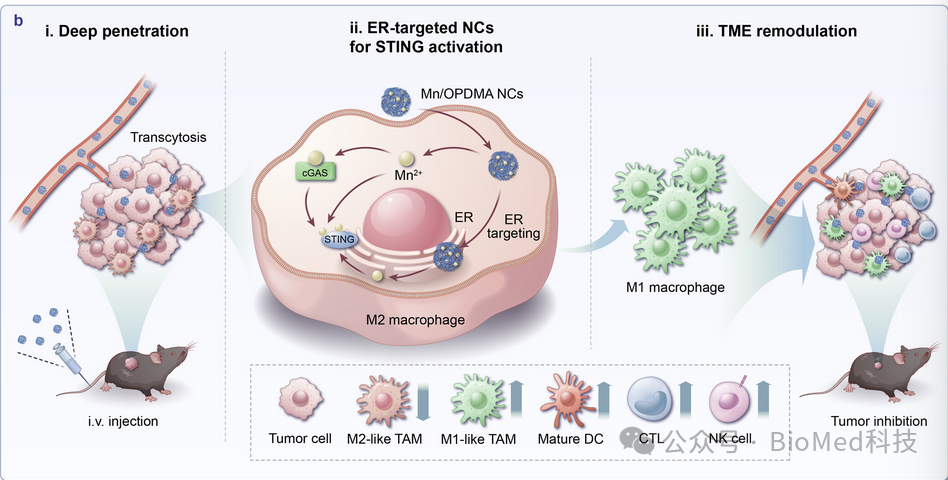
图2 cGAS/STING活化示意图
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c17279?articleRef=control


