Nat Med | COMPASSION-15 研究:卡度尼利单抗联合化疗显著改善胃/食管胃结合部(G/GEJ) 腺癌患者的 OS
时间:2025-01-26 12:09:04 热度:37.1℃ 作者:网络
- 胃癌是全球第五大常见癌症,每年导致超过 75 万人死亡。 胃癌最常见的组织学类型是腺癌,其中大多数为 HER2 阴性,尽管医疗技术有所进步,但超过 50% 的胃癌患者在诊断时已出现转移性或不可切除的肿瘤。针对 HER2 阴性、不可切除的局部晚期或转移性胃癌或胃食管结合部 (G/GEJ) 腺癌,一线治疗的标准治疗方案是抗 PD-1 药物联合化疗。 然而,对于 PD-L1 表达水平低的患者,生存获益有限。卡度尼利单抗(Cadonilimab)是一种抗 PD-1/CTLA-4 双特异性抗体,已在 I 期/II 期临床试验中显示出良好的临床疗效和安全性,包括低 PD-L1 表达的患者。 本研究旨在进一步评估卡度尼利单抗联合化疗与单纯化疗相比,在不可切除的局部晚期或转移性 G/GEJ 腺癌患者中的疗效和安全性。

方法
COMPASSION-15 试验是一项在中国 75 家医院进行的随机、双盲、安慰剂对照的 3 期试验。该研究纳入了18-75 岁的成年人,经组织学证实为不可切除的局部晚期或转移性 G/GEJ 腺癌,患者未接受过全身性抗癌治疗,至少有一个可测量的肿瘤病灶,ECOG 体能状态评分为 0 或 1,具有足够的器官功能,预计生存期 ≥ 3 个月,能够提供新鲜或存档的肿瘤样本以评估 PD-L1。患者按 1:1 比例随机分配接受 卡度尼利单抗 (10 mg/kg) 或安慰剂,每 3 周与 XELOX (奥沙利铂和卡培他滨) 联合使用,最多 6 个周期,然后继续使用卡度尼利单抗或安慰剂单药治疗,剂量相同。使用卡度尼利单抗或安慰剂的治疗一直持续到疾病进展、出现不可接受的毒性反应或撤回知情同意书为止。主要终点为意向治疗人群的总生存期 (OS);次要终点为PD-L1 联合阳性评分 (CPS) ≥ 5 的患者的 OS、无进展生存期 (PFS)、客观缓解率 (ORR)、疾病控制率 (DCR)、缓解持续时间 (DoR)和安全性。
研究结果
COMPASSION-15试验达到了主要终点。在意向治疗人群中,与单纯化疗相比,卡度尼利单抗联合化疗显著改善了总生存期 (OS) 和无进展生存期 (PFS),中位 OS 从 11.1 个月延长至 14.1 个月,死亡风险降低了 34% (HR 0.66, 95% CI 0.54-0.81; P<0.001)。
在 PD-L1 CPS ≥ 5 的患者中,卡度尼利单抗联合化疗同样显著改善了 OS 和无进展生存期 (PFS)。中位 OS 从 10.9 个月延长至 15.3 个月 (HR 0.58, 95% CI 0.41-0.82),中位 PFS 从 5.5个月延长至 6.9个月 (HR 0.51, 95% CI 0.37-0.70)。
在 PD-L1 CPS < 5 的患者中,卡度尼利单抗联合化疗也显著改善了 OS 和 PFS,中位 OS 从 11.4 个月延长至 13.7 个月 (HR 0.75, 95% CI 0.56-1.00),中位 PFS 从 4.6 个月延长至 6.9 个月 (HR 0.60, 95% CI 0.45-0.79)。
卡度尼利单抗联合化疗组的客观缓解率 (ORR) 和缓解持续时间 (DoR) 也显著高于单纯化疗组,ORR 分别为 65.2% 和 48.9%,DoR 中位数分别为 8.8 个月和 4.4 个月。


安全性分析
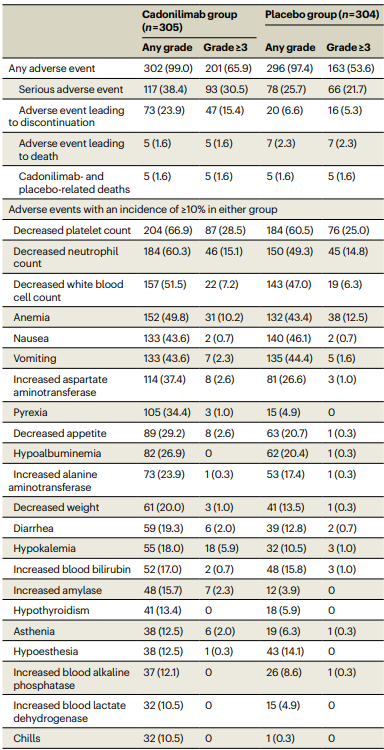
卡度尼利单抗联合化疗的安全性特征与该组合的已知安全性特征一致,没有发现新的安全性信号,卡度尼利单抗联合化疗组 3 级或以上治疗相关不良事件 (TRAE) 的发生率高于安慰剂组 (65.9% vs 53.6%),最常见的不良事件是血小板计数减少、中性粒细胞计数减少和贫血,大多数免疫相关不良事件 (irAE) 为 1 级或 2 级,最常见的是甲状腺功能减退。
结论
COMPASSION-15 试验的预先计划中期分析表明,与单纯化疗相比,卡度尼利单抗联合化疗在 G/GEJ 腺癌患者的一线治疗中显著改善了 OS,且安全性特征良好,该研究为低 PD-L1 表达水平的 G/GEJ 腺癌患者提供了一种新的治疗选择。
原始出处
Shen, L., Zhang, Y., Li, Z. et al. First-line cadonilimab plus chemotherapy in HER2-negative advanced gastric or gastroesophageal junction adenocarcinoma: a randomized, double-blind, phase 3 trial. Nat Med (2025). https://doi.org/10.1038/s41591-024-03450-4.


