【麻案精析】全麻腹腔镜手术患者肺复张时发生心搏骤停:细数心脏里的各种反射
时间:2025-01-21 12:12:37 热度:37.1℃ 作者:网络
85%-100%的接受气管插管全身麻醉患者,会受肺不张影响。研究表明,全身麻醉仅5分钟后就可能出现肺不张。肺不张形成的四个主要原因包括纤毛运动障碍、肺泡氧浓度增加、叹气/深呼吸消失以及肺泡表面活性物质减少。通过肺复张操作使塌陷的肺复张,可改善肺泡气体交换和动脉氧合,降低与术后肺部并发症相关的病残率和死亡率。对没有心血管功能异常的患者,肺复张操作被认为是安全的,并且是腹腔镜手术全身麻醉结束前的标准操作。
2024年12月,来自丹麦霍森斯霍森斯地区医院麻醉科的住院医师M. C. Larsen在Anaesthesia Reports报告了一例无心血管疾病史的女性在择期腹腔镜胆囊切除术中因肺复张操作继发心搏骤停的病例。
病例报告
一名67岁女性,因胆囊息肉1年内多次因上腹部疼痛入院,计划择期行腹腔镜胆囊切除术。患者身高170cm,体重65kg。ASAI级,无常规用药史。患者有吸烟史,40年前已戒烟,无饮酒史。患者13年前因乳腺癌接受肿瘤切除术、腋窝清扫术、化疗和放疗。在胆囊切除术时,乳腺癌治疗后无残留症状或复发。
术中行标准监测,包括三导联心电图、无创血压测量(NIBP)和脉搏血氧饱和度监测。使用四个成串刺激(TOF)监测评估神经肌肉阻滞情况。患者术前观察指标为:NIBP160/90mmHg,心率96次/分钟,氧饱和度97%。麻醉采用丙泊酚和瑞芬太尼全凭静脉麻醉诱导和维持。使用罗库溴铵和140mg丙泊酚单次注射辅助气管插管。由于血压缓慢持续下降,30分钟后开始持续输注去氧肾上腺素。手术期间,建立12mmHg的气腹,在缝合穿刺孔前停止。手术过程中,患者先取头高脚低位,直到胆囊切除后改为平卧位。手术按计划进行,总手术时间为83分钟。
在麻醉终止前,按照科室指南进行肺复张操作,气道峰压为35cmH₂O,持续20秒。复张操作后,患者立即出现严重心动过缓,并迅速发展为心搏骤停。手术团队立即开始心肺复苏(CPR),随即启动院内心搏骤停呼叫,负责患者麻醉的上级医师被召集到手术室。在CPR期间,在胸部放置自动体外除颤器电极片。第一轮CPR后分析心脏节律,可观察到电活动,心率为75-80次/分钟。患者于2至3分钟内恢复自主循环。
患者麻醉苏醒过程顺利,并安全拔除气管导管。术后,患者被转至重症监护病房进行进一步检查和观察。术后患者情况稳定,生命体征无异常,无胸痛。在心搏骤停后1.5h和6h,抽血检测肌钙蛋白T,并行12导联心电图检查。事件发生后肌钙蛋白T为16ng/L,该值在6h后保持不变。两次12导联心电图均显示窦性心律,心率分别为67次/分钟和81次/分钟,电轴正常,传导正常,QRS波群窄,无T波异常。患者随后被转至心内科进一步观察,经过24h心电监测且无异常后出院。
病例讨论
作者描述了一例在全身麻醉下肺复张操作后发生严重心动过缓导致心搏骤停的事件。由于患者术前无心血管疾病,术后也未观察到异常,故认为心搏骤停是由肺复张操作诱发。复张操作可能通过过度拉伸外周气道刺激迷走神经,而胸腔内压的增加导致前负荷降低。这些事件可触发心脏内在反射,如贝佐尔德-亚里施反射(Bezold-Jarisch reflex)、反向本布里奇反射(“Reverse” Bainbridge Reflexes)和起搏细胞牵张反射(pacemaker stretch reflex),从而影响心律。贝佐尔德-亚里施反射由心室机械感受器触发,增加副交感神经活动,导致心动过缓和外周阻力降低。反向本布里奇反射也通过检测心房牵张减少导致心动过缓,这会向脑干发出信号增加副交感神经输出。起搏细胞牵张反射涉及窦房结,根据起搏细胞的机械牵张调整心率,牵张增加时心率升高,牵张减少时导致心动过缓。
除复张操作外,该病例中还有几个因素可能导致静脉回流受损和/或心动过缓。与开腹手术相比,腹腔镜手术因气腹增加胸腔内压力。虽然腹腔内压力增加会影响静脉回流,但在复张操作前气腹已停止,因此在心动过缓发生时不太可能影响静脉回流。另一个可能导致静脉回流受损的因素是血容量不足。患者在手术前3h饮用两杯液体,手术期间输注600ml液体,无失血情况。因此,估计手术期间的液体需求量约为2ml/kg/h,因此血容量不足不太可能是心动过缓的原因。患者使用瑞芬太尼麻醉,瑞芬太尼可引起心动过缓。在心搏骤停时,患者已接受瑞芬太尼约1h,心率稳定在65-75次/分钟。虽然丙泊酚在诱导时可引起心动过缓,但在持续输注时通常与心动过缓无关。在手术过程中或心肺复苏期间未使用神经肌肉阻滞逆转剂或抗胆碱能药物。
总之,由于上述机制导致心率严重降低甚至心脏停搏是可能的,但极为罕见。尽管罕见,但已有多个病例报告表明,在脊髓麻醉期间心脏停搏可能通过上述讨论提及的机制发生。而本病例是首例关于腹腔镜手术中肺复张操作后心搏骤停的报告。
麻案精析的评述
本病例呈现了一例67岁女性在全身麻醉下腹腔镜胆囊切除术期间,于肺复张操作后突发严重心动过缓并进展至心搏骤停的情形,这一罕见且危急事件对临床麻醉工作极具警示意义。
一、临床关键要点剖析
1.麻醉管理深度的反思
病例中未提及麻醉深度监测手段,这可能是麻醉管理中的一大缺失。麻醉深度与心脏自主神经调节密切相关,适宜的麻醉深度是维持循环稳定的重要保障。建议常规采用脑电双频指数(BIS)、状态熵(SE)或Narcotrend监测等技术,实时监控麻醉深度,确保其维持在既能保证手术顺利进行又能减少对循环系统不良影响的范围。
2.肺复张操作的审慎考量
尽管遵循科室指南执行操作,仍引发心搏骤停,这提示现行标准操作流程可能未充分顾及患者个体差异。对于高龄、合并心肺基础疾病或心肺功能储备较差的患者,在进行肺复张操作前,应综合评估患者术前肺功能(如肺顺应性、功能残气量等)、心血管功能状态(如心输出量、心脏射血分数等),依据评估结果对复张压力、时间等参数进行精细化、个体化调整,避免因统一标准操作而诱发严重并发症。
当前临床上缺乏有效预测肺复张操作相关心血管并发症的指标和方法。未来研究应着重探索可用于术前评估的相关指标,如心脏自主神经功能检测指标(心率变异性等),构建风险预测模型,筛选高危患者,提前制定针对性防范措施。在操作前,确保急救药物(如阿托品、肾上腺素等)和设备(除颤仪等)处于随时可用状态,并制定详细的应急预案,以便在紧急情况发生时能迅速、有序地开展抢救工作。
3.心肺复苏实施的经验教训
手术团队在事件发生后迅速启动心肺复苏值得肯定,但仍存在可改进之处。例如,术中患者体位(如腹腔镜手术的特殊体位)可能对心肺复苏时的胸外按压效果产生影响,按压位置、深度和频率的准确性难以保证。应通过模拟演练、团队培训等方式,优化手术团队与麻醉团队在紧急情况下的协作模式,提高胸外按压质量,同时确保气道管理、药物注射等其他急救措施能高效协同进行。
患者成功恢复自主循环后,其心脏功能和全身状况仍面临诸多潜在风险。除文中提及的对心肌损伤标志物和心电图的监测外,还应密切关注患者血流动力学变化、重要脏器灌注情况(如尿量、乳酸水平等),并制定全面的复苏后管理方案,涵盖液体管理、心血管活性药物支持、呼吸功能维护、脑保护以及预防感染等多方面措施,确保患者平稳度过复苏后阶段。
二、心血管相关反射的要点回顾
心血管反射是调节和调节心脏功能和血管张力的神经反馈回路。它们由传入(感觉)、中枢神经系统延髓的整合和传出(运动)组成。表1列出了主要的心血管反射。动脉压力感受器反射是一种主要的稳态机制,可将动脉血压维持在狭窄的范围内。它根据位于主动脉弓和颈动脉窦的高压牵张受体的反馈,通过调整循环来实现此功能。Bezold-Jarisch 反射抑制交感神经流出到血管和心脏,这些变化是由位于心室壁的机械敏感和化学敏感受体介导(图1)。

反向本布里奇反射,则是指完全心肺反射,包括高血容量期间心率增加和低血容量期间心率降低。反向本布里奇反射的存在意味着,心肺受体在基线条件下是活跃的,它们对窦房结的放电率施加强直刺激作用。因此,静脉回流的减少会导致这些受体的卸载(失活),从而引发反射诱导的心率降低。
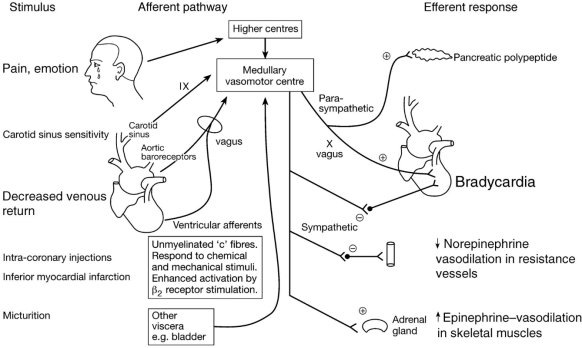
图1 心脏反射环路
椎管内麻醉回导致节前交感神经的去神经支配,导致小动脉(阻力血管)和静脉(电容血管)扩张。小动脉扩张导致全身血管阻力降低,静脉扩张导致静脉淤积和静脉回流、每搏输出量和心输出量减少。这些变化结合在一起,会导致全身性低血压。心脏交感神经(加速器)纤维位于脊髓的T1-4水平,T4以上(高位腰麻)或T4以下(低位腰麻)与心动过缓相关,心率也可能无显著变化。高位腰麻醉期间的心动过缓,通常仅归因于心脏交感神经的直接麻痹,窦房结的控制权留给了抑制性迷走神经纤维。
然而,这种机制无法解释低位腰麻期间的心率减慢,因为此时心脏的交感神经支配是完整的。因此,这才提出了反向本布里奇反射。许多观察性研究和麻醉医师的临床实践都观察到下属现象。首先,脊髓麻醉期间心脏减慢程度与腰麻水平无关。相反,它与动脉血压的降低相关。能将心率和动脉血压联系起来的共同因素是静脉回流,也就是右心房压力。其次,对于在高位腰麻期间出现低血压和心动过缓的患者,抬高双腿或将患者置于头低位会增加动脉血压和心率。因此,如果心率的降低完全是由心脏交感神经阻滞引起,体位的调整应该不会导致心率增加。因此,反向本布里奇反射是脊髓麻醉期间心率的最重要决定因素。也就是说,椎管内麻醉期间心动过缓的最重要原因是静脉回流减少,而非心脏交感神经的中断。
除上述反射外,麻醉医师对下述常见的心血管反射也应熟悉并理解:
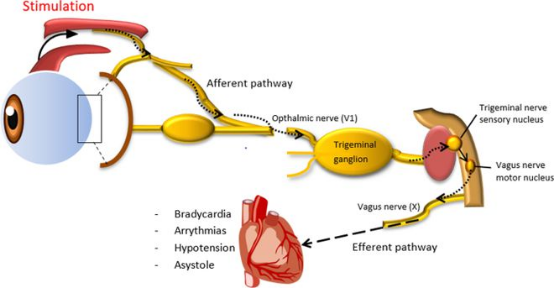
1、眼心反射
眼外肌中富含本体感受器,当压迫眼球或牵拉眼外肌时,刺激信号经长、短睫神经传导至睫神经节,在此换元后,沿三叉神经的眼支传入半月神经节,最后与动眼神经的副核发生联系,促使动眼神经释放乙酰胆碱,增强副交感神经对心脏的支配作用,进而使心率减慢。这种反射的潜伏期较短,通常在刺激后20 - 40 秒即可出现心率变化,且刺激强度与心率减慢程度呈正相关。
在眼科手术尤其是涉及眼球操作的手术如斜视矫正术、白内障摘除术等过程中,眼心反射发生率颇高,可达30% - 90%。麻醉医师必须密切监测心率变化,一旦出现心率骤减,需及时提醒手术医师暂停操作,并可给予阿托品等抗胆碱药物拮抗。若在全身麻醉状态下,由于麻醉药物对心血管系统的抑制作用叠加眼心反射,可能导致严重的心动过缓和低血压,甚至心搏骤停,危及患者生命。因此,术前对眼心反射的预估及术中的精准监测与处理是眼科麻醉管理的关键环节。
2、中枢神经缺血反射(Cushing反射)
当颅内压急剧升高,如颅脑外伤、颅内占位性病变导致脑疝形成前期,脑血管受压,脑血流灌注急剧减少,引发中枢神经系统缺血缺氧。此时,位于延髓的心血管中枢感受到缺血刺激,触发Cushing反射。具体表现为先是交感神经系统强烈兴奋,外周血管收缩,心率加快,心肌收缩力增强,以试图提升血压保障脑灌注;随着颅内压进一步升高,压力感受器反射逐渐被激活,又使得心率减慢,呈现典型的 “两阶段” 血压、心率变化模式。
在神经外科手术中,尤其是开颅手术操作靠近脑干等关键部位时,麻醉医师要高度警惕颅内压变化引发的Cushing反射。一方面,通过合理的麻醉药物选择(如丙泊酚、异氟烷等具有一定降低颅内压作用的药物)和通气管理(适度过度通气降低二氧化碳分压,减轻脑水肿)来预防颅内压升高;另一方面,实时监测血压、心率、脉搏血氧饱和度等生命体征,一旦出现Cushing反射迹象,如血压先升后降、心率异常波动,需迅速采取措施纠正颅内压异常,如甘露醇快速静脉滴注脱水、调整手术操作部位等,确保患者围手术期脑功能及心血管系统的稳定。
3、肺血管反射
肺动脉壁内分布有压力感受器,当肺动脉压力升高时,这些感受器受到刺激,传入神经纤维将冲动传至延髓心血管中枢。反射性地引起交感神经兴奋,使心率加速,同时部分血管床收缩以调节肺循环血流分布,维持肺部气体交换效率与心血管功能的平衡。
在体外循环心肺转流术开始阶段,肺动脉血流突然改变,压力骤升,肺血管反射即刻启动。这可能导致患者在转机初期出现心率突然加快、肺动脉压进一步波动,若麻醉深度不当,还可能引发体循环血压不稳定。此外,在胸科手术中,对肺组织的牵拉、压迫或肺部疾病本身导致的肺动脉高压,均可激活该反射,麻醉医师需要依据手术进程与患者实时心血管反应,精细调控麻醉深度、血管活性药物使用,以缓冲肺血管反射对围手术期循环的干扰。
4、冠状动脉反射
在左心室壁冠状动脉左旋支末端附近存在特殊的化学感受器,这些感受器对心肌代谢产物如腺苷、氢离子、钾离子等浓度变化极为敏感。当心肌缺血时,心肌细胞无氧代谢增强,代谢产物积聚,刺激化学感受器,兴奋经无髓鞘的迷走传入C纤维传导至延髓心血管中枢,进而引起副交感神经张力增加。
在心脏手术尤其是冠状动脉搭桥术、心肌梗死急性期的急诊手术中,心肌缺血再灌注损伤是常见问题。此时,冠状动脉反射被激活,表现为心动过缓、低血压以及冠状动脉扩张,旨在增加缺血心肌的灌注、减轻损伤。但这种反射也可能导致严重的血流动力学不稳定,麻醉医师需提前预判,准备好阿托品、多巴胺等药物,在出现反射效应时迅速干预,保障心脏泵血功能及全身循环稳定,确保手术顺利进行与患者术后恢复。
5、躯体感受器反射
躯体感受器包括皮肤的温度感受器、痛觉感受器,肌肉的牵张感受器以及内脏感受器等。皮肤寒冷刺激时,冷觉感受器兴奋,传入神经纤维将信号传至脊髓,经中间神经元与交感神经节前神经元联系,促使外周血管收缩,减少散热,血压升高;肌肉剧烈运动时,牵张感受器兴奋,通过脊髓反射弧调节心血管活动,增加心输出量以满足肌肉代谢需求;内脏感受器在受到牵拉、炎症等刺激时,同样引发心血管反射,如胆囊炎发作时可伴有心率加快、血压升高。
在手术麻醉过程中,患者体位摆放不当,长时间压迫某一躯体部位,可激活该部位的躯体感受器,引发局部血管收缩、血液循环不畅,术后易形成压疮,同时可能导致反射性血压波动、心率改变。麻醉医师术前应指导正确体位摆放,术中定期检查,预防此类问题。此外,术后疼痛管理至关重要,有效镇痛可避免因手术切口处躯体感受器持续受刺激引发的应激性心血管反应,如高血压、心动过速,促进患者康复进程。
三、肺复张策略的临床实施
在腹腔镜手术患者中,肺不张是常见的肺部并发症之一,而肺复张手法有助于改善氧合、减少术后肺部并发症。
1、时机选择
一般选择在手术主要操作结束、准备关闭腹腔前进行肺复张,此时手术对患者呼吸力学和循环系统的影响相对较小,且能在术后早期改善患者的氧合状态,有利于患者恢复。但如果手术过程中患者出现严重的氧合障碍(如SpO₂持续低于90%)或其他需要紧急改善氧合的情况,也可在手术过程中适时进行肺复张,但需权衡手术操作与肺复张操作之间的相互干扰。
2、操作方法
常用的肺复张方法包括持续气道正压(CPAP)法和压力控制通气(PCV)法,可根据患者具体情况和设备条件选择。
CPAP法:在麻醉机上设置持续气道正压水平,一般为30-40cmH₂O,维持30-60秒。操作过程中密切观察患者的呼吸力学参数(如气道峰压、平台压)、氧合指标(SpO₂、动脉血氧分压,PaO₂)以及循环参数(心率、血压、CVP等)变化。如果患者能够耐受,可适当延长CPAP维持时间,但需注意避免气压伤等并发症。
PCV法:采用压力控制模式,设置吸气压力为35-45cmH₂O,吸呼比为1:1-1:2,呼吸频率为10-15次/分钟,持续3-5分钟。在PCV过程中同样密切监测上述参数变化,根据患者反应调整压力和时间参数。
3、压力与时间调整
初始设置肺复张压力和时间时,应参考患者术前肺功能评估结果和术中实际情况。对于肺顺应性较好、心肺功能储备较强的患者,可适当提高压力上限和延长维持时间;而对于肺顺应性差、心肺功能脆弱的患者,则应从较低压力开始,逐渐增加压力,并缩短维持时间,同时密切观察患者反应,一旦出现不良反应(如严重心动过缓、低血压、气胸等),立即停止肺复张操作,并采取相应处理措施。
在肺复张过程中,如果患者氧合改善不明显或出现不良反应,可尝试调整压力和时间参数,但调整幅度不宜过大,每次调整后应稳定观察一段时间(如1-2分钟),评估患者对新参数的耐受情况和氧合改善效果。
四、监测与不良反应处理
1、监测指标及频率
呼吸力学参数:持续监测气道峰压、平台压、呼气末正压(PEEP)等,每1-2分钟记录一次。肺复张过程中气道压力升高是正常现象,但如果气道峰压超过45-50cmH₂O或平台压超过35-40cmH₂O,应警惕气压伤的发生。
氧合指标:密切观察SpO₂变化;也可间断抽取动脉血进行血气分析,监测PaO₂、动脉血二氧化碳分压(PaCO₂)等指标,评估肺复张对氧合和通气的影响。如果SpO₂持续低于90%或PaO₂改善不明显,应分析原因并调整肺复张策略或采取其他辅助通气措施。
循环参数:持续监测心率、血压(有创或无创)、CVP等。肺复张过程中可能因胸腔内压力升高导致静脉回流减少、心输出量下降,从而引起低血压和心动过缓。如果心率低于50次/分钟或血压下降幅度超过基础值的20%-30%,应立即停止肺复张,并根据情况给予相应处理(如使用阿托品提升心率、血管活性药物维持血压等)。
2、不良反应处理预案
低血压:如果出现低血压,首先快速静脉输注适量晶体液或胶体液(如200-500ml),以增加血容量;同时可适当降低肺复张压力或暂时停止肺复张操作,观察血压变化。如果血压仍未恢复,可考虑使用血管活性药物,如去氧肾上腺素(50-100μg静脉注射,根据血压反应调整剂量)或去甲肾上腺素(0.05-0.1μg/kg/min静脉输注),维持血压稳定。
心动过缓:当心率低于50次/分钟时,立即静脉注射阿托品0.5-1.0mg,可重复使用至心率恢复正常。如果阿托品无效或出现严重心动过缓伴低血压,可考虑使用肾上腺素(5-10μg静脉注射)或异丙肾上腺素(5-10μg静脉注射)等药物,但需谨慎使用,避免引起心律失常等其他并发症。
气压伤:若怀疑发生气压伤(如出现突发胸痛、呼吸困难加重、皮下气肿、气胸体征或氧合急剧恶化等),应立即停止肺复张操作,并进行胸部影像学检查(如床旁胸部X光或胸部CT)确诊。对于少量气胸(肺压缩<20%)且患者生命体征稳定者,可密切观察,给予高浓度吸氧,促进气胸自行吸收;对于大量气胸或患者出现严重呼吸困难、循环不稳定等情况,应立即行胸腔闭式引流术,排出胸腔内气体,缓解症状。
其他不良反应:如出现心律失常(如室性早搏、室性心动过速等),应分析原因(如电解质紊乱、酸碱平衡失调、心肌缺血等),并给予相应处理。对于严重心律失常,可能需要使用抗心律失常药物(如利多卡因、胺碘酮等)或电除颤等治疗措施。
总之,在腹腔镜手术患者中实施肺复张手法需要全面的术前评估、精细的麻醉管理、规范的操作流程、密切的监测以及完善的不良反应处理预案。只有这样,才能在确保患者安全的前提下,有效改善患者氧合,减少术后肺部并发症,促进患者快速康复。临床麻醉医师应熟练掌握肺复张技术,并根据患者个体差异灵活运用,不断提高临床麻醉质量。
此病例深刻提醒临床医师,全身麻醉下看似常规的操作亦蕴含潜在风险。在临床实践中,应始终秉持精细化、个体化的麻醉管理理念,强化对罕见并发症的认识与警惕。从术前全面评估、麻醉方案精心设计、术中操作谨慎施行到术后密切监测与管理,每一个环节都关乎患者安危。通过持续学习、经验总结以及积极参与相关研究,不断提升应对此类危急情况的能力,确保患者围手术期安全,推动麻醉学科的安全管理水平迈向新高度。
原始文献:
Larsen MC, Soni UK. Cardiac arrest during alveolar recruitment manoeuvre under general anaesthesia for laparoscopic surgery. Anaesth Rep. 2024;12(2):e12332. doi: 10.1002/anr3.12332


