IVD前沿:细胞外囊泡相关DNA的诊断和治疗应用
时间:2025-01-20 12:15:03 热度:37.1℃ 作者:网络
细胞外囊泡(EV)包括各种细胞类型释放的各种颗粒,它们都被包裹在脂质双层膜中,不具有复制能力。相比之下,非囊泡细胞外颗粒(NVEP)缺乏脂质双层膜,尺寸小于50 nm,其分子生物学成因尚不清楚。EVs和NVEP封装了一系列生物活性分子,这些分子在生理和病理背景下对细胞间的通信至关重要。最近的研究对某些生物活性分子(如蛋白质和RNA)的关注相当大,但对EV-DNA的探索仍然相对不足。尽管这一领域的研究有限,但EV-DNA的生物学意义已得到越来越多的认识。新出现的证据强调了它作为各种病理条件的生物标志物和候选诊断来源的潜力,包括癌症、结核病、肾损伤、产前诊断、帕金森病和炎症性疾病。
近日,杂志Cell Death and Disease 上发表了一篇题为“Extracellular vesicle-associated DNA: ten years since its discovery in human blood”的综述文章。在这篇综述中,作者重点总结了EV-DNA在人类健康和疾病中的功能,包括细胞间通讯、癌症进展和免疫调节。作者深入研究EV-DNA的潜在临床和诊断应用,强调其在生物标志物发现和非侵入性疾病检测和监测中的作用。此外,总结了用于表征EV-DNA基因组和表观遗传内容的最常用技术。最后,评估了EV-DNA的潜在功能作用及其对人类健康和疾病的影响。

图片来源:Cell Death and Disease
主要内容
EP亚型和按EV大小分类的EP-DNA研究
细胞外囊泡(EV)包含各种细胞类型释放的颗粒,所有这些都包裹在脂质双层膜中,缺乏复制的能力。非囊泡性胞外颗粒(NVEP)缺乏脂质双层膜,其大小小于50 nm,其分子生物发生仍然未知。EV具有较高的异质性,可以根据其大小、组成和起源进行分类(如下图)。
EV对DNA的装载能力可能受到其大小的影响,较大的EV封装了更多的线性和质粒DNA,而sEV样外泌体在其腔内不携带DNA,其表面也很少携带DNA。总体而言,研究结果表明,不同亚型的EV具有不同的DNA递送潜力,这使得MV (microvesicles)或LOs (Large oncosomes)成为基于液体活检的EV-DNA生物标志物的一个有希望的选择。
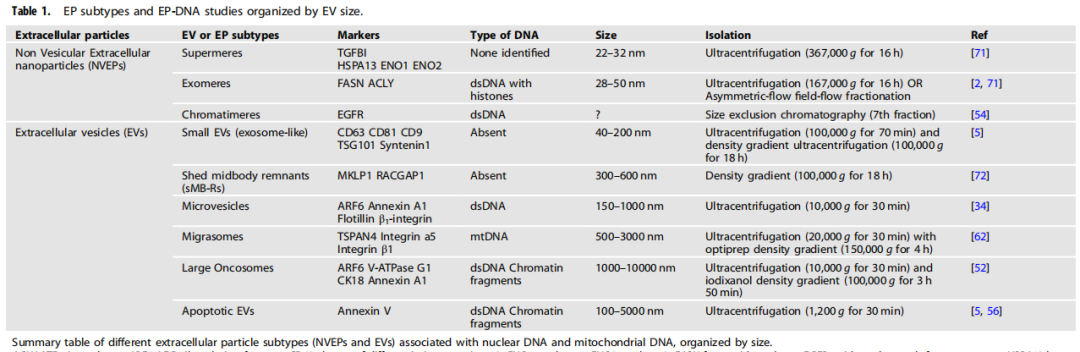
EP亚型和按EV大小组织的EP-DNA研究。
图片来源:Cell Death and Disease
EV-DNA的功能作用
除了EV相关RNA、蛋白质和脂质的作用外,EV-DNA (gDNA和mtDNA)可能具有生理意义并影响受体细胞的功能,特别是在致癌转化、免疫调节和疾病发病机制中(见下图)。
水平基因转移:EV生物活性cargo经历内吞作用,携带癌基因突变的EV-DNA将进入受体细胞,如受体细胞肿瘤抑制基因失调,会促进癌基因表达或引发基因组不稳定性,甚至可能会诱导恶性肿瘤。
炎症中的EV-DNA:EVs已被证明对多种情况下的免疫功能有重大影响,最明显的是癌症。肿瘤源性EV可以对先天免疫系统和适应性免疫系统发挥免疫刺激或免疫抑制(图D)。EV-DNA对免疫系统的激活不仅限于gDNA;EV-mtDNA也被证明具有免疫调节功能。EV-DNA通过刺激TLR和非TLR核酸传感器,引发抗原特异性抗体反应,形成免疫复合物,从而引发免疫效应的潜在作用,促进各种自身免疫性疾病的发展,如类风湿关节炎、系统性红斑狼疮和动脉粥样硬化性心脏病。
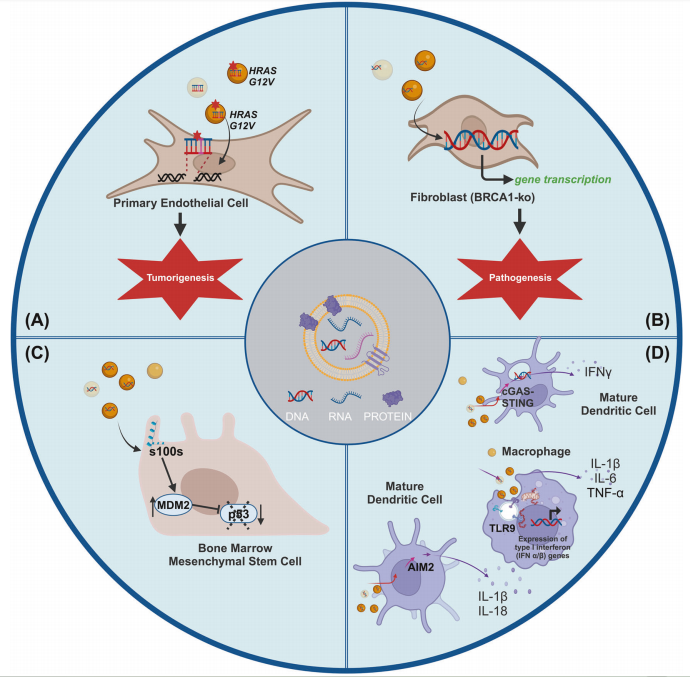
EV-DNA的功能作用。图片来源:Cell Death and Disease
分析EV-DNA的方法
EV-DNA的分析包括在不同基质中提取和纯化EV,最后进行EV-DNA的分析。但在EV群体中,肿瘤来源的EV的有限存在,这对在复杂样本中检测其含量提出了挑战。传统的方法如ELISA和流式细胞术面临局限性,包括低浓度的挑战。ddPCR和各种测序方法已被广泛用于检测EV相关的突变DNA拷贝。ddPCR预扩增步骤有助于检测低拷贝数的EV-DNA,但仅限于已知的序列。
应用下一代测序(NGS)EV-DNA提供了独特的优势,可识别未知的单核苷酸多态性以及检测所有类别的结构变异。除了遗传学研究之外,EV-DNA的表观遗传学谱分析,如甲基化分析,也被用于胶质母细胞瘤的肿瘤分类。展望未来,EV-DNA可类似cfDNA作为一种液体活检分析物的分析有可能制定个性化的治疗决策,预测癌症结果,并识别对治疗的耐药性。
肿瘤来源EV-DNA作为液体活检的生物标志物
循环EV来源于一个全面的细胞群,因此具有反映异质性肿瘤整体的潜力,并具有诊断应用。癌症患者血液中EV相关蛋白、EV-DNA和EV-RNA水平升高。与传统的组织活检相比,侵入性小,可以实现更频繁和可重复的采样。EV的脂质双层膜为EV相关核酸提供了保护和稳定性,比ctDNA更具优势,为加强当前的癌症监测、预后和治疗策略提供了一条有前途的途径。
比如,在外泌体DNA中检测到的KRAS和TP53突变已被确定为原发性癌症(如胰腺癌)的潜在指标。EV相关突变DNA (BRAF V600E)可以作为黑色素瘤患者肿瘤进展的标记物。结肠癌突变KRAS G12D和G13D,利用EV-DNA作为生物标志物,实现了76.67%的灵敏度和100%的特异性。EV-DNA突变拷贝的分数丰度也被证明与癌胚抗原水平和总体存活率呈正相关,这表明EV-DNA是临床广泛使用的癌胚抗原测量的补充工具。
免疫细胞来源EV作为液体活检的生物标志物
源自免疫细胞的循环EV也可以作为生物标志物,帮助预测临床对化疗的反应。转移性黑色素瘤患者T细胞/树突状细胞来源的EVs表面标志物PD-1和CD28水平升高与ipilimumab等化疗药物的临床反应改善相关。来自不同病因的EV相关生物活性分子的多功能性使其成为解决各种疾病(特别是癌症)对非侵入性液体活检工具的迫切临床需求的最佳生物标志物。
EV-DNA作为生物标志物的重大挑战
尽管分析人体生物体液中的EV-DNA对诊断和长期监测患者具有吸引力,但缺乏标准化方法,以及可重复性、透明度和数据共享,构成了重大挑战。解决这些问题需要克服许多技术挑战,特别是防止与EV具有相似物理和分子特性的囊泡的共提纯。
为了应对这些挑战,成立了专门的EV工作组。有工作组专注于血液EV生物标志物的独特挑战。也有尿液工作组为尿液EV研究提供了更严格和可重复的方法建议,以促进成功过渡到临床实践。还有团队开发了公开免费的细胞外囊泡相关DNA数据库(EV-ADD),旨在提高EV-DNA研究领域的标准化和透明度。
EV-DNA疗法
许多研究也强调了EV-DNA作为一种治疗策略的潜力,特别是在癌症疫苗中,EV-DNA显示出启动免疫系统防御癌症的希望。编码EV相关卵清蛋白抗原的DNA疫苗已被证明可引发抗肿瘤免疫反应,从而减少体内肿瘤进展。
外源DNA也可以被包装到EV中并传递到目标细胞,来自胎盘外植体培养系统的大型EV和sEV可以装载高达1000 ng的质粒,作为基因治疗的递送载体。自噬或nSMAse抑制剂已成功用于阻止EV介导的有害遗传物质转移。
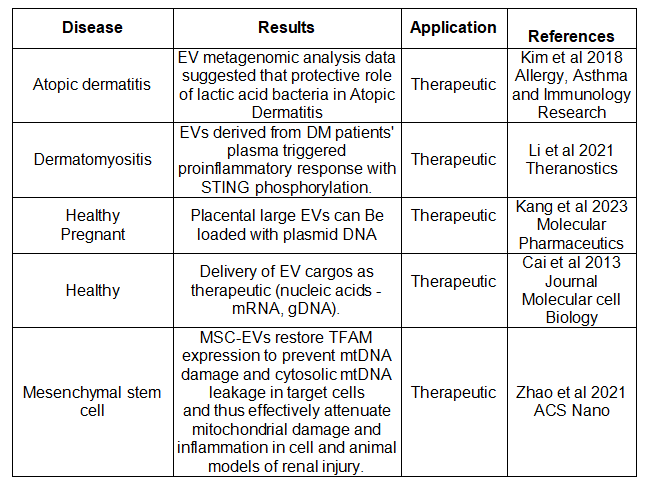
EV-DNA作为治疗应用。图片来源:Cell Death and Disease
EV-DNA疗法的挑战
目前,EV-DNA治疗面临几个持续的挑战。首先,EV货物的异质性为确保一致和有效地递送治疗有效载荷带来了挑战。尽管电穿孔已被广泛用于装载治疗货物,但它对DNA的装载能力有限。此外,解决受体细胞中DNA转移后瞬时蛋白表达的问题对于实现持续的治疗效果至关重要。此外,需要成功的临床试验来验证和最终的临床应用EV-DNA疗法。克服这些技术挑战对于EV-DNA治疗的临床实施至关重要。
结论和前景
EV-DNA在正常生理和病理条件中的关键作用已经变得明显,包括水平基因转移、遗传不稳定、炎症和癌症的影响。然而,文献中报道的EV-DNA研究存在不一致性,即使在同一实验室和使用同一细胞系,关于EV-DNA缺失或存在的矛盾发现也有报道。文献中不一致的发现可能部分归因于EV分离、cfDNA表征和EV-DNA检测方法的差异,这突出了该领域对标准化、透明度和数据共享的需求。
对EV-DNA生物发生了解的进步为发现新的生物标志物和开发治疗策略提供了希望。随着开发更先进的EV分离技术,以及国际合作和工作组,未来十年有望更好地了解EV-DNA释放和最佳的EV分离。未来的工作应侧重于生物标志物检测的标准化以及提高灵敏度和特异性。此外,在治疗领域,应努力平衡EV-DNA的治疗效果和毒性。这一进展将利用EV巨大潜力,促进其从实验室到临床的转化,并可能为其发病机制提供新的见解。


