PNAS:山东师范大学王翊洁/陈岩合作研究发现CYLD-PARP1反馈回路调节乳腺癌细胞的DNA损伤修复和化疗敏感性
时间:2025-01-20 12:09:46 热度:37.1℃ 作者:网络
聚(ADP-核糖)聚合酶1(PARP1)在DNA修复和基因组稳定性维持中起着至关重要的作用。然而,调控PARP1活性的机制,尤其是通过去泛素化的调控,仍然知之甚少。
2024年12月31日,山东师范大学王翊洁、陈岩共同通讯在PNAS(IF=9.4)在线发表题为“The CYLD–PARP1 feedback loop regulates DNA damage repair and chemosensitivity in breast cancer cells”的研究论文。该研究通过使用去泛素化酶(DUB)库结合筛选,作者在乳腺癌细胞中鉴定出了圆顶瘤(CYLD)作为PARP1的真正去泛素化酶。
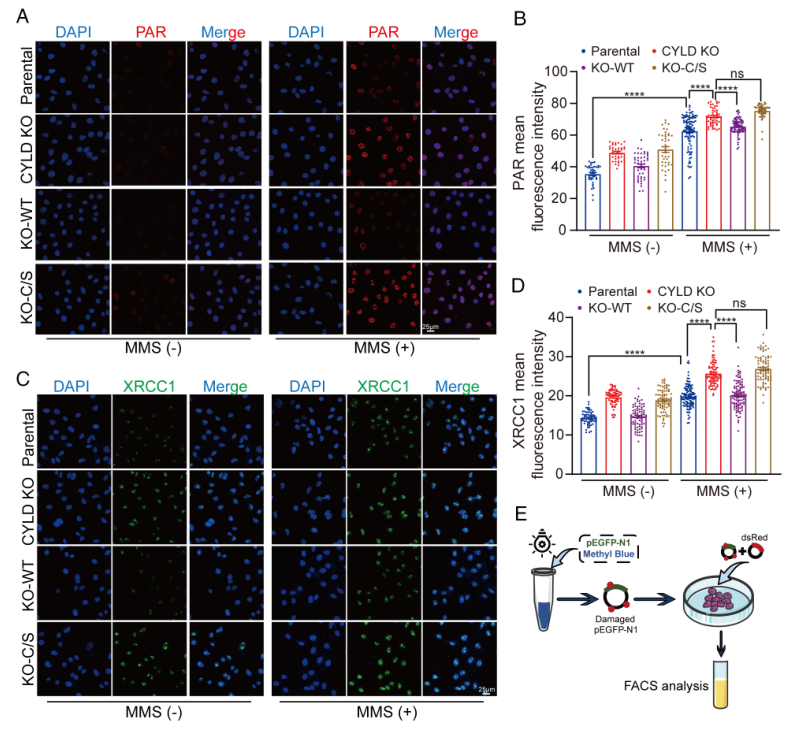
机制上,CYLD在基因毒性应激作用下被PARP1招募到DNA损伤位点,并在PARP1的K748、K940和K949位点剪切K63连接的多泛素链,从而导致PARP1的激活受损。相反,PARP1通过PAR化作用在CYLD的E191、E231、E259和E509位点,增强其去泛素化活性。因此,CYLD的缺失导致碱基切除修复效率的提高,并使乳腺癌细胞对烷基化剂产生耐药性。相反,CYLD的过表达即使在同源重组修复功能正常的乳腺癌细胞中,也能增强对PARP抑制剂(PARPi)的敏感性。这些发现为CYLD与PARP1在DNA修复中的复杂相互作用提供了独特的见解,并强调了靶向这一调控轴在乳腺癌化疗中的重要性。

快速高效的DNA修复对于防止基因组不稳定至关重要,基因组不稳定是癌症的常见特征,通常由内外部DNA损伤源引发。PARP1作为一种关键的DNA修复效应蛋白,在多种人类癌症中具有显著的治疗潜力。当遭受基因毒性应激时,PARP1被激活,利用NAD+作为供体催化合成聚(ADP-核糖)(PAR)链,附加到包括PARP1自身在内的受体蛋白上(这一过程称为自PAR化),从而招募其他修复组件并促进修复过程。通过PARP抑制剂(PARPi)靶向PARP1在临床中已取得相当成功。然而,这些药物的应用主要局限于同源重组(HR)缺陷癌症,这构成了一个临床障碍。
由于PARPi并未完全阻断PARP1的活性,因此识别参与调节PARP1活性的靶点可能提供治疗漏洞,从而帮助扩大PARPi在临床应用中的治疗窗口。PARP1的活性通过许多翻译后修饰(PTM)精细调节,超出了其自我修饰的范畴,例如泛素化、磷酸化和乙酰化。然而,去泛素化在DNA修复过程中对PARP1的影响仍然很大程度上未知。有趣的是,去泛素化酶(DUB)抑制剂PR-619可导致PARP1的过度泛素化,并进而增强PARP1的酶活性,这表明DUB在PARP1活性调控中具有重要作用。尽管USP15和USP36已被发现调节PARP1的稳定性,但目前尚未有去泛素化酶报告调节PARP1的活性。因此,作者试图识别特定调控PARP1活性的潜在DUB。
CYLD在DNA损伤时抑制PARP1活性(图片源自PNAS )
圆顶皮肤瘤(CYLD)是泛素特异性蛋白酶(USP)家族的成员,参与多种生物过程,如促炎、先天免疫和纤毛生成。CYLD主要裂解Lys63链的多泛素化,而对Lys48链的多泛素化活性较低。在多种癌症类型中,包括肝细胞癌(HCC)、乳腺癌和结肠癌,CYLD的表达或酶活性下降,表明CYLD可能具有肿瘤抑制作用。值得注意的是,CYLD还参与DNA损伤应答。CYLD通过促进DNA损伤诱导的p53激活,进而促进损伤诱导的凋亡,抑制肠道和皮肤肿瘤的发生。与此一致,CYLD下调会降低HCC细胞对多柔比星(Doxorubicin)和顺铂(Cisplatin)的敏感性,而CYLD的缺失则通过不明机制使乳腺癌细胞对依托泊苷(Etoposide)产生耐药性。此外,CYLD通过抑制HDAC1/2活性和诱导氧化应激增强鼻咽癌细胞的放射敏感性。所有这些发现表明,CYLD在调节癌细胞对DNA损伤的敏感性中起着至关重要的作用,尽管其潜在机制尚不完全明确。
在本研究中,作者揭示了CYLD与PARP1之间在DNA修复过程中的一个前所未见的机制性联系。作者证明了基因毒性应激引起的ATM磷酸化CYLD增强了其与PARP1的相互作用。随后,CYLD去泛素化PARP1,从而抑制其活性。值得注意的是,PARP1将CYLD招募到DNA损伤位点并对其进行PAR化,增强了CYLD的去泛素化酶活性。CYLD的缺失增强了PARP1依赖的碱基切除修复(BER)信号,并使乳腺癌细胞对化疗药物产生耐药性。因此,CYLD–PARP1负反馈回路为癌症治疗中的治疗干预提供了重要潜力。
原文链接:
https://doi.org/10.1073/pnas.2413890121


