肿瘤家族史患者应尽早进行多基因检测!BRCA2胚系突变携带者罹患五种恶性肿瘤
时间:2025-01-19 12:11:11 热度:37.1℃ 作者:网络
BRCA2胚系突变已知会使携带者易患各种癌症,包括乳腺癌、卵巢癌、胰腺癌和前列腺癌。也有报道称,BRCA2与黑色素瘤有关。然而,与BRCA2突变相关的全部肿瘤谱,尤其是对于同时存在其它致病突变的患者,尚未探索。本文介绍一位 70 岁的女性患者,携带致病性BRCA2 c.5946del变异。在 15 年的时间里,患者罹患两种独立的乳腺癌,高分化脂肪肉瘤、透明细胞肾细胞癌和骨髓增生性肿瘤。这种不寻常的肿瘤谱和这些肿瘤的交替发生需要进行多轮基因检测,并导致对BRCA2相关肿瘤易感性的诊断延迟。除了BRCA2突变外,扩展胚系检测还发现了APC c.3920T>A变异以及BRIP1和ATR基因中意义不明的变异。对肿瘤的分子检测揭示了不同的特征:HRD状态和拷贝数变异存在差异,表明没有共同的起源。本文案例研究显示,致病性BRCA2 c.5946del胚系变异可能与不寻常的肿瘤谱有关,这可能会导致延迟诊断和遗传性肿瘤易感性。因此,鼓励预先使用多基因或全基因组测序进行基因检测,尤其是在有显著家族史的病例中。
背 景
长期以来,人们都认为BRCA1和BRCA2基因突变会使个体易患某些恶性肿瘤,如女性乳腺癌和卵巢癌。BRCA突变与胰腺癌和前列腺癌之间的关联也已得到证实。多个研究小组报告了黑色素瘤的发病趋势,但仍然存在争议。Momozawa等人最近的一项研究表明,与BRCA1和BRCA2突变(可能致病)相关的癌症类型范围可能更广,包括胆道癌、胃癌和食管癌。另一方面,APC基因胚系突变长期以来一直与家族性腺瘤性息肉病有关。还有报道称APC突变会导致染色体不稳定。
本报告介绍了一位携带BRCA2突变的女性病例,诊断出患有五种不同的恶性肿瘤:两种独立的乳腺癌、高分化脂肪肉瘤、透明细胞肾细胞癌(ccRCC)和治疗相关的骨髓增生性肿瘤。虽然BRCA2突变与乳腺癌之间的关联已经得到充分研究,但是很少或没有研究调查过BRCA2突变与本文病例中存在的其它恶性肿瘤之间的关联。据报道,BRCA突变携带者的一级和二级亲属肾癌的标准化发病率增加。同样,Momozawa等人也观察到BRCA2致病变异与肾癌之间的关联。相反,荟萃分析显示,存在BRCA突变的情况下患肾癌的风险没有增加。迄今为止,还没有发现关于APC突变与肾癌或BRCA1、BRCA2或APC突变与任何类型的脂肪肉瘤之间的关联的文献。
病 例
患者女,70 岁,携带BRCA2突变。在 15 年的时间里患上了五种不同的恶性肿瘤。2006 年,她首次诊断出右大腿高分化脂肪肉瘤(非典型脂肪瘤[ALT]),并进行了手术切除。2008 年,发现右侧ccRCC(最初pT1cN0cM0 G2)并进行了手术切除。随后,出现了右肾上腺转移,于 2010 年进行了手术切除,2016 年切除了第二左肋骨的孤立性骨转移。2010 年,在右外下象限发现了低分化浸润性导管乳腺癌(最初pT1c[11 mm]pN0(sn)(0/4)M0 G3)。2018 年,在纤维化早期诊断出原发性骨髓纤维化类型的治疗相关性骨髓增生性肿瘤。最近,在 2021 年,在左下内象限发现了一个乳腺癌,非特殊类型(NST)(最初pT2[37 mm]pN1 (2/2)M0R0 G3)。患者有多种恶性疾病家族史(见图1)。患者家族是北欧人,可能是阿什肯纳兹犹太人后裔。患者儿子在 19 岁时被诊断出患有皮肤边缘区B细胞淋巴瘤;患者女儿发现一个直肠息肉并切除。患者姐姐接受了预防性附件切除术。在活检中,在两个输卵管中发现了浆液性输卵管上皮内癌(STIC)病变、卵巢癌前体细胞和P53病变。患者的母亲在 65 岁时被诊断出患有结肠癌,同时还被诊断出患有膀胱癌和肺癌(可能是转移性结肠癌)。患者舅舅在 76 岁时死于胃肠道肿瘤,外祖父在 64 岁时死于肝癌。这位祖父的侄女在 72 岁时死于胰腺癌,她的女儿在 45 岁时也死于胰腺癌。患者父亲的家族病史也很引人注目:父亲在年纪较大时被诊断出患有鳞状细胞皮肤癌,还患有肠息肉。一位叔叔在 86 岁时因肾癌去世,并且患有息肉。父亲这边的一个堂兄也被诊断出患有肠息肉病,兄弟在大约 57 岁时死于前列腺癌。祖母在 80 岁时死于胃癌。
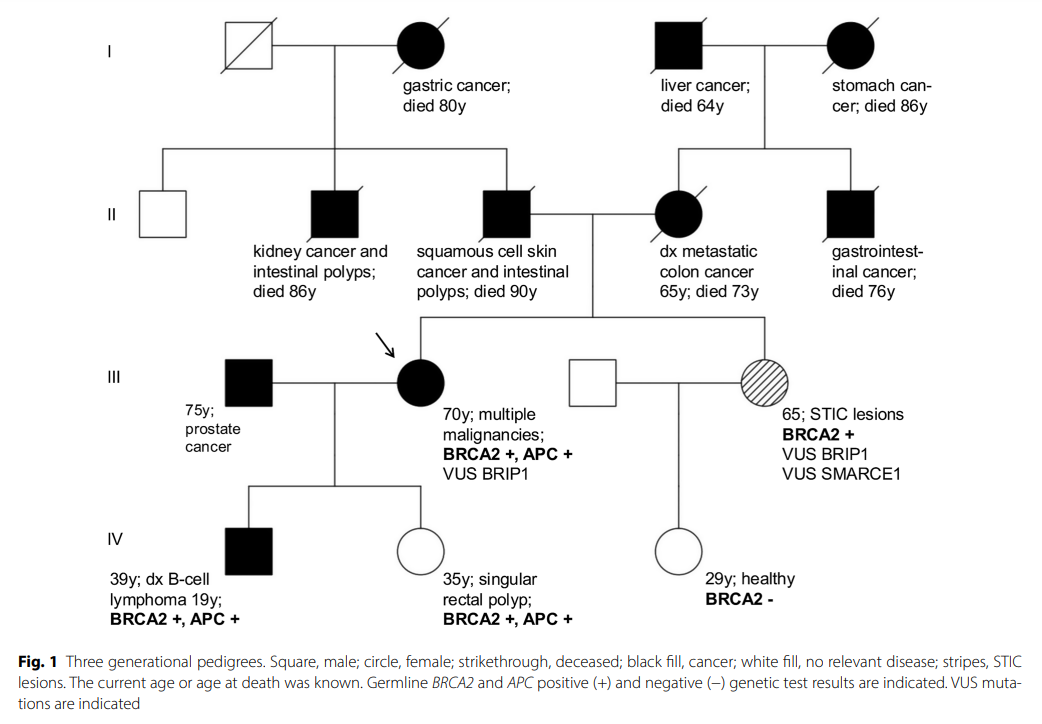
▲图1 患者家族三代谱系
由于肿瘤谱异常且发病时间不固定,因此进行了多轮基因检测。在ALT确诊后,TP53基因检测(测序和MLPA分析)显示结果正常,排除了可能患有Li-Fraumeni综合征(李-法美尼综合征)。随后,分析了其它几个与肉瘤、肠癌、肾癌和乳腺癌相关的基因(APC、MUTYH、MSH2、MLH1、MSH6、PMS2、STK11、SMAD4、BMPR1A、PTEN、TP53、CDH1、PALB2、RAD51C、RAD51D、SDHB、SDHC、SDHD和VHL),检测到了APC基因(NM_000038.6)变异c.3920T>A, p.(Ile1307Lys)。据报道,这种变异在约 5-10% 的阿什肯纳兹犹太人中存在,使结直肠癌风险增加 1.5-1.75 倍。只有在进行第二次乳腺癌外显子组测序和 97 个样本分析后,对从血液、唾液和头发中提取的DNA进行了遗传性肿瘤综合征相关基因检测。该分析揭示了BRCA2(NM_000059.4)杂合致病变异 c.5946del,p.(Ser1982Argfs*22)和BRIP1基因(NM_032043.3)中的 2 个意义不明的杂合变异 (VUS):c.1444A>G,p.(Ile482Val)和ATR基因(NM_001184.4)中的c.6226C>G,p.(Leu2076Val)。患者接受了预防性附件切除术,没有输卵管恶性肿瘤的证据。患者的两个孩子均携带致病性BRCA2变异c.5946del,p.(Ser1982Argfs*22)和APC变异c.3920T>A,p.(Ile1307Lys)。同样,患者的姐姐也发现了杂合的致病性BRCA2变异c.5946del,p.(Ser1982Argfs*22)和BRIP1基因杂合c.1444A>G,p.(Ile482Val)中的VUS。姐姐还携带SMARCE1基因中的另一个VUS c.1210A>G,p.Ile404Val。患者女儿的BRCA突变检测结果为阴性。对所有五种肿瘤样本进行了同源重组缺陷(HRD)和拷贝数变异检测(见图2;表1)。
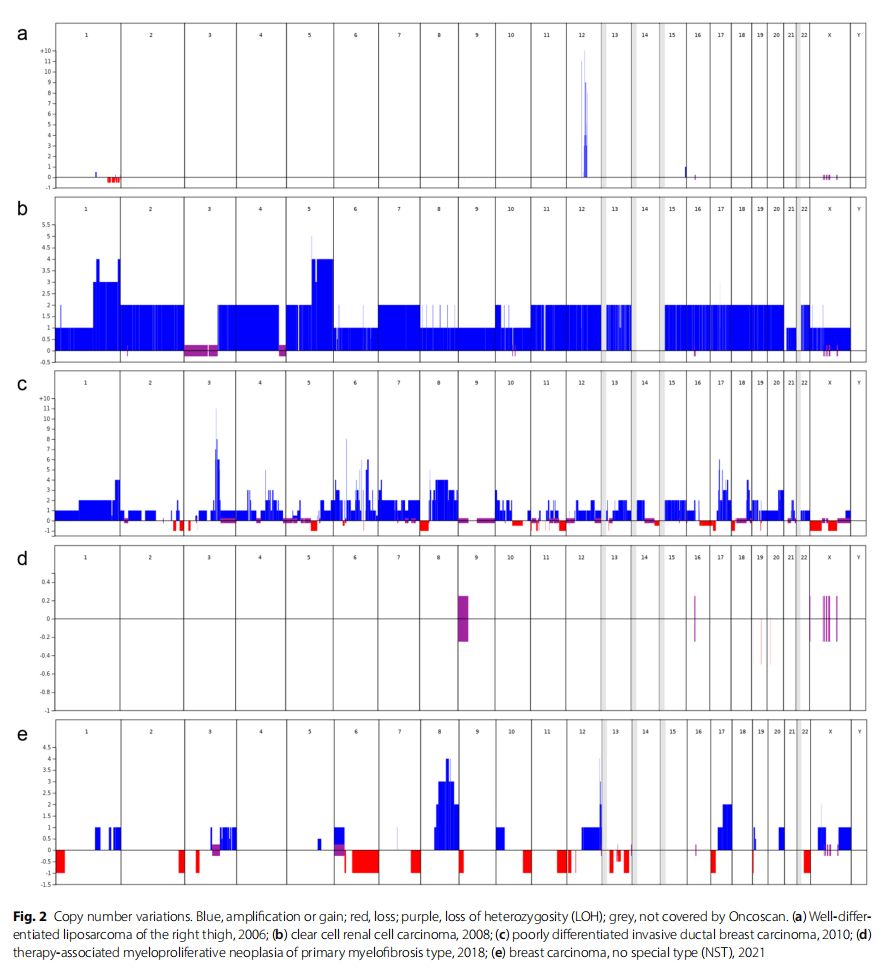
▲图2 拷贝数变异
蓝色表示扩增或增加;红色表示缺失;紫色表示杂合性缺失(LOH);灰色表示未覆盖
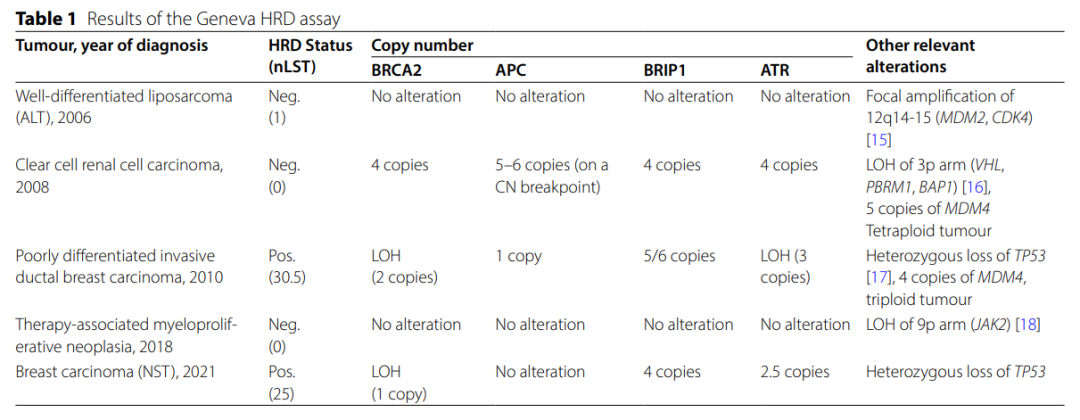
▲表1 HRD检测结果
ALT检测结果显示12q14-15(代表MDM2和CDK4)局部扩增,基因组稳定,BRCA2、BRIP1、ATR或APC中没有拷贝数变异。在ccRCC标本中,可以在四倍体肿瘤的背景下观察到BRCA2、BRIP1、ATR和APC的拷贝数增加。值得注意的是,APC基因处于断点,这可能表明一个等位基因丢失而另一个等位基因被扩增。低分化浸润性导管乳腺癌是一种三倍体肿瘤,BRIP1和ATR的拷贝数增加,并且有大量变异,还显示APC基因的杂合性缺失(LOH)。非特殊类型(NST)乳腺癌存在许多变异,包括BRCA2的缺失,但没有APC的缺失。原发性骨髓纤维化类型的治疗相关骨髓增生性肿瘤没有任何显著变异。
讨 论
本文患者的肿瘤不属于目前与BRCA2胚系突变相关的典型疾病谱。这种不寻常的肿瘤谱可能是由于在该患者中检测到了额外的胚系变异。检测到的APC c.3920T>A变异以及BRIP1和ATR VUS可能改变了与致病性BRCA2变异相关的特征性肿瘤谱。ClinVar上有关于本文患者中发现的特定BRIP1胚系突变的报告,该病例也与遗传性乳腺癌有关。对于ATR突变,也有一份意义不明确的报告。因此,尽管BRIP1和ATR基因都参与DNA修复,但没有证据表明这些变异根据拷贝数变异对本文患者的致癌作用有影响。目前还不清楚这五种恶性肿瘤是否都可以归因于检测到的突变,或者是否有基于父母双方阳性家族史的其他遗传原因。然而,由于患者的父母没有接受遗传咨询,因此尚不清楚他们是否携带更多突变。因此,尚不清楚BRCA2变异和APC变异是从父母哪一方遗传的。虽然这两种乳腺癌都符合BRCA2突变的范围,但患者没有胃肠道息肉,这可能从她有多发性肠息肉的家族史中可以看出。目前还不清楚尚未探索的环境因素是否会对患者及其家人的各种癌症产生影响。
肿瘤的分子分析显示出不同的特征,并未表明这些肿瘤具有共同的起源。在拷贝数变异方面,几乎没有共同的断点,并且几个区域的LOH状态在时间上与克隆进化不一致。前两种肿瘤ALT和ccRCC具有典型的肿瘤特征,并由拷贝数变异驱动。脂肪肉瘤可能是由MDM2和CDK4的扩增驱动,而ccRCC可能是由3p的缺失和多种基因变异驱动。似乎无论发现什么突变,这两种肿瘤都会发展,只是这两种肿瘤都是由拷贝数变化驱动的,并且这两个基因都与拷贝数变异有关。然而,两个乳腺癌都是HRD阳性,并且至少有一个BRCA2拷贝数缺失。在 2010 年的乳腺癌中,BRCA2完全缺失,这也许可以解释为什么肿瘤呈HRD阳性。在 2021 年的乳腺癌中,只剩下一个可能包含BRCA2突变的拷贝。没有进行肿瘤基因分型来最终确定保留的等位基因是突变型还是野生型,因为Oncoscan分析的主要目的是评估潜在的共同起源,而不是全面表征肿瘤。然而,在两种乳腺肿瘤中观察到的HRD阳性强烈支持同源重组通路功能存在障碍。有趣的是,APC在第一个乳腺癌中缺失,但在第二个乳腺癌中仍然保有功能,这与只有第一例乳腺癌是多倍体的事实相吻合。与 2010 年样本相比,2021 年乳腺癌样本中的变异似乎除了HRD之外还以非整倍体的形式存在。最有可能的是,由于原发性骨髓纤维化类型的骨髓增生性肿瘤的治疗相关性质,拷贝数没有发生显著改变。
可以假设,某些癌症中染色体臂1q的额外拷贝可能通过MDM4获得而导致p53下调,正如Girish等人最近所描述的那样。有趣的是,APC和TP53突变也与非整倍体有关,这在肾癌和 2011 年乳腺癌中都有观察到。尽管存在胚系突变,但肾癌中并没有BRCA2或APC的丢失,这表明这些突变可能不会驱动肾癌。然而,该肿瘤是四倍体,3p臂上存在杂合性缺失。这很常见,尤其是在透明细胞肾癌中,因为许多肾癌驱动因素都位于这一臂上(VHL、PBRM1和BAP1)。由于对肿瘤的分子检测并未表明它们有共同的起源,因此也可以假设BRCA2突变(单独或与APC突变结合)使基因组变得脆弱。反过来,这种染色体不稳定性可能增加了拷贝数相关肿瘤发展的倾向。这一观点可以解释为什么检测到的拷贝数变异并非出现在所有或大多数肿瘤中。有趣的是,并非所有肿瘤都具有HRD表型,如果它们是基于BRCA2突变进化的,那么这是可以预料到的。
虽然本文患者没有胃肠道息肉,但之前有报道称APC p.I1307K变异除了使人患上肠息肉之外,还会使人罹患其它癌症。Lenosh等人研究了以色列队列中APC I1307K多态性携带者的总体癌症风险,并表明女性携带者患乳腺癌和皮肤癌的患病率增加。同样有趣的是,另一项研究表明,具有阿什肯纳兹犹太血统的APC I1307K携带者无论男女患肾癌的风险均会增加。先前关于APC I1307K变异与BRCA突变共存的研究表明,APC I1307K增加了乳腺癌BRCA突变的外显率。BRCA2基因和APC胚系突变的共突变曾经报道过。Dolkar 等人报道了一名患有结肠腺癌的男性患者。测序发现BRCA2基因中存在有害的c.8297delC变异,APC基因外显子 9 的核苷酸位置 1213 处存在致病性突变,导致终止密码子提前出现(p.R405X)。尚不清楚是哪种突变导致了结肠癌,也不清楚这些胚系突变是否相互作用并同时使受影响的个体更容易患上某些癌症。
在目前的文献中,BRCA2和APC基因的胚系突变共同遗传似乎是一种非常罕见的事件。然而,随着NGS panel检测在肿瘤易感综合征中的应用日益广泛,相关变异的检测将变得更加频繁。如前所述,检测到的APC变异不是典型息肉病的高外显率突变,而是在 5-10% 的阿什肯纳兹犹太人中描述的多态性变异。BRCA创始人突变(founder mutation)在这一人群中也相对常见。鉴于此,可以假设APC多态性和BRCA突变的共存可能并不极其罕见。这强调了告知受影响个体在这种情况下可能面临的任何额外癌症风险的重要性。提供最佳监测和指导(如Valle等人所建议的)对于为这些患者提供最佳护理至关重要。
据研究人员所知,本文是首例展示了一名携带BRCA2和APC胚系突变并患有多种恶性肿瘤的女性患者。该患者不寻常的肿瘤谱需要进行多轮胚系检测,并导致对BRCA2相关肿瘤易感性的诊断延迟。因此,研究人员鼓励及时和多基因检测以确认其它可能相关的突变。特别是对于患有遗传性癌症的患者,收集详细的家族史并进行大型多基因或全基因组测序可能为患者带来更多获益。
针对存在遗传性肿瘤家族史的患者,我司可提供实体瘤全外显子组基因检测、遗传性肿瘤625基因检测、遗传性肿瘤105基因检测,评估患者的遗传和发病风险,协助受检者早诊断、早预防、早治疗。
参考文献:
Su E, Christinat Y, McKee T, Azzarello-Burri S, Jochum W, Fischer S, Rothermundt C. BRCA2 germline mutation carrier with five malignancies: a case report. Hered Cancer Clin Pract. 2024 Dec 19;22(1):27. doi: 10.1186/s13053-024-00302-7. PMID: 39702187; PMCID: PMC11660894.



