Nature子刊:哈尔滨医科大学研究团队揭示了高度保守的CRAPIR是心肌梗死后心肌细胞增殖和心脏修复的关键调节因子!
时间:2025-01-19 12:09:19 热度:37.1℃ 作者:网络
靶向心肌细胞周期是损伤后心脏修复的一种有前途的策略。
2025年1月15日,哈尔滨医科大学Cai Benzhi、Wang Ning、Chen Hongyang共同通讯在Nature Cardiovascular Research在线发表题为“The highly conserved PIWI-interacting RNA CRAPIR antagonizes PA2G4-mediated NF110–NF45 disassembly to promote heart regeneration in mice”的研究论文,该研究发现高度保守的PIWI相互作用RNA CRAPIR拮抗PA2G4介导的NF110–NF45分解以促进小鼠心脏再生。
该研究鉴定了一种心脏再生相关的PIWI相互作用RNA (CRAPIR)作为心肌细胞增殖的调节因子。基因切除或antagomir介导的小鼠CRAPIR敲除会损害心肌细胞增殖并降低心脏再生潜能。相反,CRAPIR的过度表达促进心肌细胞增殖,减少梗死面积,改善心肌梗死后的心功能。从机制上讲,CRAPIR通过与NF110竞争结合RNA结合蛋白PA2G4来促进心肌细胞增殖,从而阻止PA2G4与NF110–NF45异二聚体的相互作用,并减少NF110的降解。在人胚胎干细胞衍生的心肌细胞中证实了CRAPIR促进增殖的能力。值得注意的是,缺血性心脏病患者的CRAPIR血清水平较低,且与N末端脑钠肽前体水平呈负相关。这些发现将CRAPIR定位为心脏损伤的潜在诊断标志物和通过PA2G4–NF110–NF45信号轴的心脏再生的治疗靶点。

心血管疾病,如心肌梗死,由于其高发病率和死亡率,一直是人类的一个重要难题。斑马鱼和蝾螈表现出终生的心脏再生能力。尽管研究表明成年哺乳动物心脏的心肌细胞具有一定的更新能力,但当心脏受损时,它们的细胞更新率非常低,不足以进行自我修复。
值得注意的是,2011年的研究表明,新生小鼠的心脏可以在受伤后生成新的肌肉组织,从而使受损的心脏得以修复。然而,这种再生能力在出生后7天甚至2天就消失了。随后,研究发现新生大型哺乳动物猪的心脏也具有损伤后再生和修复的能力。新形成的心肌细胞主要来源于心脏内现有心肌细胞的增殖和分裂。这些发现促进了对心脏再生机制的进一步研究,目的是开发诱导成人心脏再生的方法。
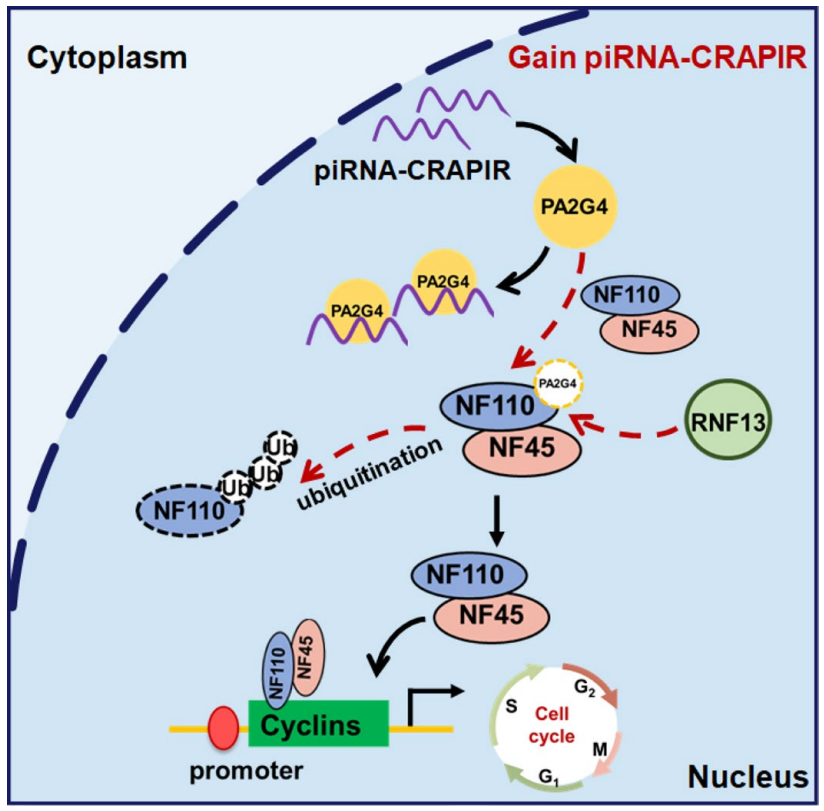
心肌细胞增殖中CRAPIR功能示意图(图源自Nature Cardiovascular Research)
已经描述了多种因素和方法来诱导成年心肌细胞的增殖。除了心脏微环境和基因对心脏的重要影响外。心肌细胞周期的重新进入,非编码RNA如MicroRNA、长非编码RNA和环状RNA在心脏再生和修复中也起着关键作用。另一类独特的小非编码RNA,PIWI相互作用RNA(piRNAs),长度为26-32个核苷酸,逐渐引起了研究人员的兴趣。研究表明,piRNAs参与生殖细胞发育和肿瘤发生。研究人员发现,piRNAs在心血管疾病中也有重要作用。piRNA CHAPIR通过靶向METTL3介导的小鼠Parp10 mRNA转录物的N6-甲基腺苷甲基化来促进病理性肥大和心脏重塑。然而,piRNAs在心肌细胞增殖和心脏再生中的作用以前没有被研究过。
在这项研究中,研究人员证明了高度保守的CRAPIR是心肌梗死后心肌细胞增殖和心脏修复的关键调节因子。CRAPIR直接与增殖相关蛋白2G4 (PA2G4,也称为EBP1)结合,影响PA2G4与NF110–NF45异二聚体的相互作用,减少NF110的降解,从而促进心肌细胞增殖。该研究表明,CRAPIR可以作为心血管疾病的潜在生物标志物,修复受损的心肌组织并增强心脏功能。
参考消息:
https://www.nature.com/articles/s44161-024-00592-z


