【综述】| 类器官在妇科恶性肿瘤药物筛选中的应用
时间:2025-01-10 12:15:23 热度:37.1℃ 作者:网络
[摘要] 妇科恶性肿瘤是威胁女性生命健康的重大疾病之一,其发病率和死亡率在女性各类疾病中均位居前列。妇科恶性肿瘤起源于女性生殖器官,通常依据发病部位进行分类,其中卵巢癌(ovarian cancer,OC)、子宫内膜癌(endometrial cancer,EC)及宫颈癌(cervical cancer,CCA)是较为常见的几种类型。目前妇科恶性肿瘤多采用以手术、化疗及放疗为主的综合治疗,其中药物在治疗过程中发挥着至关重要的作用。然而,实际临床治疗效果常受到多种因素影响,如药物毒性导致的不良反应和部分患者对药物的耐药性、不敏感性,这些因素都限制了患者生存率的提高。最新研究表明,同一类型的肿瘤在不同个体间呈现出显著的生物学特性和药物反应异质性,这是导致临床上对同一种妇科恶性肿瘤采用相同药物治疗方法却产生不同治疗效果的重要原因。因此,为了实现妇科恶性肿瘤的个体化精准治疗,迫切需要建立与人类肿瘤高度相似的体外模型进行临床研究。药物筛选是一种用于识别和评估具有药物活性及潜在治疗作用化合物的技术,其通过对不同药物在特定条件下的作用效果进行评估,可为医师提供科学的用药指导,避免盲目试药,减少患者的治疗痛苦和经济负担。类器官模型作为药物筛选和个性化医疗的一种创新手段,在探究妇科恶性肿瘤治疗方面进行了广泛研究。类器官是一种在体外由干细胞进行三维培养而形成的具有一定空间结构的组织类似物,能高度模拟体内组织结构及功能,并展现出与人体器官极为相似的组织学和基因型特征。它在很大程度上克服了患者源性癌细胞模型、患者源性异种移植瘤模型等传统肿瘤模型的局限性,已成为肿瘤学领域的重要研究工具,为妇科恶性肿瘤药物筛选研究搭建了一个更具生理学相关性的实验平台。因此,本文将对几种临床前癌症模型的优缺点进行比较,回顾类器官技术的发展历程,阐述妇科肿瘤类器官的建立以及其在OC、EC及CCA药物筛选中的应用,同时探讨类器官技术在当前应用中存在的局限性和未来的发展愿景,旨在为未来的医学研究,特别是新药研究和个性化医疗研究带来启示。
[关键词] 妇科恶性肿瘤;类器官;药物筛选;个性化医疗
[Abstract] Gynecologic malignant tumors are among the leading diseases threatening women’s lives and health, with the highest morbidity and mortality rates among all female diseases. These tumors originate from female reproductive organs and are typically classified based on the affected site. Ovarian cancer (OC), endometrial cancer (EC) and cervical cancer (CCA) are the most common types. Currently, gynecologic malignant tumors are primarily treated with a combination of surgery, chemotherapy and radiotherapy, where drugs play a critical role in the treatment process. However, the actual clinical effectiveness is often influenced by various factors, such as adverse reactions due to drug toxicity and the drug resistance and insensitivity observed in some patients, which limit improvements in patient survival rates. Recent studies have shown that the same type of tumor exhibits significant biological characteristics and drug response heterogeneity among different individuals, which is a key factor contributing to the varied clinical outcomes when using the same drug treatment for the same type of gynecologic malignant tumor. To achieve individualized and precise treatment for gynecologic malignant tumors, there is an urgent need to develop in vitro models that closely resemble human tumors for clinical research. Drug screening is a technique used to identify and evaluate compounds with pharmacological activity and potential therapeutic effects, providing doctors with scientific guidance on drug use, thereby avoiding blind drug testing and reducing patients' therapeutic pain and economic burden by assessing the effects of different drugs under specific conditions. Organoid models have been extensively studied as an innovative drug screening tool and personalized medicine for treating gynecologic malignancies. Organoids are tissue-like structures with a specific spatial arrangement formed in vitro through three-dimensional cell culture, capable of highly simulating the structure and function of tissues in vivo and displaying histological and genotypic characteristics very similar to human organs. This approach has largely overcome the limitations of traditional tumor models, such as patient-derived cancer cell models and patient-derived tumor xenograft models, becoming an essential research tool in oncology. It provides a more physiologically relevant experimental platform for drug screening studies of gynecologic malignancies. This paper compared the advantages and disadvantages of several preclinical cancer models, reviewed the development process of organoids, and described the establishment of gynecologic oncology organoids and their application in drug screening for ovarian, endometrial, and cervical cancers. Additionally, we discussed the current limitations of organoid technology in its application and envisioned its future development, aiming to provide insights for future medical research, particularly in new drug discovery and personalized medicine.
[Key words] Gynecologic malignancies; Organoids; Drug screening; Personalized medicine
2022年国家癌症中心发布的最新数据[1]显示,中国妇科恶性肿瘤的发病率逐年上升,年新发病例数达11.93万例,发病率约为17.69/10万,死亡病例数达3.72万例,死亡率约为5.53/10万。卵巢癌(ovarian cancer,OC)、子宫内膜癌(endometrial cancer,EC)及宫颈癌(cervical cancer,CCA)等妇科恶性肿瘤对女性健康造成了巨大威胁。目前,妇科恶性肿瘤多采用以手术、化疗及放疗为主的综合治疗,其中化疗在提高手术治愈率和减少复发率方面起着重要作用。然而,一些患者对化疗药物敏感性较低或产生耐药性,限制了其生存率的提高。为了有效地解决患者耐药的临床问题,实现对不同患者的个性化治疗,掌握高效而精确的药物筛选技术至关重要。药物筛选是通过合适的筛选模型和有效的实验方法,对药物的活性和作用靶点进行筛选,从而发现具有一定生物学功能的药物,并将其从实验室研究引入临床试验的过程[2]。在这个过程中,药物筛选模型的选择和优化尤为关键。
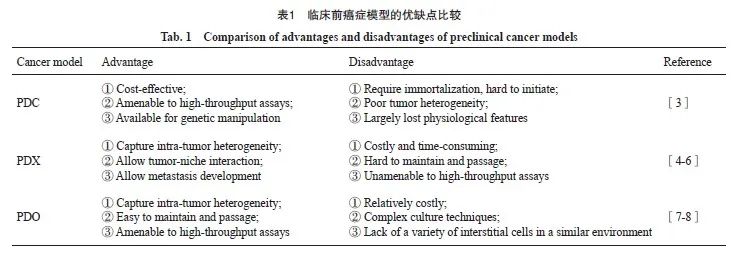
传统的患者源性肿瘤细胞(patient-derived tumor cell,PDC)模型和患者源性肿瘤异种移植瘤(patient-derived tumor xenograft,PDX)模型在药物筛选中发挥着重要作用[3],但它们各自存在一定的局限性(表1)。PDC模型虽然培养条件简单、体外扩增较快,但其在培养过程中无法模拟肿瘤三维生长的肿瘤微环境,从而丢失肿瘤细胞的生理学特征和异质性。PDX模型可充分模拟肿瘤与体内环境作用的基本过程,在一定程度上弥补了PDC模型的不足,但PDX模型的建立通常需要4~8个月的时间[4],其维护则需要更长时间的观察和传代,才能确保模型的稳定性和可靠性。然而,模型的维护成本高昂,包括小鼠的饲养费用、实验设备的维护费用以及实验人员的劳务费用等[5]。由于PDX模型是患者来源的,因此模型的个体差异较大,数据可靠性和可重复性难以保证。不同患者之间的肿瘤组织存在差异,即使在同一患者体内,不同时间点的肿瘤组织也可能存在差异。此外,由于小鼠的免疫系统被抑制,模型的免疫微环境与人体存在差异,这也可能影响数据的可靠性和可重复性,进一步增加了模型维护和通行的难度[6]。因此,在肿瘤研究领域,科学家们一直致力于开发更为先进的三维诊断模型。
患者源性肿瘤类器官(patient-derived organoid,PDO)是利用成体干细胞或多能干细胞进行体外三维培养而形成的具有一定空间结构的组织类似物。相较于PDC模型和PDX模型, PDO模型虽其成本高昂、培养技术繁杂,但其经历多次传代不仅可以保留原始肿瘤的异质性,而且易于维护和扩增,可应用于高通量药物筛选或辅助个性化治疗方案的制订[7]。除此之外, PDO模型可允许不同来源肿瘤样本(如来源于穿刺活检、胸腔积液、循环肿瘤细胞)的扩增,从而对不同分期肿瘤进行建模。尽管类器官并不是真正意义上的人体器官,但其能在结构和功能上模拟真实器官,可以最大程度地模拟体内组织结构和功能,并能长期稳定传代培养[8]。总之,类器官模型以其高度稳定性和癌症同源性等独特优势,正逐渐在生物样本库构建、疾病建模、药物测试与筛选以及个性化医疗等多个领域展现出应用价值。本文概述类器官技术的演进历程,详细介绍妇科肿瘤类器官的构建及其在药物筛选中的应用。
1 类器官的发展过程
类器官是一种在体外重现人体组织和器官生物学特征的三维细胞结构[9],尽管当前对其定义尚未达成共识,但公认其必须满足3个核心要素:① 必须涵盖建模器官中至少一种以上的细胞类型;② 必须能重现建模器官的某些特定功能;③ 其细胞间的组织结构需高度模拟建模器官的组织结构。
类器官培养的起源可以追溯到1900年。在众多的开创性实验中,1907年Wilson[10]发现了机械分离的海绵细胞可以重新聚集并自组织成为新的具有正常功能的海绵有机体,这一细胞的自组织现象在类器官形成过程中具有重要作用。自1980年起,研究人员开始使用富含胶原蛋白和层粘连蛋白的基质在三维环境中培养细胞。在此背景下,Pellegrini等[11]在人健康眼睛的角膜缘滋养细胞上成功培养出角膜缘干细胞,并将其移植到受损的眼睛中,这一成果标志着类器官技术发展的起步。随着研究的不断深入,2009年Sato等[12]成功地从原代肠组织中分离出Lgr5+干细胞,这是一种富含亮氨酸重复序列的G蛋白偶联受体5的干细胞,通过将这些干细胞接种于基质胶进行三维培养,并补充肠上皮生长所需的生长因子,最终成功地培养出肠道隐窝-绒毛类器官,这一创新实践为类器官的概念赋予了更丰富的内涵。随后这种方法也成功地应用于胃、胰腺、结肠和肝脏等类器官的培养中,推动了类器官培养技术的发展。近年来,干细胞技术、定向细胞培养及三维组织培养等前沿科技的迅猛进步,已引领类器官研究步入了一个前所未有的高速发展阶段。Nature Methods杂志更是将类器官技术评选为“2017年度技术”[13]。与此同时,类器官在模拟人体器官发育、推动精准医疗实践、再生医学探索、药物筛选优化及疾病模型构建等方面展现出巨大的发展潜力,2022年12月美国颁布了《FDA现代化法案2.0》[14],这一里程碑式的立法变革,取消了食品药品监督管理局对于此类药物进行动物实验的强制性要求,转而支持并鼓励在临床前研究中采用类器官等创新替代方法作为动物实验的补充或替代,进行药物安全性和有效性的评估,为类器官研究领域的蓬勃发展注入了强劲动力。
2 妇科恶性肿瘤类器官的建立
2.1 肿瘤类器官的建立
当前,建立肿瘤类器官的主流方法主要有两种。第一种是基质胶悬滴法,它利用浸没式细胞外基质,将源自患者肿瘤组织或活检样本中具有增殖分化能力的肿瘤细胞、多能干细胞等悬滴于基质胶中,并覆盖含有类器官培养必需成分的培养基[15]。第二种是整体培养法,是将源自患者的肿瘤组织与胶原蛋白混合而形成能够保留肿瘤微环境成分的球状体,然后将其注射到能够提供动态血管流动、输送化学物质和营养物质的微流体培养装置中,以模拟体内的动态代谢过程[16]。
2.2 基质胶悬滴法在妇科恶性肿瘤类器官建立中的应用
细胞外基质作为细胞生长的支架,不仅为细胞提供附着、生长和分化的场所,还模拟细胞生长的天然环境,有力地促进类器官的形成,并保障其生理学功能的维持。因此这种方法得到了广泛应用。
Kopper等[17]提出了一种有效的OC类器官培养方案,他们首先从原发肿瘤或转移病变中采集组织,解离出肿瘤细胞,随即将这些细胞悬浮于基膜提取物中,通过涂覆和补充培养基,成功建立了OC类器官模型,值得一提的是,他们在培养基中加入氢化可的松、毛喉素和调节蛋白β-1,显著提高了OC类器官的形成效率。Rinehart等[18]开发了一种在体外培养人子宫内膜腺上皮的方法,利用不含血清的培养基,结合基质胶作为细胞培养板涂层,使细胞以单层形式生长,随后自发形成腺体或类器官结构。随后Maru等[19]在此基础上进一步改良了EC类器官培养方法,他们将解离出的癌细胞在固化的基膜培养物上培养过夜,然后用另一层基膜培养物覆盖活细胞。这种方案将类器官的培养成功率从45%大幅度提升至90%。Boretto等[20]的研究深入探讨了培养基成分对EC类器官生长的影响,发现WNT信号增强剂RSPO1是类器官生长不可或缺的因子,并通过调整培养基成分,实现了EC类器官的长期体外增殖。此外,Maru等[21]首次成功地建立了基于宫颈透明细胞癌患者的肿瘤类器官模型,他们将患者来源的细胞种植在固化的基质胶上,并在无血清的培养基上播散,形成具有多个出芽的小型或大型固体结构,这些结构在包埋基质胶中连续传代后依然保持生长,并成功培养了长达6个月。
2.3 整体培养法在妇科恶性肿瘤类器官建立中的应用
相较于传统的2D培养模式,整体培养法独具创新性,它在三维空间中模拟了肿瘤细胞的自然生长环境,更接近生物体内的真实情境。这一方法显著增强了模拟肿瘤侵袭和转移过程的能力,从而提升了预测肿瘤对各种治疗反应的准确度。
Neal等[22]巧妙地利用气液界面培养法将肿瘤作为一个整体进行类器官培养,发现来自原发肿瘤碎片中的成纤维细胞与各种免疫细胞群(如T细胞、B细胞、巨噬细胞等)能够在这种培养环境中持续增殖数周,同时保留了原始肿瘤中T细胞克隆的多样性。目前气液界面培养法已在黑色素瘤、肾细胞癌和非小细胞肺癌等多种肿瘤的免疫检查点疗法中初步应用[23],但其在妇科恶性肿瘤领域的探索仍处于初始阶段。Dong等[24]则进一步推动了这一领域的发展,他们研发了一种可以提供连续、可控的氧气递质和药物的灌注空气培养系统,将新鲜的人卵巢肿瘤组织放在自制灌注空气培养系统上进行了交替培养,发现顺铂处理能够诱导caspase-3和PD-L1表达裂解的增加,凸显了不同患者对药物治疗反应的异质性。Tian等[25]将子宫内膜上皮细胞和基质细胞结合,并采用改进的基质胶和气液界面培养方法,首次构建了一种新型的子宫内膜-腔上皮复合体,这一复合体不仅重现了人类子宫内膜的解剖学结构、细胞组成及激素诱导的月经周期变化,还展现了其基因表达谱及动态纤毛发生过程。这些突破性的研究为后续研究提供了新的视角和工具,为拓展未来的治疗策略奠定了坚实基础。
3 类器官在妇科恶性肿瘤药物筛选治疗研究中的应用
通过建立肿瘤类器官模型和肿瘤类器官库,我们能够更为准确地评估药物的抗肿瘤活性、药物毒性,并确定药物作用靶点以及进行药敏性筛查等工作。这一模型的引入,有望为妇科恶性肿瘤的治疗带来新的突破。
3.1 OC
OC是全球第三常见的妇科恶性肿瘤,每年新增的确诊病例超过24万例,患者5年生存率低于45%[26]。鉴于OC的高度异质性,对肿瘤异质性的准确评估在预测耐药性和探索有效治疗方法方面显得尤为重要。
近年来,多项研究致力于建立和应用OC类器官模型以推动治疗进展。Kopper等[17]构建了56个OC类器官模型,成功率高达65%,这些模型几乎涵盖了OC所有的病理学类型(如浆液性癌、黏液性癌、浆液性交界性肿瘤、黏液性交界性肿瘤、子宫内膜样癌和透明细胞癌等),为疾病的深入研究提供了有力工具。Phan等[27]则创新性地利用96孔板,通过环形接种来自细胞系或手术标本的单细胞悬浮液,构建了一个小型高通量的类器官筛选系统,并成功地培养出2例高级别浆液性OC患者和1例OC肉瘤患者的类器官,为实现高通量药物筛选奠定了基础。Gotimer 等[28]建立了一个源自高级别浆液性OC的短期类器官平台。而Nanki等[29]则对23种美国食品药品监督管理局批准的药物进行了敏感性测试,结果证明这些类器官模型在个性化治疗药物的筛选中具有巨大潜力。Hill等[30]通过构建33个高级别浆液性OC类器官,并开展药物敏感性分析,准确预测了对共济失调毛细血管扩张突变基因Rad3相关激酶(ataxia-telangiectasia and Rad3-related,ATR)抑制剂、多腺苷二磷酸核糖聚合酶[poly (ADP-ribose) polymerase,PARP]抑制剂和prexasertib等药物的敏感性。Kopper等[17]的研究进一步证实了类器官模型对临床化疗药物的敏感性,并揭示了患者内部和患者间的异质性。此外,不同患者来源的OC类器官对于常用的化疗药物和靶向药物反应的差异性也进一步验证了其在药物筛选中的适用性[31]。然而,临床上OC治疗常采取联合用药方案。为此,De Witte等[32]的研究将基因组测序的OC患者纳入实验,对卡铂和紫杉醇的联合药物作用进行了研究,结果显示,OC类器官在药物反应上同样呈现出患者间和肿瘤内部的异质性。这一发现使得类器官药物筛选模型更贴近临床应用。尽管免疫疗法如细胞毒性T淋巴细胞相关抗原4 (cytotoxic T lymphocyte associated antigen-4,CTLA-4)和程序性死亡蛋白-1(programmed death-1,PD-1 ) /程序性死亡蛋白配体-1 (programmed death ligand-1,PD-L1)抑制剂在OC治疗中仍处于临床试验阶段,但已有研究[33]发现类器官在免疫治疗研究中的价值,然而,目前尚无报道证明类器官-免疫细胞共培养技术可用于预测免疫治疗的临床疗效,这一领域在OC中的应用仍有待进一步探索。
3.2 EC
EC作为女性群体中第5大常见癌症,位列妇科恶性肿瘤前列,其发病率逐年上升[34]。近年来,EC类器官取得了显著突破。Rinehart等[18]成功开发了一种在体外培养人子宫内膜腺上皮的方法,这一创新方法为构建生物库、运用高通量测序技术深入探索EC的分子类型和遗传特征提供了平台。Higa等[35]利用96孔或384孔微板,开发出高效的高通量筛选测定方法,通过细胞活力测定法精确测量细胞中腺苷三磷酸(adenosine triphosphate,ATP)的量,以评估抗癌药物的实际效果。Girda等[36]通过构建EC类器官模型,证实紫杉醇、酪氨酸激酶抑制剂和信号转导及转录激活因子3(signal transduction and activator of transcription 3,STAT3)抑制剂对EC类器官的生长具有抑制作用,并通过分析单个肿瘤的内分泌谱和药物敏感性,发现STAT3抑制剂BBI608有望成为EC的新型靶向治疗药物。此外,Tamura等[37]聚焦对标准治疗药物(如紫杉醇和卡铂)高耐药性的患者,通过建立相应的类器官模型,验证了硼替佐米、卡非佐米、地那昔布和帕诺比诺司他对这类患者的肿瘤细胞生长和增殖具有显著抑制作用,为开发EC治疗新方案的研究提供了更多选择。目前,EC类器官已在化疗和免疫治疗等多个领域展现出广泛的应用前景。
3.3 CCA
CCA是全世界女性中常见的恶性肿瘤之一,尽管随着人乳头状瘤病毒(human papilloma virus,HPV)疫苗的广泛接种、癌前筛查的普及和及时的手术治疗让CCA的发病率及死亡率显著下降,但转移、复发的CCA却很难达到彻底根治,也是患者死亡的主要原因[38]。目前,临床上缺乏能精准评估CCA治疗效果的生物标志物,因此,急需一种能够基于肿瘤特性预测患者治疗反应的新型临床模型。
Seol等[39]从CCA不同亚型中构建了4种类器官,并发现它们对蛋白酶体抑制剂和组蛋白去乙酰化酶抑制剂敏感,但对其他抗癌药物反应各异,这一发现凸显了癌症内部异质性在治疗耐药性和个性化医疗中的核心作用。尽管有关CCA放射疗法的研究较少,但最新研究已揭示类器官在评估放射敏感性方面的潜力。Seol等[39]通过辐射剂量依赖性生存分析验证了肿瘤类器官对体外照射的反应,并与患者组织学肿瘤消退分级进行了匹配分析,结果显示,鳞状细胞癌(squamous cell carcinoma,SqCa)和子宫颈绒毛管状腺癌(villoglandular adenocarcinoma of the uterine cervix,VGA)对放疗敏感,而腺癌(adenocarcinoma,AdCa)和大细胞神经内分泌癌则对放疗表现出耐药性。有研究[40-41]对1组CCA类器官进行了药物筛选分析,通过绘制剂量-反应曲线图,深入揭示了CCA类器官对不同药物的不同反应。这些差异的反应性在药物和放射疗法中均有所体现,特别是在当前动物实验受限的背景下,一个全面的类器官平台能够为我们个性化地预测不同个体对药物的反应提供可能,从而为制订个体化治疗方案和开发新药奠定了基础。
4 类器官的局限性与展望
在众多肿瘤诊断模型中,PDO模型凭借其独特的优势正在迅速崛起。然而,肿瘤类器官的研究也面临着一些亟待解决的问题。首要挑战在于如何精确地模拟真实的体内肿瘤微环境。目前,肿瘤类器官的构建不能完全复制肿瘤所需血管、免疫细胞、间质和神经等支持结构,这在一定程度上会影响药物筛选的准确性和个性化医疗的指导。尽管有研究尝试通过引入免疫细胞和特异性白细胞介素来维持免疫细胞的功能,但完全模拟体内真实微环境的类器官模型仍需进一步研发和应用。其次,肿瘤类器官的建立成本较高,依赖于大量的细胞因子和基质胶等原材料[42]。目前PDO模型多采用动物源性基质凝胶或胶原蛋白作为支撑材料,以构建三维结构,然而这些细胞外基质中的未知细胞外成分可能会改变肿瘤原有的异质性,进而影响实验结果的稳定性和可重复性。此外,随着PDO模型和基因编辑技术的不断发展,PDO层面进行基因操作在妇科肿瘤研究中的应用前景广阔。Godbole等[43]探讨了细胞外囊泡可作为基因编辑疗法在上皮性OC中的潜在递送平台,这为PDO层面的基因操作提供了新的递送策略。Buckley等[44]利用一种基于游离DNA甲基化的液体活检方法评估高级别浆液性OC的风险,为PDO层面的基因操作提供了潜在的分子标志物。然而,在PDO层面进行基因操作仍面临巨大技术挑战,例如,PDO模型培养成功率、稳定性和可重复性等方面的问题需要进一步的研究和改进;进行基因操作的安全性和有效性需要进一步验证;跨学科合作和临床试验的加强也是推动该领域发展的关键。因此为了实现高通量、高度同质化的PDO模型生产,并引入自动化操作、智能监测和精准控制,亟需研发更为尖端的算法和技术手段[45]。当前,类器官技术正携手生物工程、人工智能和基因编辑技术共同推进预测模型的构建、精准疾病模拟以及个性化医疗方案的制订,有望重塑我们对体外建模的看法[46]。
随着类器官技术的快速发展,妇科恶性肿瘤的类器官生物库也逐步建立,这无疑为未来的研究奠定了坚实基础。鉴于肿瘤类器官在药物筛选中的核心作用,我们有理由相信,它将在个性化医疗中发挥越来越重要的作用,为妇科恶性肿瘤患者提供更加精准和有效的治疗方案,推动精准医学在妇科肿瘤治疗领域的深入发展。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
蒋媛媛:参与文章选题,文献和资料分析与解释,文章撰写和修改;
魏文斐:参与文章选题和修改,对文章的知识性内容作审阅;
吴靖雅:参与文章选题和修改,对文章的知识性内容作审阅;
黎华文:参与文章选题和修改,文章监管与指导,对文章的知识性内容作审阅。
[参考文献]
[1] HAN B F, ZHENG R S, ZENG H M, et al. Cancer incidence and mortality in China, 2022[J]. J Natl Cancer Cent, 2024, 4(1): 47-53.
[2] 孙雅倩. 三维细胞模型在抗癌药物筛选中的研究进展[J]. 现代诊断与治疗, 2023, 34(11): 1629-1631.
SUN Y Q. Research progress of 3D cell model in anti-cancer drug screening[J]. Mod Diagn Treat, 2023, 34(11): 1629-1631.
[3] 张 宁, 杨 慧, 王 鹏. 类器官在癌症研究、药物筛选与精准诊疗中的应用进展[J].北京大学学报(医学版), 2022, 54(5): 814-21.
ZHANG N, YANG H, WANG P. Advances in the application of organoids in cancer research, drug screening, and precision diagnosis and treatment [J]. J Peking Univ (Health Sci), 2022, 54(5): 814-21.
[4] LIU Y H, WU W T, CAI C J, et al. Patient-derived xenograft models in cancer therapy: technologies and applications[J]. Signal Transduct Target Ther, 2023, 8(1): 160.
[5] JIN J K, YOSHIMURA K, SEWASTJANOW-SILVA M, et al. Challenges and prospects of patient-derived xenografts for cancer research[J]. Cancers, 2023, 15(17): 4352.
[6] ZANELLA E R, GRASSI E, TRUSOLINO L. Towards precision oncology with patient-derived xenografts[J]. Nat Rev Clin Oncol, 2022, 19(11): 719-732.
[7] CHEN H D, ZHUO Q F, YE Z, et al. Organoid model: a new hope for pancreatic cancer treatment?[J]. Biochim Biophys Acta Rev Cancer, 2021, 1875(1): 188466.
[8] ZHAO Z X, CHEN X Y, DOWBAJ A M, et al. Organoids[J]. Nat Rev Methods Primers, 2022, 2: 94.
[9] GÓMEZ-ÁLVAREZ M, AGUSTINA-HERNÁNDEZ M, FRANCÉS-HERRERO E, et al. Addressing key questions in organoid models: who, where, how, and why?[J]. Int J Mol Sci, 2023, 24(21): 16014.
[10] WILSON H V. A new method by which sponges may be artificially reared[J]. Science, 1907, 25(649): 912-915.
[11] PELLEGRINI G, TRAVERSO C E, FRANZI A T, et al. Longterm restoration of damaged corneal surfaces with autologous cultivated corneal epithelium[J]. Lancet, 1997, 349(9057): 990-993.
[12] SATO T, VRIES R G, SNIPPERT H J, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[J]. Nature, 2009, 459(7244): 262-265.
[13] Method of the year 2017: organoids[J]. Nat Meth, 2018, 15: 1.
[14] T h e U n i t e d S t a t e s C o n g r e s s . S . 5 0 0 2 ( 1 1 7 t h ) : F D A modernization Act 2.0[R/OL]. 2022[2024-01-01].
[15] YUKI K, CHENG N, NAKANO M, et al. Organoid models of tumor immunology[J]. Trends Immunol, 2020, 41(8): 652-664.
[16] SUN C P, LAN H R, FANG X L, et al. Organoid models for precision cancer immunotherapy[J]. Front Immunol, 2022, 13: 770465.
[17] KOPPER O, DE WITTE C J, LÕHMUSSAAR K, et al. An organoid platform for ovarian cancer captures intra- and interpatient heterogeneity[J]. Nat Med, 2019, 25(5): 838-849.
[18] RINEHART C A JR, LYN-COOK B D, KAUFMAN D G. Gland formation from human endometrial epithelial cells in vitro[J]. In Vitro Cell Dev Biol, 1988, 24(10): 1037-1041.
[19] MARU Y, TANAKA N, ITAMI M, et al. Efficient use of patientderived organoids as a preclinical model for gynecologic tumors[J]. Gynecol Oncol, 2019, 154(1): 189-198.
[20] BORETTO M, MAENHOUDT N, LUO X L, et al. Patientderived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening[J]. Nat Cell Biol, 2019, 21(8): 1041-1051.
[21] MARU Y, TANAKA N, EBISAWA K, et al. Establishment and characterization of patient-derived organoids from a young patient with cervical clear cell carcinoma[J]. Cancer Sci, 2019, 110(9): 2992-3005.
[22] NEAL J T, LI X N, ZHU J J, et al. Organoid modeling of the tumor immune microenvironment[J]. Cell, 2018, 175(7): 1972-1988.e16.
[23] 俞东红, 曹 华, 王心睿. 类器官的研究进展及应用[J].生物工程学报, 2021, 37(11): 3961-3974.
YU D H, CAO H, WANG X R. Advances and applications of organoids: a review[J]. Chin J Biotechnol, 2021, 37(11): 3961-3974.
[24] DONG M, BÖPPLE K, THIEL J, et al. Perfusion air culture of precision-cut tumor slices: an ex vivo system to evaluate individual drug response under controlled culture conditions[J]. Cells, 2023, 12(5): 807.
[25] TIAN J W, YANG J, CHEN T W, et al. Generation of human endometrial assembloids with a luminal epithelium using airliquid interface culture methods[J]. Adv Sci, 2023, 10(30): e2301868.
[26] QU J J, KALYANI F S, LIU L, et al. Tumor organoids: synergistic applications, current challenges, and future prospects in cancer therapy[J]. Cancer Commun, 2021, 41(12): 1331-1353.
[27] PHAN N, HONG J J, TOFIG B, et al. A simple high-throughput approach identifies actionable drug sensitivities in patientderived tumor organoids[J]. Commun Biol, 2019, 2: 78.
[28]GOTIMER K, CHEN H, LEISEROWITZ G S, et al. Short-term organoid culture for drug sensitivity testing in high-grade serous ovarian cancer[J]. Gynecol Oncol, 2019, 153(3): e13.
[29]NANKI Y, CHIYODA T, HIRASAWA A, et al. Patient-derived ovarian cancer organoids capture the genomic profiles of primary tumours applicable for drug sensitivity and resistance testing[J]. Sci Rep, 2020, 10(1): 12581.
[30]HILL S J, DECKER B, ROBERTS E A, et al. Prediction of DNA repair inhibitor response in short-term patient-derived ovarian cancer organoids[J]. Cancer Discov, 2018, 8(11): 1404-1421.
[31]MAENHOUDT N, DEFRAYE C, BORETTO M, et al. Developing organoids from ovarian cancer as experimental and preclinical models[J]. Stem Cell Reports, 2020, 14(4): 717-729.
[32]DE WITTE C J, ESPEJO VALLE-INCLAN J, HAMI N, et al. Patient-derived ovarian cancer organoids mimic clinical response and exhibit heterogeneous inter- and intrapatient drug responses[J]. Cell Rep, 2020, 31(11): 107762.
[33]BAR-EPHRAIM Y E, KRETZSCHMAR K, CLEVERS H. Organoids in immunological research[J]. Nat Rev Immunol, 2020, 20(5): 279-293.
[34]中国抗癌协会妇科肿瘤专业委员会. 妇科恶性肿瘤多学科诊疗中国专家共识(2022年版)[J]中国癌症杂志. 2022, 32(8): 747-56.
China Anti-Cancer Association Gynecologic Oncology Professional Committee. Consensus of Chinese experts on multidisciplinary team of gynecological malignant tumors (2022 edition)[J]. China Oncology, 2022, 32(8):747-56.
[35]HIGA A, TAKAHASHI N, HIYAMA G, et al. High-throughput in vitro assay using patient-derived tumor organoids[J]. J Vis Exp, 2021, (172).
[36]GIRDA E, HUANG E C, LEISEROWITZ G S, et al. The use of endometrial cancer patient-derived organoid culture for drug sensitivity testing is feasible[J]. Int J Gynecol Cancer, 2017, 27(8): 1701-1707.
[37]TAMURA H, HIGA A, HOSHI H, et al. Evaluation of anticancer agents using patient-derived tumor organoids characteristically similar to source tissues[J]. Oncol Rep, 2018, 40(2): 635-646.
[38]DAS S, BABU A, MEDHA T, et al. Molecular mechanisms augmenting resistance to current therapies in clinics among cervical cancer patients[J]. Med Oncol, 2023, 40(5): 149.
[39]SEOL H S, OH J H, CHOI E, et al. Preclinical investigation of patient-derived cervical cancer organoids for precision medicine[J]. J Gynecol Oncol, 2023, 34(3): e35.
[40]FONG E L S, TOH T B, LIN Q X X, et al. Generation of matched patient-derived xenograft in vitro-in vivo models using 3D macroporous hydrogels for the study of liver cancer[J]. Biomaterials, 2018, 159: 229-240.
[41]BORETTO M, COX B, NOBEN M, et al. Development of organoids from mouse and human endometrium showing endometrial epithelium physiology and long-term expandability[J]. Development, 2017, 144(10): 1775-1786.
[42]MARX V. Closing in on cancer heterogeneity with organoids[J]. Nat Methods, 2024, 21(4): 551-554.
[43]GODBOLE N, QUINN A, CARRION F, et al. Extracellular vesicles as a potential delivery platform for CRISPR-Cas based therapy in epithelial ovarian cancer[J]. Semin Cancer Biol, 2023, 96: 64-81.
[44]BUCKLEY D N, LEWINGER J P, GOODEN G, et al. OvaPrint-a cell-free DNA methylation liquid biopsy for the risk assessment of high-grade serous ovarian cancer[J]. Clin Cancer Res, 2023, 29(24): 5196-5206.
[45]SHI H Y, KOWALCZEWSKI A, VU D, et al. Organoid intelligence: integration of organoid technology and artificial intelligence in the new era of in vitro models[J]. Med Nov Technol Devices, 2024, 21: 100276.
[46]YAO Q G, CHENG S, PAN Q L, et al. Organoids: development and applications in disease models, drug discovery, precision medicine, and regenerative medicine[J]. MedComm, 2024, 5(10): e735.


