迄今最大研究,可切除肺淋巴上皮瘤样癌围手术期免疫联合化疗显著改善pCR/MPR/EFS
时间:2025-01-06 20:46:36 热度:37.1℃ 作者:网络
原发性肺淋巴上皮瘤样癌(PLELC)是一种罕见的非小细胞肺癌亚型。本研究旨在比较围手术期 PD-1/PD-L1 抑制剂+化疗vs仅化疗在 II-IIIB 期 PLELC 患者中的疗效和安全性。本回顾性研究纳入 II-IIIB 期 PLELC 患者。这些患者接受了围手术期免疫+化疗(IO-Chemo)或仅化疗(Chemo)。收集有关患者特征、治疗、疗效、毒性和病理学的数据。主要终点是主要病理缓解(MPR)和无事件生存期(EFS)。次要终点包括客观缓解率(ORR)、总生存期(OS)和不良事件(AE)。共纳入 72 例患者。免疫+化疗组的 ORR 为 75.0%,化疗组为 58.3%(比值比 [OR] 0.47 [95% CI 0.15–1.42];P = 0.200)。免疫+化疗组达到主要病理缓解(MPR)的患者百分比为 54.2%,化疗组为 12.5%(OR 1.91 [95% CI 1.22-2.99];P < 0.001)。免疫+化疗组 33.3% 的患者达到病理完全缓解(pCR),而化疗组这一比例为 4.2%(OR 1.44 [95% CI 1.08-1.92];P = 0.002)。免疫+化疗组的中位 EFS 未达到,而化疗组为 35.0 个月(95 % CI 14.2-55.8;风险比 [HR] 0.42 [95 % CI 0.19-0.93];P = 0.031)。中位随访 47.0 个月后,中位总生存期(OS)未达到。多变量分析表明,PD-1/PD-L1 抑制剂联合治疗与较长的 EFS 独立相关(HR = 0.32 [95 % CI 0.11–0.95];P = 0.043)。任何级别的 AE 在免疫+化疗组中的发生率为 91.7%,在化疗组为 89.6%。本研究表明,在可切除 PLELC 患者中,与仅化疗相比,围手术期 PD-1/PD-L1 抑制剂+化疗的 EFS 显著较长,达到 MPR 和 pCR 的患者百分比更高,安全性可耐受。
研究背景
原发性肺淋巴上皮瘤样癌(PLELC)是非小细胞肺癌(NSCLC)的一种罕见且独特的亚型,占 NSCLC 病例的 <1%。这种癌症的病因与 EB 病毒(EBV)密切相关,肿瘤细胞内 EBV 编码的 RNA(EBER)的检测是诊断的关键。虽然在 2021 WHO 胸部肿瘤分类中被归类为“鳞状细胞癌”,但 PLELC 的临床病理特征和突变谱与腺癌和鳞状细胞癌不同,因此这一新分类存在争议。
大多数 PLELC 患者诊断时处于早期,有根治性切除的可能性。然而,对于 I-III 期疾病患者,尽管进行了手术干预,1 年无进展生存率仍为 70%,提示复发和转移仍然是重大挑战。因此,迫切需要确定可以改善局部晚期 PLELC 患者预后的治疗方法。由于 PLELC 的发病率低,关于 PLELC 的新辅助或辅助治疗管理没有确立的共识,临床医生通常依赖 NSCLC 管理指南。
值得注意的是,程序性细胞死亡配体 1(PD-L1)在 PLELC 中的表达显著较高,提示抗程序性细胞死亡 1(PD-1)/PD-L1 疗法具有前景。我们以及其他研究人员的研究结果表明,PD-1/PD-L1 抑制剂联合铂类化疗可为晚期 PLELC 患者带来积极结局。临床试验表明新辅助或围手术期免疫联合化疗对可切除 NSCLC 有益,但仍然缺乏证据支持围手术期免疫联合化疗对可切除 PLELC 的疗效。
为了填补这一空缺,我们进行了这项回顾性研究,比较围手术期抗 PD-1/PD-L1 免疫疗法联合化疗与仅化疗在可切除 PLELC 患者中的疗效和安全性。
研究方法
这项回顾性临床研究涉及中山大学肿瘤防治中心 2010 年 1 月至 2024 年 3 月期间的 II-IIIB 期 PLELC 患者,这些患者在接受根治性手术前接受了抗 PD-1/PD-L1 治疗联合化疗或仅化疗。纳入标准包括:(1)年龄超过 18 岁;(2)组织病理学证实为 PLELC;(3)排除起源于鼻咽癌的肺转移;(4)根据第 8 版肺癌分期系统,可切除 II-IIIB 期患者;(5)接受围手术期抗 PD-1/PD-L1 抑制剂+化疗或仅化疗。
研究结果
患者
72 例患者符合本研究条件。选择过程的流程图如图 1 所示。基线临床病理特征总结于表 1。整个队列的中位年龄为 51 岁(范围,29-71 岁)。女性占比高于男性(分别为 56.9% 和 43.1%)。所有患者的 ECOG 体能状态为 0 或 1,绝大多数患者(57 例)(79.2%)没有吸烟史。根据 TNM 分期系统,0 例患者诊断为 IIA 期疾病,8 例患者(11.1%)为 IIB 期,26 例患者(36.1%)为 IIIA 期,38 例患者(52.8%)为 IIIB 期。38 例患者(52.8%)的肿瘤进行了经典 EGFR 突变或 ALK 易位检测,结果均为阴性。所有病例均为 EBER 阳性。17 例患者(23.6%)有基线 EBV DNA 数据,中位滴度为 3.37 × 103 拷贝/mL(范围,6.35 × 101 至 1.74 × 105 拷贝/mL)。24 例患者(33.3%)接受 PD-1/PD-L1 抑制剂+化疗(IO-Chemo组),48 例患者(66.7%)接受仅化疗(Chemo组)。关于化疗方案,64 例患者(88.9%)接受铂类加紫杉烷类(TP)或吉西他滨(GP)治疗。在所有患者中,实现完全(R0)切除的患者比例为免疫+化疗组 95.8% vs 化疗组 97.9% ,两组中不完全(R1)切除的患者比例分别为 4.2% 和 2.1%。只有 5 例患者有 PD-L1 表达结果,所有患者均为 PD-L1 阳性(PD-L1 TPS ≥1 %),其中 3 例患者 PD-L1 TPS ≥50 %。两组的基线特征相似。
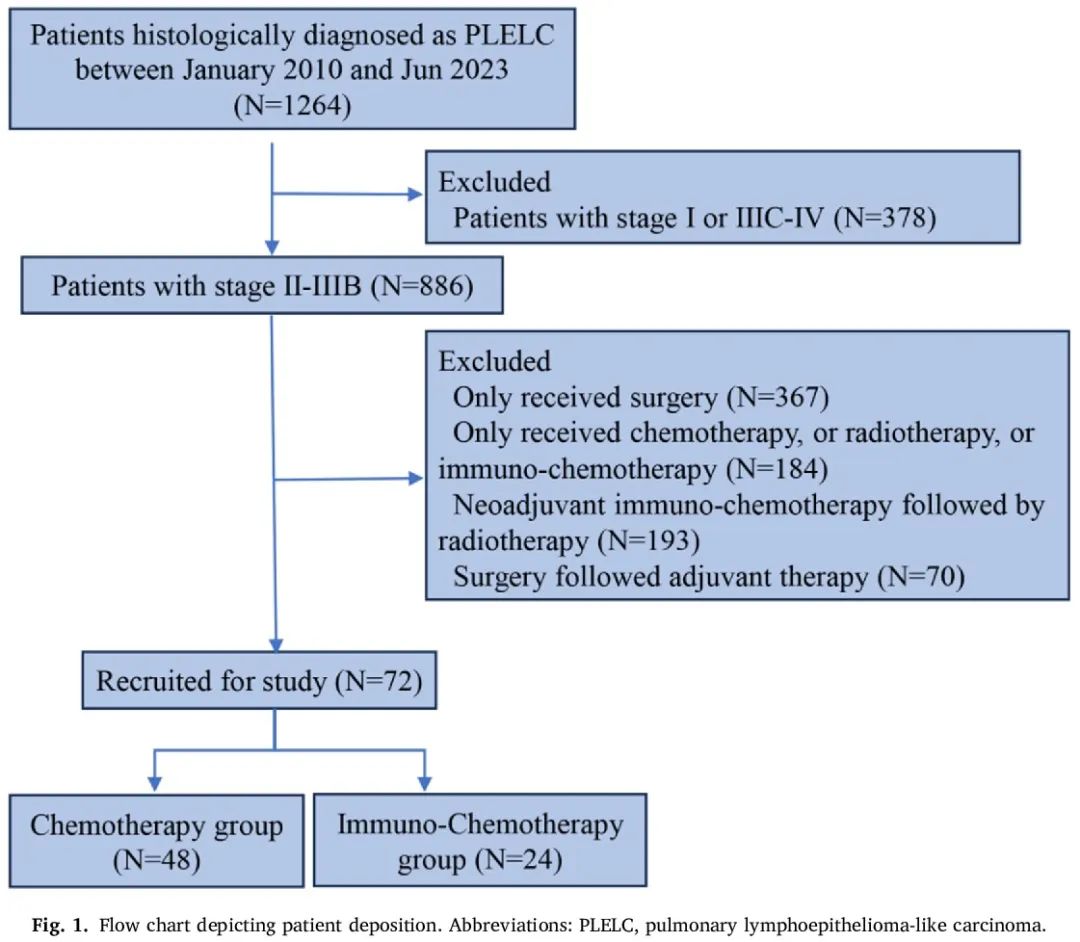
图1
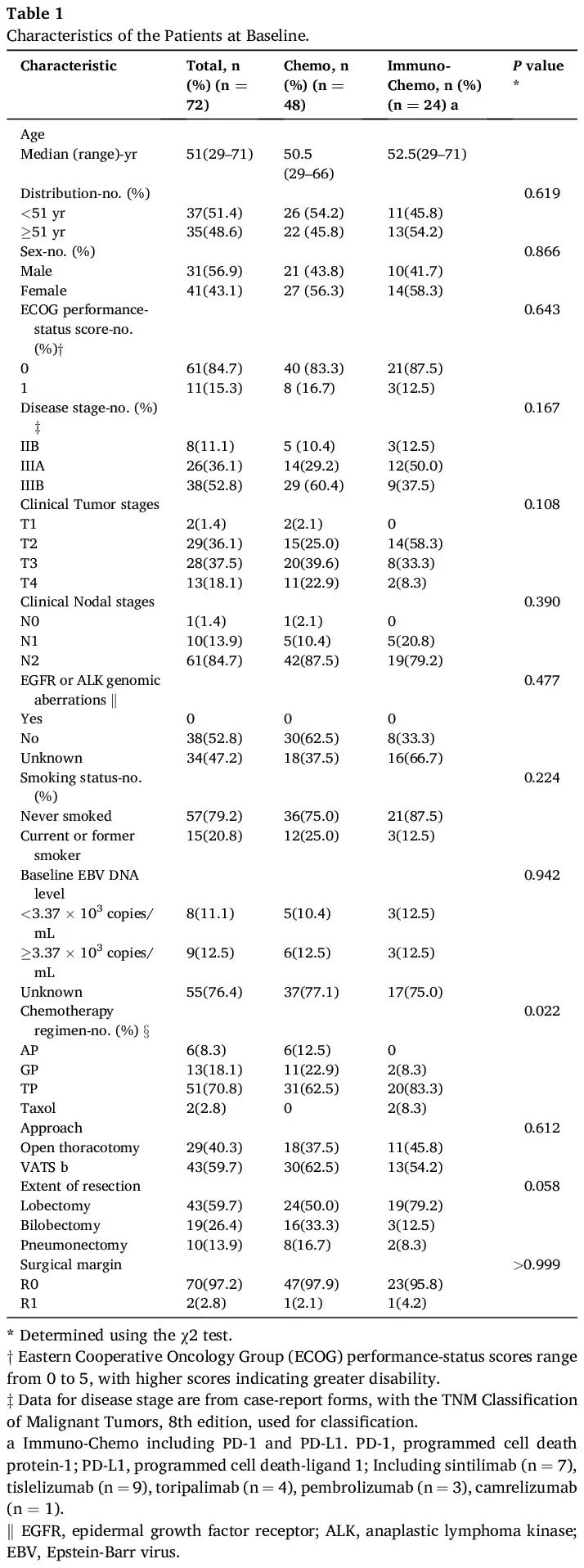

表1
疗效
截至 2024 年 3 月数据收集日期,整个队列的中位随访时间为 47.0 个月(范围,2.0-135.0 个月),免疫+化疗组为 25.0 个月(范围,11.0-54.0 个月),化疗组为 73.0 个月(范围,2.0-135.0 个月)。两组均接受了中位 3 个周期的化疗(范围,2-6 个周期)。免疫+化疗组接受了中位 8 个周期的辅助免疫治疗(范围,3-17 个周期)。疗效数据见表 2。影像学结果显示,免疫+化疗组 17 例(70.8%)患者和化疗组 28 例(58.3%)达到部分缓解(PR)作为最佳反应,免疫+化疗组 5 例(20.8%)和化疗组 18 例(37.5%)达到疾病稳定(SD)。免疫+化疗组 1 例患者达到完全缓解(CR)。新辅助治疗后,免疫+化疗组的客观缓解率(ORR)为 75.0%,化疗组为 58.3%(比值比 [OR] 0.47 [95% CI 0.15-1.42];P = 0.200)。
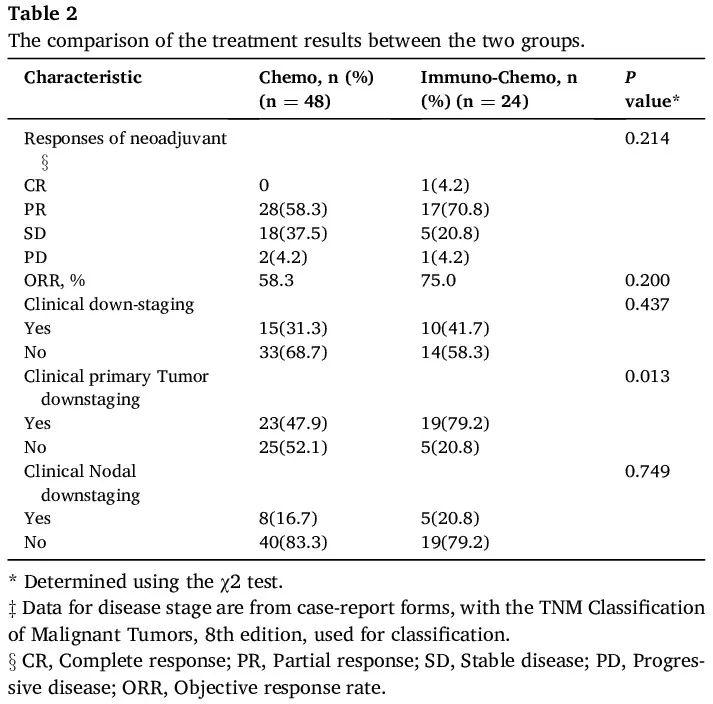
表2
免疫+化疗组 10 例患者(41.7%)和化疗组 15 例患者(31.3%)实现临床 TNM 降期(疾病分期较基线降低)(OR 1.57 [95% CI 0.59-4.08];P = 0.437)。免疫+化疗组 5 例患者(20.8%)和化疗组 8 例患者(16.7%)获得临床淋巴结降期(OR 1.32 [95% CI 0.41-4.23];P = 0.749)。值得注意的是,在免疫+化疗组 19 例患者(79.2%)和化疗组 23 例患者(47.9%)中观察到临床原发性肿瘤降期(OR 2.50 [95% CI 1.10–5.71];P = 0.013)。
整个队列的中位无事件生存期(EFS)为 45.0 个月(95 % CI 27.3-62.7 个月)。免疫+化疗组的中位 EFS 未达到,化疗组为 35.0 个月(95 % CI 14.2-55.8 个月)(风险比 [HR] 0.42 [95 % CI 0.19-0.93];P = 0.031;图 2A 和 B,表 3)。整个队列中共有 32 例(44.4%)患者出现复发或转移,包括免疫+化疗组 4 例(16.7%)患者和化疗组 28 例(58.3%)患者(OR 0.14 [95 % CI 0.05-0.50];P = 0.001)。
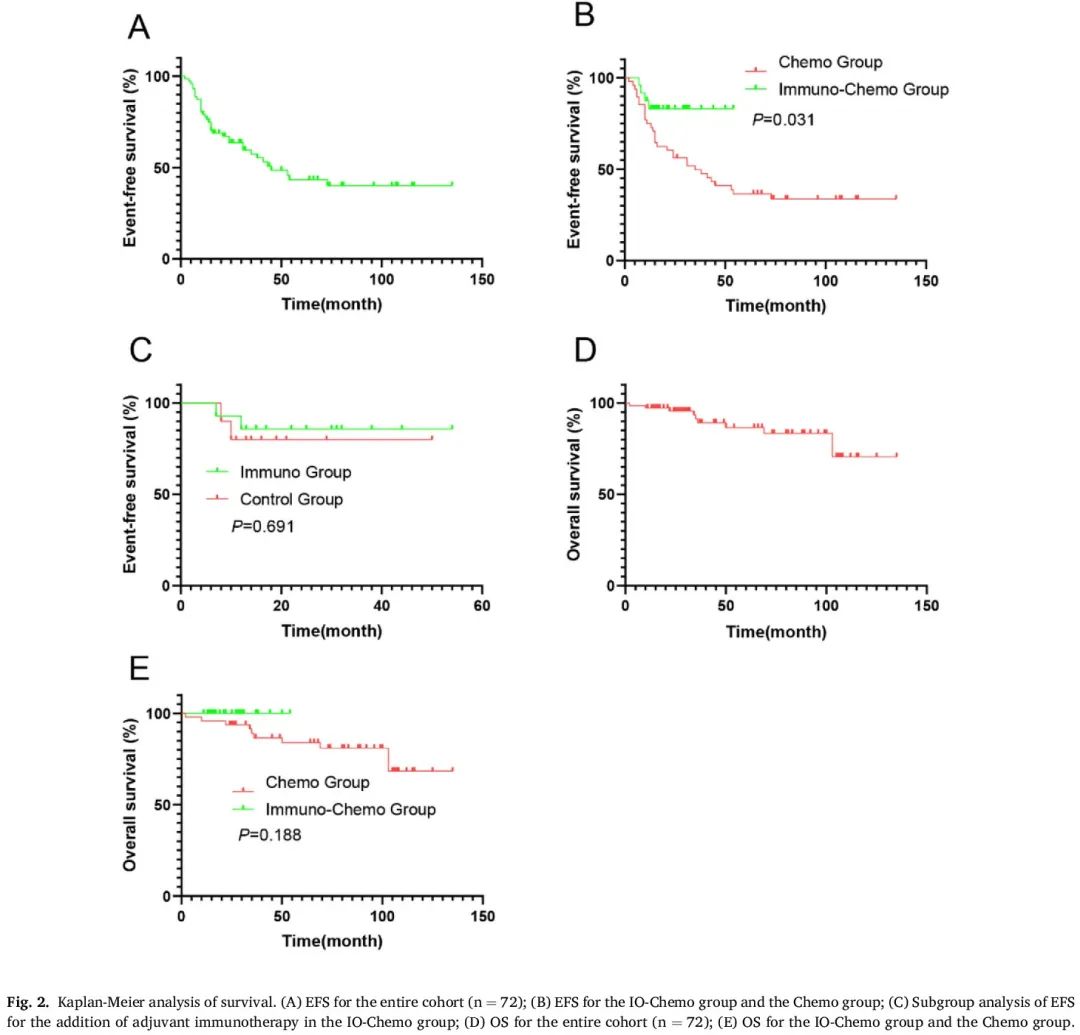
图2
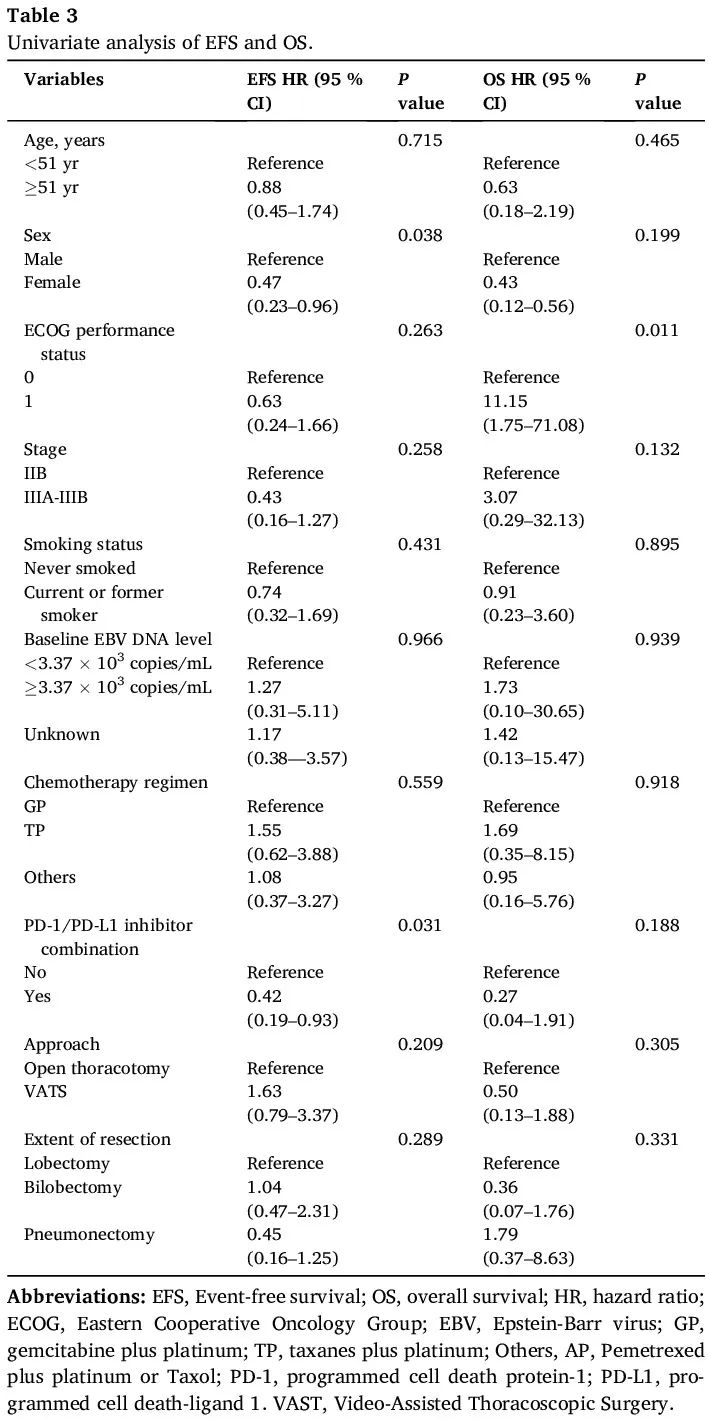
表3
根治性手术后,化疗组 30 例(62.5%)患者和免疫+化疗组 17 例(70.8%)患者接受辅助治疗。在免疫+化疗组中,14 例(58.3%)患者接受免疫维持治疗。然而,在新辅助化疗+免疫治疗中加入辅助免疫治疗与 EFS 改善无关(HR,0.67;95% CI,0.09-4.93;P = 0.691;图 2C)。
截至最后一次随访之日,化疗组有 10 例患者(20.8%)死亡,而免疫+化疗组没有报告死亡。估计的中位总生存期(OS)在两组中均未达到,两组的 OS 无统计学显著差异(HR 0.27 [95 % CI 0.04–1.91];P = 0.188;图 2D 和 E,表 3)。
病理缓解情况
在免疫+化疗组中,13 例患者(54.2%)达到主要病理缓解(MPR),而化疗组有 6 例患者(12.5%)达到 MPR(OR 1.91;[95 % CI 1.22–2.99];P < 0.001)。免疫+化疗组 8 例(33.3%)患者和化疗组 2 例(4.2%)患者实现病理完全缓解(pCR)(OR 1.44;[95 % CI 1.08–1.92];P = 0.002)。免疫+化疗组 20 例患者(83.3%)和化疗组 23 例患者(47.9%)获得病理降期(OR 3.13;[95 % CI 1.227–7.959];P = 0.005)。此外,在免疫+化疗组 18 例(75.0%)患者和化疗组 19 例(39.6%)患者中观察到病理淋巴结降期(OR 2.42;[95 % CI 1.165–5.014];P = 0.006),在免疫+化疗组 20 例(83.3%)患者和化疗组 30 例(62.5%)患者中观察到病理原发性肿瘤降期(OR 2.25;[95 % CI 0.856–5.913];P = 0.103)。这些数据如表 4 所示。
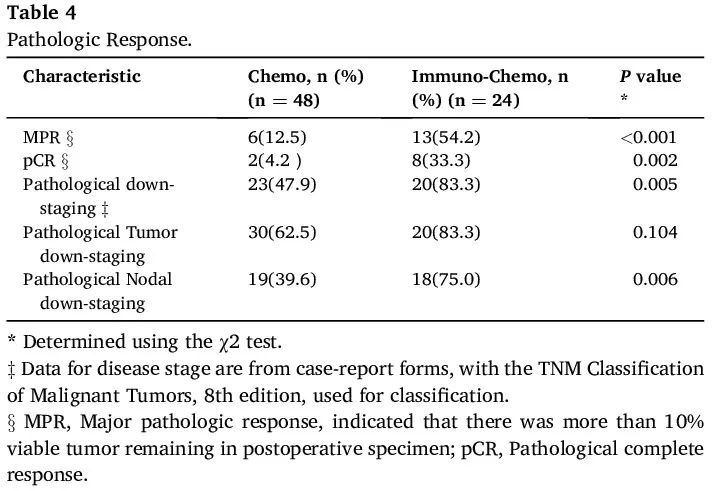
表4
EFS和OS单变量和多变量Cox回归分析
单变量和多变量分析见表 3 和表 5。单变量分析显示,女性性别(P = 0.038)和使用含 PD-1/PD-L1 抑制剂的新辅助治疗(P = 0.031)与较长的 EFS 显著相关(图 2B、图 3A)。此外,在单变量分析中,ECOG 体能状态为 0 与较长的 OS 相关(P = 0.011;图 3B)。多变量分析探索了在可切除 PLELC 患者中年龄、性别、临床分期、ECOG 体能状态、吸烟状况和 PD-1/PD-L1 抑制剂使用情况与 EFS 的关系。结果表明,PD-1/PD-L1 抑制剂联合治疗(HR = 0.32;P = 0.043)和女性性别(HR = 0.33;P = 0.036)与较长的 EFS 独立相关。
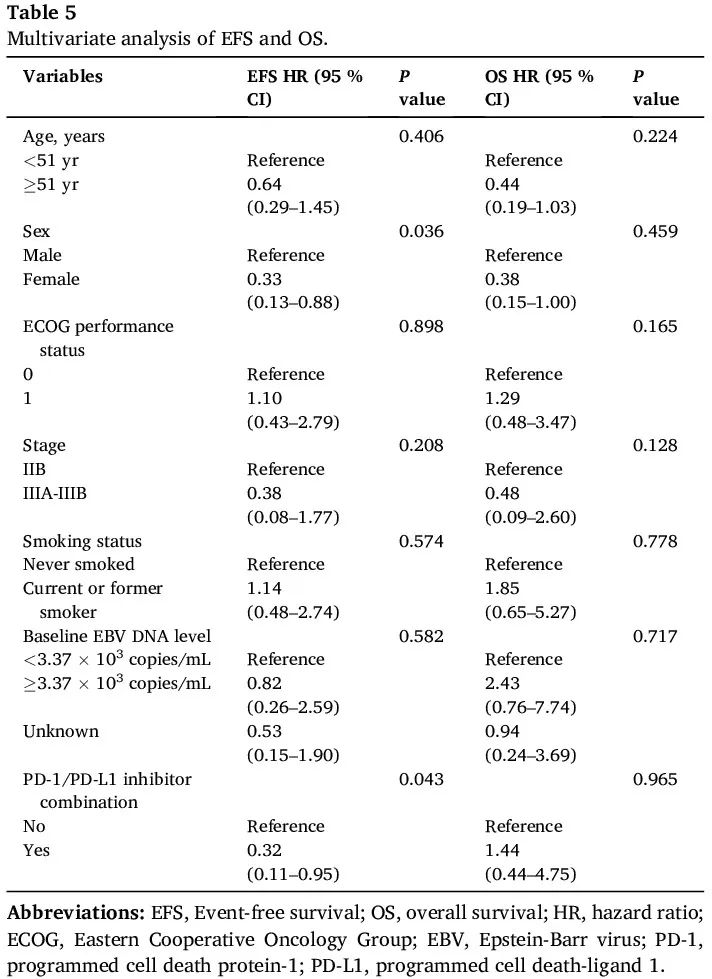
表5
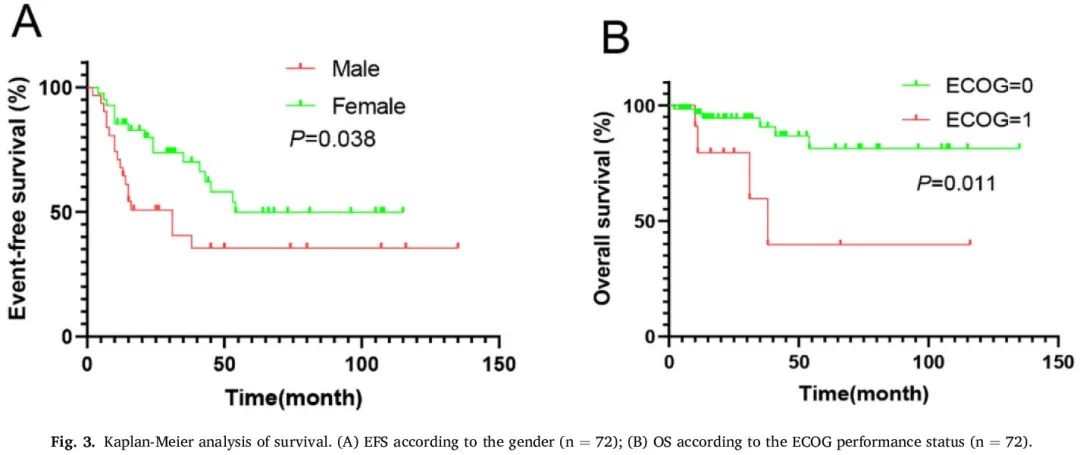
图3
不良事件
治疗相关不良事件(AE)总结于表 6。免疫+化疗组 22 例(91.7%)患者和化疗组 43 例(89.6%)患者发生任何级别的 AE。免疫+化疗组 10 例患者(41.7%)和化疗组 19 例患者(39.6%)报告了新辅助治疗期间 3 级或 4 级 AE。在两组中,最常见的 AE 为贫血(免疫+化疗组 7 例患者 [29.2 %] vs. 化疗组 16 例患者 [33.3 %])、恶心(8 例患者 [33.3 %] vs. 17 例患者 [35.4 %])和中性粒细胞减少(8 例患者 [33.3 %] vs. 15 例患者 [31.3 %])。未观察到长期毒性。
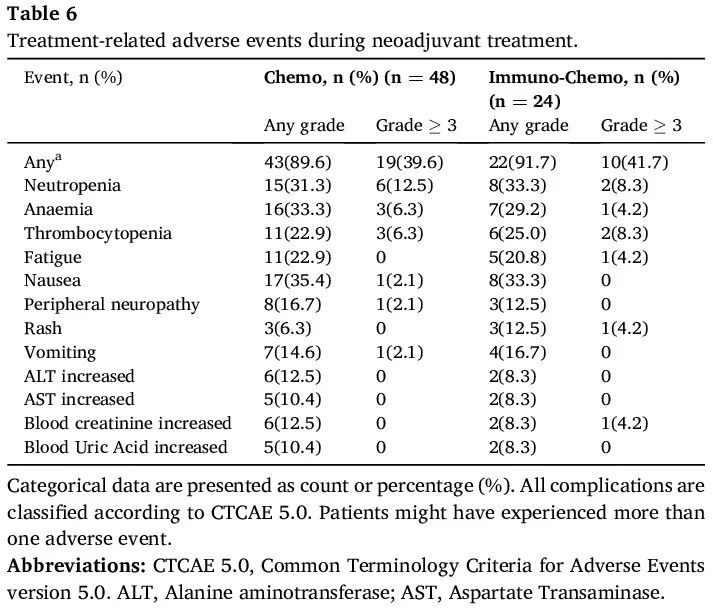
表6
讨 论
本研究比较了围手术期免疫联合化疗与仅化疗在可切除 PLELC 中的疗效和安全性,据我们所知,是迄今为止这方面最大的回顾性研究。结果表明,与仅化疗相比,围手术期 PD-1/PD-L1 抑制剂+化疗导致 EFS 显著较长,事件风险降低 58%。此外,联合疗法显著提高了主要病理缓解(MPR)和病理完全反应(pCR)率,使达到 MPR 的可能性提高 41.7%,达到 pCR 的可能性提高 29.1%。在安全性方面,与仅化疗相比,免疫联合化疗不会导致不良事件的发生率或严重程度增加,提示免疫联合化疗的耐受性良好。
作为一种与 EBV 感染高度相关的癌症类型,PLELC 在流行病学、组织病理学和遗传学特征上与肺鳞状细胞癌和其他 NSCLC 亚型不同。EBV 感染通常会诱导促炎反应,导致免疫发炎的肿瘤表型。
这种富含炎症的肿瘤微环境(TME)的典型特征是丰富的肿瘤浸润淋巴细胞(TILs)和较高的 PD-L1 表达。因此,EBV 相关癌症中的 TME 可能对免疫检查点抑制剂反应良好。很多 PLELC 表现出高水平的 TILs 和 PD-L1 过表达。研究显示,63.3-75.8% 的 PLELC 病例为 PD-L1 阳性,这一比例明显高于其他 NSCLC 亚型,与在鼻咽癌(NPC)中观察到的相似。这一证据提示,PLELC 患者可能比其他 NSCLC 亚型患者更有可能从免疫治疗中获益。
我们之前的研究发现,在晚期 PLELC 的一线治疗中,PD-1/PD-L1 抑制剂+化疗比仅化疗带来更大的临床获益。手术仍然是可切除 PLELC 的首选治疗方法,围手术期免疫治疗在改善临床结局方面的作用仍需要前瞻性研究的进一步验证。
最近,多项大型前瞻性III期临床试验证实,围手术期PD-1/PD-L1抑制剂联合铂类化疗可显著改善EFS,风险比为0.56-0.68。此外,这些试验表明,可切除 NSCLC 患者的 MPR 率从 30.4% 提高到 35.4%,pCR 率从 18.1% 提高到 25.3%。由于围绕 PLELC 分类的长期争议,这些临床研究中并未具体涉及该分类。在本研究中,对于 II-IIIB 期 PLELC 患者,PD-1/PD-L1 抑制剂+化疗组的 EFS 显著优于仅化疗组(HR 0.42 [95 % CI 0.19–0.93];P = 0.031)。此外,免疫+化疗组的 MPR(54.2 % vs 12.5 %,P < 0.05)和 pCR(33.3 % vs 4.2 %,P < 0.05)率显著更高。在数值上,围手术期免疫联合化疗对 PLELC 的益处似乎超过了在 NSCLC 中观察到的益处。这一发现进一步支持 PLELC 对免疫治疗特别敏感的观点。因此,对 PLELC 使用围手术期免疫治疗需要更积极地考虑,并需要前瞻性临床试验来验证这些益处。
在晚期 PLELC 中,PD-1/PD-L1 抑制剂联合铂类化疗显示出显著疗效,ORR 和 DCR 通常超过仅化疗所达到的水平。最近的研究报告,免疫联合化疗的 ORR 在 50-75% 之间,中位 PFS 为 13 至 17 个月,而仅化疗为 7 至 10 个月。这些发现强调了免疫联合化疗治疗晚期 PLELC 患者的疗效。
我们在围手术期环境中的研究结果揭示了类似的趋势。与仅化疗相比,免疫联合化疗在可切除 PLELC 中产生更高的 MPR 和 pCR 率,并且显著延长了 EFS。这提示免疫联合化疗可能为可切除 PLELC 患者带来显著获益,这与在晚期疾病环境中观察到的结果一致。然而,值得注意的是,本研究关注可切除 PLELC,免疫治疗用于围手术期环境的长期生存获益需要进一步验证。
总体而言,晚期和围手术期的结果都支持 PD-1/PD-L1 抑制剂在 PLELC 治疗中的价值。未来需要开展针对可切除 PLELC 的前瞻性研究,以证实长期生存获益,进一步描述免疫治疗在这种独特的 NSCLC 亚型中的作用。
值得注意的是,在最近一项评估新辅助免疫治疗对 PLELC 患者疗效的回顾性研究中,作者发现 PLELC、肺鳞状细胞癌和腺癌从新辅助免疫治疗中的获益相似,新辅助化疗与 PD-1/PD-L1 抑制剂联合或不联合化疗在 PLELC 中的短期疗效无显著差异。然而,在这项研究中,纳入的 PLELC 患者的样本量相对较小,新辅助治疗方案存在显著异质性,并且随访期短。这些因素可能导致该研究无法直接证明新辅助免疫治疗相比新辅助化疗的优势。相比之下,在我们的研究中,免疫+化疗组和化疗组的样本量都相对较大,大多数患者接受了 GP/TP 化疗方案,治疗异质性较低。重要的是,我们排除了仅接受免疫治疗的患者,这大大减少了我们研究结果的潜在偏倚。尽管如此,这两项研究都为新辅助免疫联合化疗用于可切除 PLELC 患者提供了临床相关和互补的见解。需要进一步的研究和临床试验来验证这些发现,将围手术期免疫联合化疗确立为可切除 PLELC 的标准治疗方法。
本研究的另一个相关发现是,对于可切除 PLELC,在辅助阶段添加 PD-1/PD-L1 抑制剂与 EFS 显著改善无关(HR 0.67;P = 0.691)。这引出了一个有趣的问题,即术后免疫治疗可能为已经接受新辅助免疫治疗的 PLELC 患者带来的额外益处和潜在毒性的程度。我们应该如何平衡这些潜在益处和风险?我们之前关于 NSCLC 的荟萃分析表明,在新辅助化疗+免疫治疗中加入辅助 PD-1/PD-L1 抑制剂并没有改善 EFS(HR 0.90;P = 0.59)。因此,PLELC 可能也是类似的结果。总体而言,额外辅助免疫治疗的潜在益处和风险需要进一步探索。在出现此类证据之前,考虑其应用前必须与患者进行深入讨论。
除了前面提到的临床获益外,本研究还表明了 PD-1/PD-L1 抑制剂联合化疗时在影像学原发肿瘤降期、病理降期和病理淋巴结降期方面的良好结果。这些发现表明,新辅助免疫联合化疗可能对肿瘤缩小、肿瘤和淋巴结降期产生显著影响,并可能阻止癌症扩散到远处。这些发现提供了额外的证据,支持新辅助免疫联合化疗在改善 PLELC 治疗结局方面的疗效。
与仅化疗相比,PD-1 通路抑制剂联合化疗不会导致 AE 发生率更高或更严重。本文提到的 AE 与其他临床试验中报道的免疫联合化疗的安全性一致。在两组中,大多数 AE 是血液学和胃肠道 AE,这主要归因于化疗方案。在本研究中,免疫相关 AE 的发生率较低,这可能是由于大多数患者的免疫治疗持续时间有限。
我们之前的研究表明,血浆 EBV DNA 是 PLELC 患者的可靠预后指标。由于本研究的回顾性性质,很大一部分患者缺少基线 EBV DNA 数据。鉴于其预测效用,我们主张将基线 EBV DNA 拷贝数评估纳入所有 PLELC 患者的标准临床方案中。
本研究的主要局限性包括来自单个癌症中心的样本量相对较小及其回顾性设计。然而,本研究仍然是迄今为止关于 PLELC 新辅助免疫治疗疗效的最大规模研究。
因此,我们认为本研究具有高度创新性,提供了全面的临床见解和重要的临床相关性。
本研究表明,PD-1/PD-L1 抑制剂联合化疗作为 PLELC 的围手术期治疗,在 pCR、MPR 和 EFS 方面带来的获益优于仅化疗,安全性良好。
参考文献:
Lei M, Zhang X, Hu LN, Fu S, Xiao M, Long Z, Zhu H, Zhou Y, Hong S. Perioperative immunotherapy plus chemotherapy versus chemotherapy alone for patients with resectable pulmonary lymphoepithelioma-like carcinoma. Lung Cancer. 2024 Dec 18;199:108057. doi: 10.1016/j.lungcan.2024.108057. Epub ahead of print. PMID: 39709653.



