论文解读| Chengle Zhuang教授团队揭示SPNS1缺失加剧小鼠骨骼肌萎缩的分子机制
时间:2024-12-18 16:01:59 热度:37.1℃ 作者:网络
随着年龄增长,肌肉质量和功能会逐渐下降,这一现象被称为肌肉减少症。尽管对肌肉减少症的研究取得了一些进展,但其发病机制尚未完全阐明。溶酶体在消化和回收大分子中扮演着重要角色,随着年龄增长,溶酶体酸化和自噬功能会下降,这可能会损害受损线粒体的清除。SPNS1(spinster homolog 1)是维持正常溶酶体功能的关键蛋白,但其在肌肉减少症中的具体作用尚不明确。
同济大学的Chengle Zhuang教授团队在本刊发表了题为“SPNS1 ablation drives skeletal muscle atrophy by disrupting mitophagy, mitochondrial function, and apoptosis in mice”的研究快讯,揭示了SPNS1缺失如何通过影响线粒体自噬、线粒体功能和细胞凋亡来加剧小鼠肌肉减少症。
1、研究方法
研究团队首先评估了年轻和中年野生型C57BL/6J小鼠腓肠肌中SPNS1的表达水平,发现老年小鼠的SPNS1蛋白质表达呈下降趋势。由于与年龄相关的肌肉质量减少和线粒体自噬降低主要发生在II型肌纤维,研究团队构建了II型肌纤维SPNS1基因条件性敲除小鼠模型,以探索溶酶体和线粒体功能失调与肌肉减少症发生发展之间的关联。
2、研究结果
SPNS1基因条件性敲除(SPNS1-/-)小鼠相较于对照组(SPNS1f/f)小鼠,体型更小,体重和日常食物摄入量降低,且出现更广泛的白发和更严重的驼背(图1A)。SPNS1-/-小鼠的臀大肌、股四头肌、腓肠肌、胫前肌和趾长伸肌的肌肉质量减小,而主要由慢肌纤维组成的比目鱼肌质量没有显著差异(图1B)。
SPNS1缺失后,LC3B-II、SQSTM1/p62的水平升高,而TFEB的水平降低,表明自噬启动正常但溶酶体降解和生物合成功能受损。此外,PINK1和Parkin的蛋白水平显著升高,表明线粒体自噬功能障碍和受损线粒体的积累(图1E)。
SPNS1-/-小鼠的趾长伸肌中ATP产生显著减少(图1G),TFAM、呼吸链复合体I和复合体II的蛋白含量显著下调(图1H),表明SPNS1的缺失影响了线粒体的生物合成和功能。SPNS1-/-小鼠的趾长伸肌中TUNEL阳性的凋亡肌纤维比例增加(图1I),表明SPNS1缺失导致肌纤维凋亡水平上升,这可能是SPNS1缺失引起肌肉萎缩和功能障碍的原因之一。
在SPNS1被敲低的C2C12肌管细胞中,MuRF1和裂解的caspase-3的蛋白水平显著增加(图1J),基础呼吸率和最大呼吸率显著降低(图1K)。凋亡抑制剂Ac-DEVD-CHO在一定程度上逆转了SPNS1缺失引起的效应。
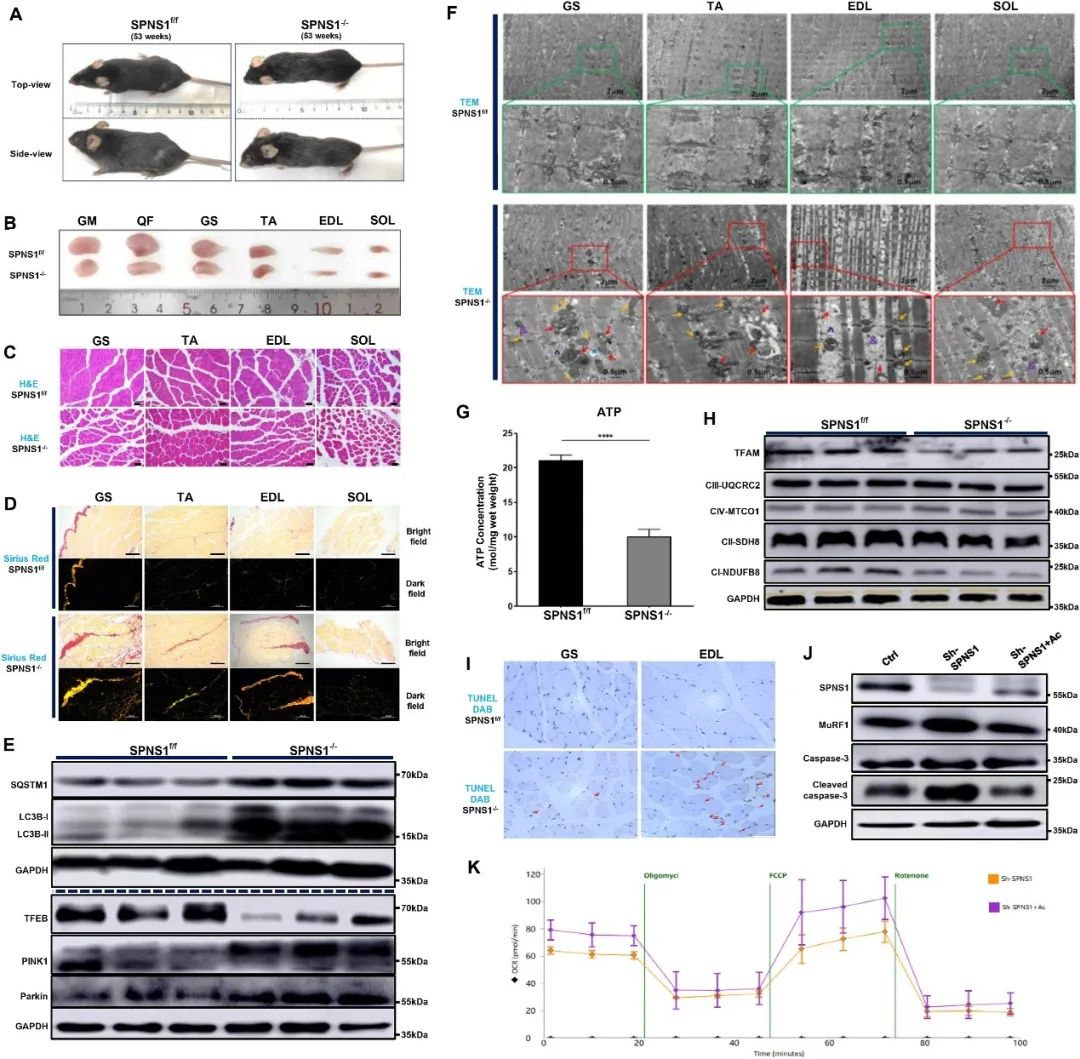
图1 SPNS1的缺失通过破坏小鼠的线粒体自噬、线粒体功能和细胞凋亡来促进骨骼肌萎缩
3、研究结论
II型肌纤维中SPNS1的条件性敲除SPNS1的缺失通过影响线粒体自噬、线粒体功能和细胞凋亡,加剧了小鼠骨骼肌的萎缩。这些发现不仅为理解骨骼肌萎缩的分子机制提供了新的见解,也为开发治疗骨骼肌萎缩的新策略提供了潜在的靶点。
文章来源
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304223003665
引用这篇文章:
Zhang X, Zhang F, Wu H, Yu Z, Zhuang C. SPNS1 ablation drives skeletal muscle atrophy by disrupting mitophagy, mitochondrial function, and apoptosis in mice. Genes Dis. 2024;11(5):101083.


