Nature:免疫疗法的前沿突破:炎性单核细胞与T细胞的相互作用在肿瘤治疗中的潜力
时间:2024-11-29 10:00:23 热度:37.1℃ 作者:网络
引言
随着医学和生物学技术的进步,癌症治疗领域取得了诸多突破,尤其是免疫治疗的崛起,让癌症的治疗前景发生了显著变化。然而,尽管免疫治疗取得了令人鼓舞的成果,癌细胞依然能够通过复杂的机制逃避机体免疫系统的攻击,这使得癌症治疗依旧面临巨大挑战。
其中,肿瘤微环境(TME)中的免疫逃逸机制尤为关键。近年来,越来越多的研究揭示了肿瘤如何利用微环境中的各种细胞和分子来干扰免疫系统的正常功能,最具代表性的机制之一就是“免疫抑制”。研究发现,癌细胞不仅能够通过改变免疫细胞的功能来逃避免疫系统的监视,还能利用免疫抑制细胞的特性来促进自身的生长和扩散。
在众多免疫抑制机制中,炎性单核细胞(inflammatory monocytes)在癌细胞免疫逃逸中的作用逐渐引起了广泛关注。炎性单核细胞不仅在肿瘤免疫反应中扮演着重要角色,还通过与T细胞的相互作用影响肿瘤的免疫微环境。11月27日Nature报道的这项研究“Cancer cells impair monocyte-mediated T cell stimulation to evade immunity”,发现炎性单核细胞通过“交叉穿戴”(cross-dressing)机制,获取肿瘤细胞的抗原并激活T细胞,从而推动抗肿瘤免疫反应的发生。然而,肿瘤微环境中的信号通路,如MAPK和PGE2的变化,会抑制这一过程,进而削弱T细胞的活性和免疫攻击能力。
这些发现不仅为我们理解癌症的免疫逃逸提供了新的视角,也为开发更有效的免疫治疗策略指明了方向。通过调节这些免疫细胞的功能,或许能够突破肿瘤的免疫屏障,开创癌症治疗的新纪元。

肿瘤微环境:T细胞激活与再激活的战场
肿瘤微环境(tumor microenvironment, TME)由肿瘤细胞和各种免疫细胞共同构成,是一个动态且复杂的微生态系统。在这里,CD8+ T细胞通过初始激活和局部再激活,获得对抗肿瘤的持续能力。然而,这种再激活过程需要特定的免疫细胞参与和支持,才能有效遏制肿瘤的生长。
传统上,人们认为T细胞的再激活主要依赖1型常规树突状细胞(type 1 conventional dendritic cells, cDC1)的交叉呈递(cross-presentation)功能。然而,最新研究表明,炎性单核细胞也在T细胞的再激活中发挥着至关重要的作用。针对YUMM1.7小鼠黑色素瘤模型的实验表明,在未经靶向治疗的肿瘤中,炎性单核细胞在肿瘤微环境中的比例高达40%,而在耐药性肿瘤中则显著下降到10%左右。这种差异性表明,炎性单核细胞在维持肿瘤局部免疫反应中具有不可或缺的作用。
在肿瘤微环境中,免疫细胞间的协作决定了抗肿瘤免疫反应的强度和持续性。CD8+ T细胞需要与炎性单核细胞的直接相互作用,才能有效地重新获得杀伤肿瘤细胞的能力。研究发现,这种直接接触不仅是细胞之间的物理接触,更是一系列复杂信号传导的结果,涉及抗原呈递、共刺激信号以及局部免疫因子的调控。因此,炎性单核细胞的存在与功能状态对维持肿瘤内的免疫平衡具有关键作用。
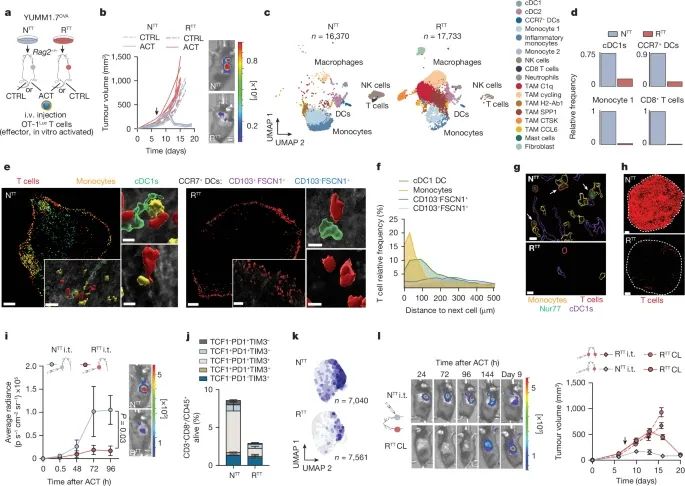
肿瘤浸润性T细胞在不同免疫微环境(TME)中的再激活情况,重点研究了YUMM1.7OVA黑色素瘤模型中非耐药性(NTT)和耐药性(RTT)肿瘤中T细胞的免疫反应(Credit: Nature)
图a:小鼠模型的示意图通过皮下注射YUMM1.7OVA NTT或RTT细胞,建立耐药和非耐药肿瘤模型,同时通过静脉注射OT-1Luc T细胞,进行自体细胞治疗(ACT)。该模型用于观察T细胞在不同肿瘤免疫微环境中的反应。
图b:ACT反应的对比该图展示了NTT和RTT肿瘤的ACT反应。通过生物发光成像(BLI)监测96小时后的T细胞活动,NTT肿瘤中的T细胞反应显著高于RTT肿瘤,表明耐药肿瘤对T细胞的再激活能力较差。
图c:单细胞RNA测序(scRNA-seq)分析利用单细胞RNA测序分析了NTT和RTT肿瘤中CD45+免疫细胞的群体分布,展示了肿瘤微环境中T细胞和其他免疫细胞的变化。NTT和RTT肿瘤的细胞群体分布在UMAP图中有所不同,表明不同TME对免疫细胞的响应有显著差异。
图d:相对细胞频率的变化基于单细胞RNA测序的分析,展示了NTT和RTT肿瘤中免疫细胞的相对频率。该数据进一步证明了耐药肿瘤中免疫细胞数量的变化。
图e:免疫荧光(IF)图像展示了NTT和RTT肿瘤48小时后通过免疫荧光染色检测到的免疫细胞的定位和分布。该图为进一步分析肿瘤中免疫反应提供了形态学证据。
图f:T细胞的相对频率与免疫细胞的距离通过免疫荧光图像分析T细胞的相对频率,并测量它们与其他免疫细胞的距离,表明NTT肿瘤中的T细胞更容易与其他免疫细胞接触和交互。
图g:Nur77-GFP OT-1 T细胞在肿瘤中的表现Nur77-GFP标记的OT-1 T细胞在NTT和RTT肿瘤中的定位情况。该图标示了在肿瘤中活化的T细胞(Nur77+)的位置,进一步揭示了不同TME对T细胞活化的影响。
图h:T细胞与肿瘤边界的关系展示了在NTT和RTT肿瘤中T细胞的定位,尤其是在肿瘤边界的分布情况。这有助于了解T细胞如何渗透到肿瘤内以及它们与肿瘤结构的关系。
图i:BLI监测T细胞的动态变化通过生物发光成像(BLI)动态监测T细胞在肿瘤中的变化,展示了不同时间点内T细胞的增殖情况和肿瘤反应的差异。
图j:流式细胞术分析T细胞状态通过流式细胞术对T细胞状态进行分析,展示了ACT后120小时内T细胞在NTT和RTT肿瘤中的变化,揭示了耐药性肿瘤对T细胞的抑制作用。
图k:效应记忆T细胞标志物的表达在单细胞RNA测序中,显示了NTT和RTT肿瘤中T细胞的效应记忆特征。这些数据表明,NTT肿瘤中T细胞具有更强的效应记忆特征,而RTT肿瘤则表现出效应记忆标志物的下调。
图l:NTT和RTT肿瘤之间T细胞的差异该图展示了通过BLI成像观察NTT和对侧耐药性肿瘤的T细胞反应。T细胞在NTT肿瘤中的增殖显著优于耐药性肿瘤,并且耐药性肿瘤的生长曲线表现出较大的抑制。
炎性单核细胞的独特作用
炎性单核细胞通过“交叉穿戴”(cross-dressing)机制,从肿瘤细胞上获取并展示肽-MHC-I复合物,以此来激活CD8+ T细胞。在NTT(未经治疗)肿瘤中,实验发现肿瘤特异性CD8+ T细胞与炎性单核细胞之间形成了多细胞聚集体。这种接触导致80%以上的T细胞上调Nur77,这是T细胞受体(TCR)活化的标志。然而,在耐药性肿瘤中,这一比例大幅下降至20%。这些数据清晰地表明,炎性单核细胞在维持T细胞活化状态中扮演了重要角色。
深入研究发现,肿瘤细胞内MAPK信号通路的过度激活是这一机制受抑的主要原因。具体来说,MAPK信号的异常激活会抑制Ⅰ型干扰素(type I interferon, IFN-I)的产生(降低70%),并增加前列腺素E2(prostaglandin E2, PGE2)的分泌(增加约2.5倍)。PGE2不仅直接抑制了炎性单核细胞的功能,还阻断了它们与T细胞之间的有效相互作用,从而显著削弱了T细胞的再激活能力。
为了更好地理解炎性单核细胞在肿瘤免疫中的作用,研究者们还分析了这些细胞在不同肿瘤发展阶段的动态行为。在肿瘤的早期阶段,炎性单核细胞通过释放趋化因子来招募其他免疫细胞,而在肿瘤的晚期,它们的功能逐渐转向直接递呈抗原并激活局部的T细胞。这种功能的动态变化使炎性单核细胞能够根据肿瘤微环境的需求做出相应调整,极大地影响了整体的免疫应答效果。
恢复炎性单核细胞功能:癌症免疫治疗的新希望
针对如何恢复炎性单核细胞介导的T细胞激活过程,研究人员们展开了大量的实验研究。他们发现,通过提高IFN-I水平并阻断PGE2的产生,可以显著恢复炎性单核细胞的功能,增强肿瘤对T细胞介导的免疫攻击。在缺乏PGE2的RTT(耐药)肿瘤中,T细胞数量显著增加,增幅达到3倍,表现出更强的增殖与效应功能。此外,过表达IRF3/7基因以恢复IFN-I的产生,使得T细胞的浸润增加了约2.8倍,肿瘤体积缩小超过50%。
这种发现为癌症免疫治疗提供了新的希望和方向。通过联合应用COX抑制剂(如环氧合酶2抑制剂)和IFN-I激动剂,可以显著改善肿瘤微环境,增强T细胞的效应功能。在小鼠实验模型中,这种联合疗法使得肿瘤内CD8+ T细胞数量增加了4倍,显著抑制了肿瘤的生长。
此外,研究人员还探索了基因编辑手段对炎性单核细胞功能的增强效果。例如,通过CRISPR/Cas9技术敲除PGE2合成相关基因,成功减少了PGE2的生成,恢复了炎性单核细胞的活性。在这种干预下,小鼠肿瘤生长明显受抑,显示出该策略的巨大潜力。这一发现也为基因编辑在癌症免疫治疗中的应用奠定了基础,展示了通过调节肿瘤微环境提高免疫反应的新途径。
癌细胞通过抑制单核细胞介导的T细胞再激活来逃避免疫监视,这一发现揭示了肿瘤微环境中复杂且动态的免疫逃逸机制。通过调节IFN-I和PGE2这两个重要的信号因子,可以开发出更加有效的组合免疫疗法,使癌症治疗不仅局限于传统的放化疗和手术干预,而是通过增强机体的免疫反应实现更持久的抗肿瘤效果。
这项研究为理解癌症的免疫逃逸机制提供了新的见解,也为未来癌症免疫治疗的创新指明了方向。未来的研究可以更加集中于如何优化炎性单核细胞的功能,如何通过调节肿瘤细胞释放的信号来进一步提高T细胞的激活效率。这些发现为个性化治疗提供了新的视角,使得针对患者具体情况的治疗成为可能。
癌症免疫治疗仍然面临挑战,但通过深入研究肿瘤与免疫系统的复杂相互作用,并充分利用炎性单核细胞和T细胞的独特功能,研究人员们有望开发出更加有效且持久的抗肿瘤免疫反应,为患者带来更多的希望和机会。
参考文献
Elewaut, A., Estivill, G., Bayerl, F. et al. Cancer cells impair monocyte-mediated T cell stimulation to evade immunity. Nature (2024). https://doi.org/10.1038/s41586-024-08257-4


