天津大学刘文广AFM:α-硫辛酸基纳米酶用于治疗急性癫痫
时间:2024-12-15 06:01:22 热度:37.1℃ 作者:网络
抗癫痫药物(AEDs)是临床上治疗癫痫的常见治疗方法,但它们面临穿透血脑屏障(BBB)的能力低下、副作用风险以及无法调节病理微环境的问题。这些问题阻碍了对癫痫的完全控制,并导致炎症-癫痫发生恶性循环。在此,天津大学刘文广团队开发了一种基于α-硫辛酸(LA)的纳米酶,该纳米酶装载了苯妥英(PHT)并复合钙离子(LA@PHT-Ca2+)。这种纳米酶结合了跨越BBB传递AEDs和调节不良微环境以治疗癫痫的功能。两亲性的LA在水中自组装成稳定的纳米粒子,通过依赖钠的多维生素转运体传递LA,赋予了其跨越BBB的能力。LA的酶样和氧化还原功能为LA@PHT-Ca2+提供了通过级联反应对多种自由基的卓越清除效果,从而保护神经元免受氧化应激的损害。此外,Ca2+扰乱了神经元呼吸,导致生物能量腺苷三磷酸的产生减少,改善了缺氧微环境。这导致药物外排门控蛋白P-糖蛋白的表达降低。这种新型的基于硫辛酸的纳米酶,具有内在的BBB穿越能力、延长的细胞内药物保留时间以及阻断炎症-癫痫发生循环的能力,在癫痫大鼠中展现了满意的治疗效果,导致症状减轻和微环境改善。该研究以题为“α-Lipoic Acid-Based Nanozyme for Treating Acute Epilepsy”的论文发表在《Advanced Functional Materials》上。

图1展示了α-硫辛酸基纳米酶LA@PHT-Ca2+的制备过程及其在癫痫治疗中的应用机制。该图说明了如何通过自组装和紫外光引发的聚合反应制备出稳定的纳米颗粒,这些颗粒能够装载苯妥英(PHT)并与钙离子(Ca2+)形成复合物。这些纳米颗粒利用α-硫辛酸的两亲性质在水中自组装,并借助钠依赖性多维生素转运体(SMVT)穿越血脑屏障(BBB)。此外,还展示了LA@PHT-Ca2+纳米酶如何通过模拟抗氧化酶的活性,清除过量的自由基,减轻氧化应激,并通过阻断炎症-癫痫发生恶性循环来治疗癫痫。因此,LA@PHT-Ca2+纳米酶作为一种新型的治疗策略,能够有效地提高癫痫治疗效果,减轻症状,并改善病理微环境。
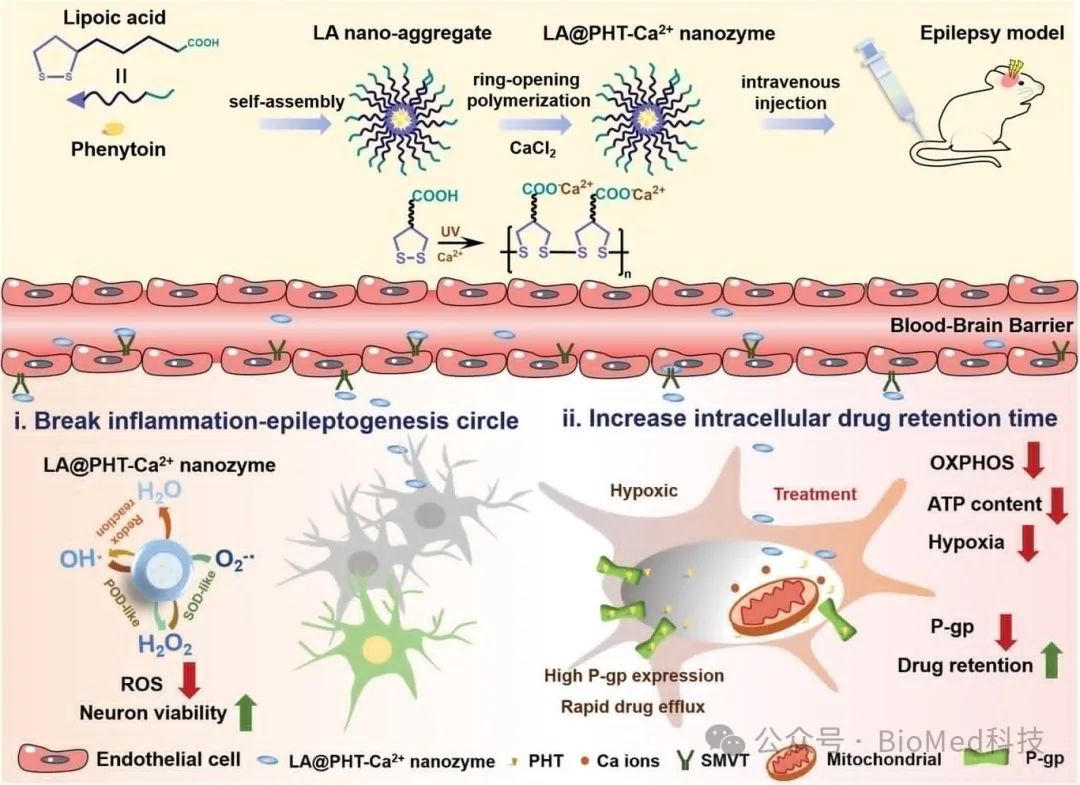
图1. α-硫辛酸基纳米酶的制备及其在癫痫治疗中的应用示意图
【α-硫辛酸基纳米酶的特性与类酶活性】
图2展示了LA@PHT-Ca2+纳米酶的特性和类酶活性。实验结果表明,LA@PHT-Ca2+纳米酶具有浓度依赖性的自由基清除活性,能够有效地将有害的O2-·转化为H2O2,并最终通过类酶和氧化还原反应将O2-·高效转化为无害的H2O。这些结果证实了LA@PHT-Ca2+纳米酶具有优异的抗氧化性能,能够作为纳米酶清除多种自由基,保护神经元免受氧化应激的损害。
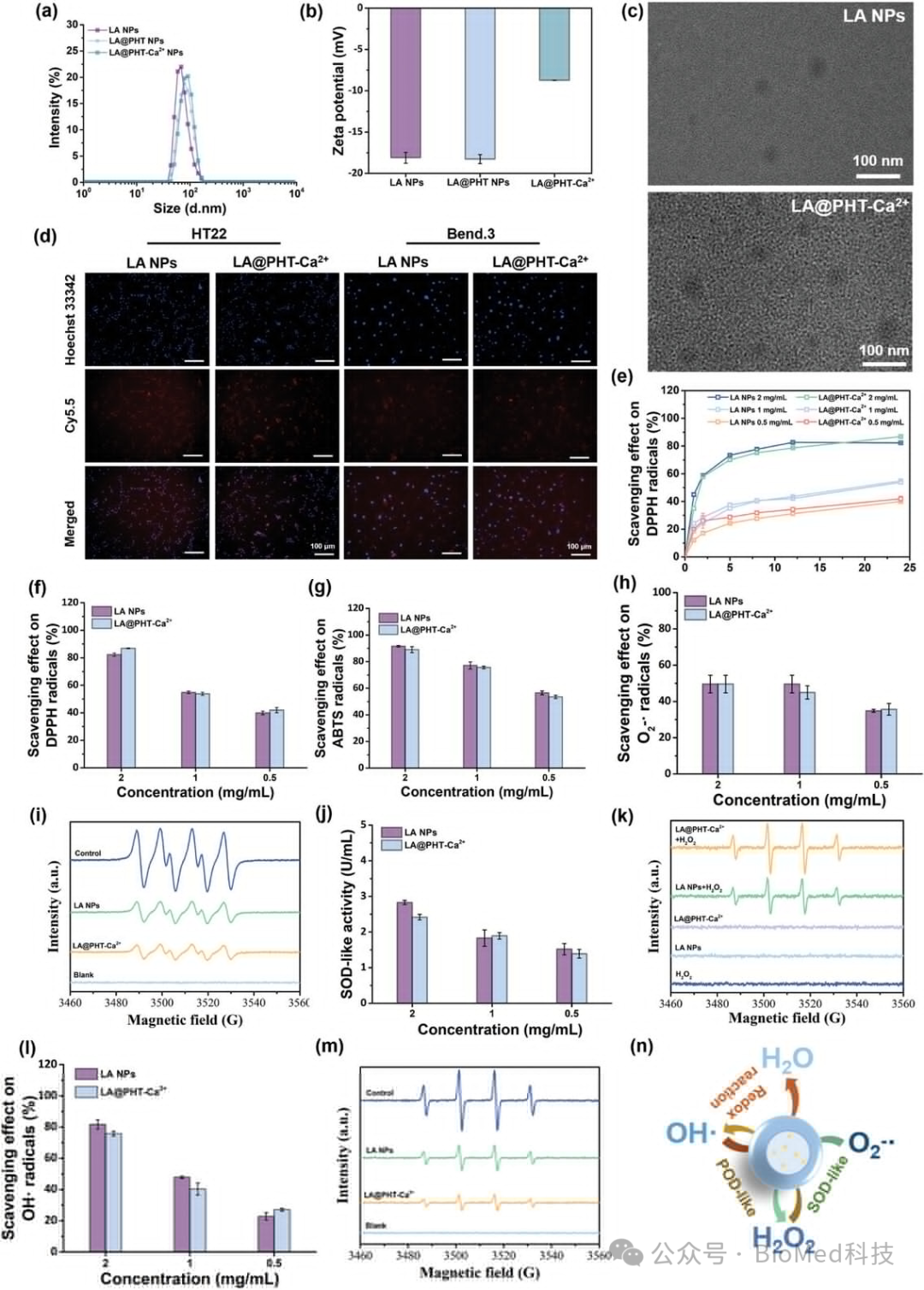
图2. α-硫辛酸基纳米酶的特性与类酶活性
【α-硫辛酸基纳米酶对神经元保护作用及钙离子影响的研究】
图3探讨了LA@PHT-Ca2+纳米酶对神经元的保护作用以及钙离子对缺氧处理的HT22细胞的影响。实验结果表明,在氧化应激条件下,LA@PHT-Ca2+纳米酶能够显著提高HT22细胞的存活率,增强超氧化物歧化酶(SOD)活性,降低丙二醛(MDA)水平,并有效清除细胞内的活性氧(ROS)。此外,钙离子的引入能够干扰神经元的氧化磷酸化(OXPHOS)过程,减少ATP的产生,改善缺氧微环境,降低P-糖蛋白(P-gp)的表达,延长药物在神经元内的保留时间。这些发现证实了LA@PHT-Ca2+纳米酶在减轻氧化应激引起的神经元损伤、提高细胞内药物保留时间以及改善缺氧微环境方面的潜力,为癫痫治疗提供了新的策略。
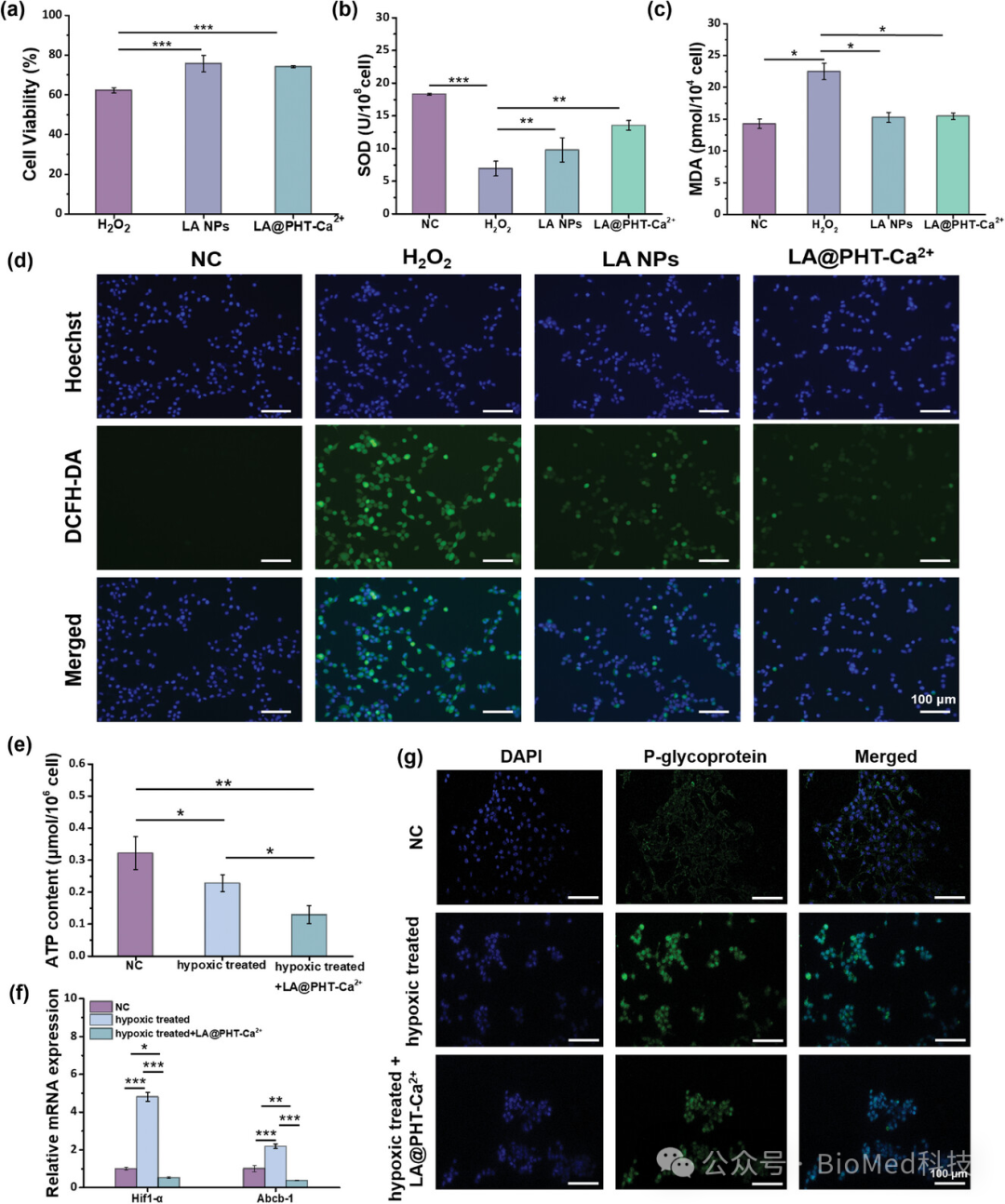
图3. α-硫辛酸基纳米酶对神经元保护作用及钙离子影响的研究
【α-硫辛酸基纳米酶的体外血脑屏障穿透能力】
图4展示了LA@PHT-Ca2+纳米酶的体外血脑屏障穿透能力。通过体外模型实验,验证了该纳米酶能够成功被Bend.3细胞内吞,并在一定时间后从细胞上层穿越到下层,这表明LA@PHT-Ca2+纳米酶具有良好的跨血脑屏障能力。此外,通过在下层HT22细胞中预处理H2O2以建立缺氧模型,并添加LA@PHT-Ca2+纳米酶,实验观察到纳米酶能够从上层传递到下层并改善细胞的氧化应激微环境,进一步证实了其穿透血脑屏障的能力。体内实验中,通过尾静脉注射Cy5.5标记的纳米酶,发现其在脑组织中的积累量随时间增加,尤其在癫痫模型组中,纳米酶的荧光强度显著增强,显示了其在癫痫病理微环境下的穿透血脑屏障能力。结论是LA@PHT-PHT-Ca2+纳米酶能够有效穿透血脑屏障,为癫痫治疗提供了一种潜在的药物载体。
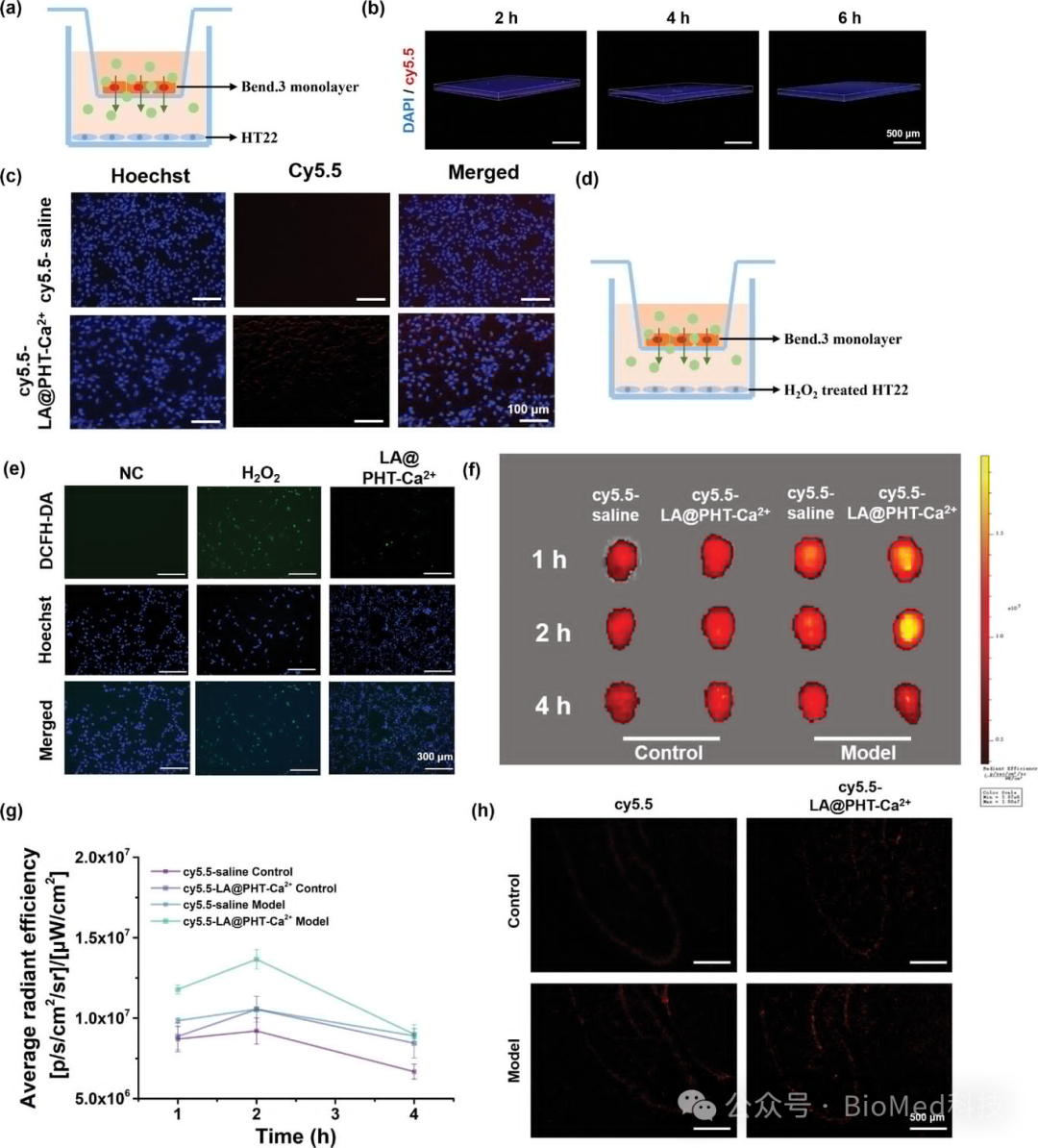
图4. α-硫辛酸基纳米酶的体外血脑屏障穿透能力
【α-硫辛酸基纳米酶对癫痫模型大鼠治疗效果的体内评估】
图5展示了LA@PHT-Ca2+纳米酶在体内对癫痫大鼠模型治疗效果的评估。实验中,通过锂-皮洛卡品诱导的癫痫发作模型来评估不同治疗组(包括对照组、模型组、PHT组、LA NPs组、LA@PHT组和LA@PHT-Ca2+组)的大鼠行为变化、发作频率、发作持续时间和发作严重程度。结果显示,与模型组相比,LA@PHT-Ca2+治疗组的大鼠发作延迟、发作次数减少、发作持续时间缩短,并且在Racine量表评分中得分降低,表明LA@PHT-Ca2+纳米酶能有效减轻癫痫症状。此外,实时脑电图(EEG)记录显示,LA@PHT-Ca2+治疗组的大鼠脑电活动降低,表明神经元兴奋性减少。开放场测试进一步证实了LA@PHT-Ca2+治疗组大鼠的运动能力得到改善,它们更倾向于进入中心区域并增加总移动距离。这些结果综合表明,LA@PHT-Ca2+纳米酶在减轻癫痫症状和改善病理微环境方面具有显著的治疗效果。
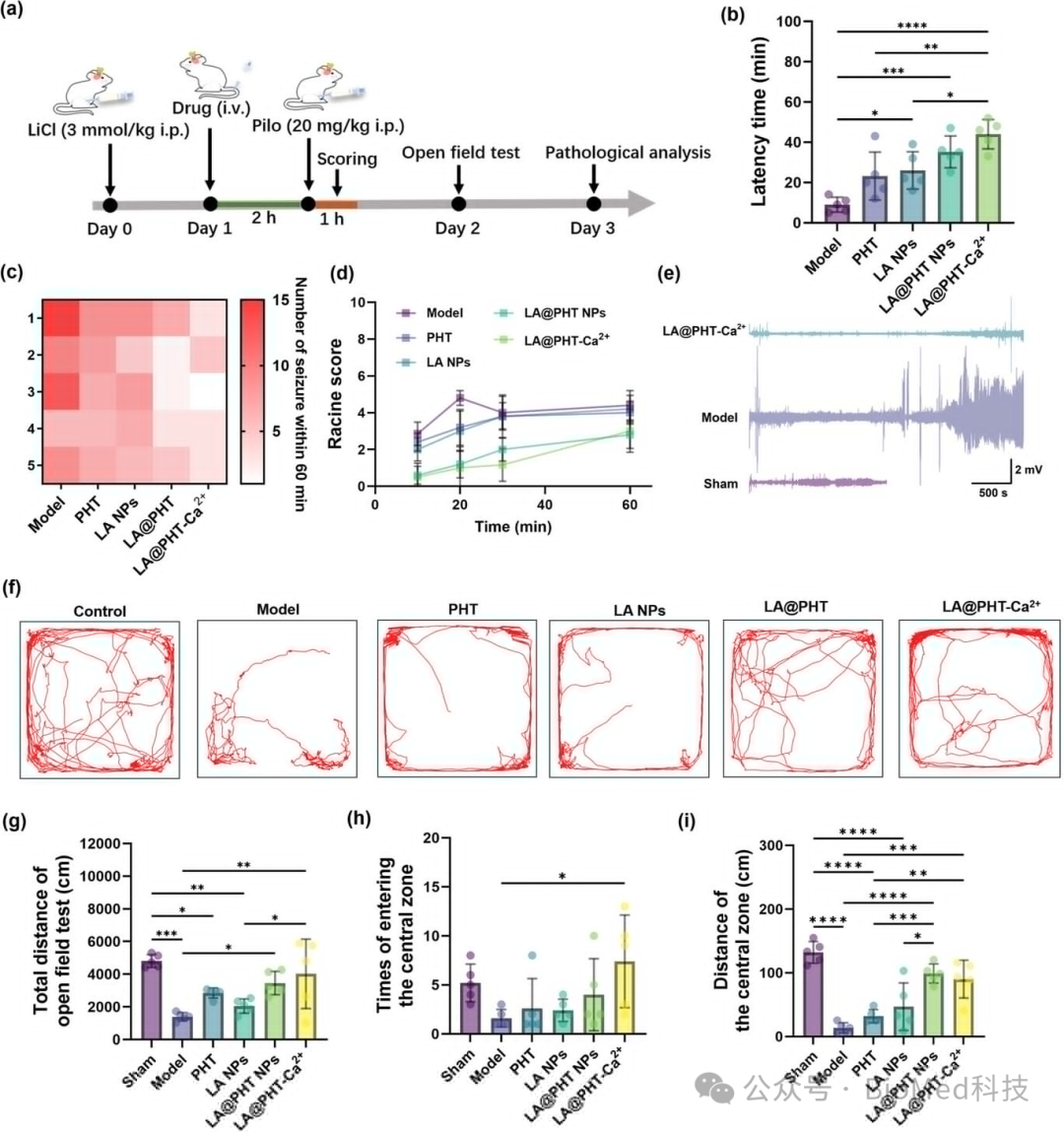
图5. α-硫辛酸基纳米酶对癫痫模型大鼠治疗效果的体内评估
【癫痫后大鼠脑组织的病理学分析】
图6展示了LA@PHT-Ca2+纳米酶对癫痫后大鼠脑组织的病理影响评估,包括Nissl染色、c-Fos免疫荧光染色以及GFAP、Iba-1、Hif1-α和TUNEL的免疫荧光染色。Nissl染色显示,与模型组相比,LA@PHT-Ca2+治疗组的神经元数量增加,恢复到接近正常水平,表明该纳米酶具有神经保护作用。c-Fos免疫荧光染色显示,LA@PHT-Ca2+治疗后,激活的神经元表达水平恢复正常,表明神经元从激活状态成功转换为静息状态。GFAP和Iba-1的免疫荧光染色显示,LA@PHT-Ca2+治疗组中,与炎症相关的星形胶质细胞和微胶质细胞的表达降低,说明炎症反应得到有效缓解。Hif1-α的表达降低表明LA@PHT-Ca2+纳米酶能够减轻缺氧微环境。TUNEL免疫荧光染色强度的降低进一步证实了LA@PHT-Ca2+纳米酶抑制神经元凋亡的能力。综合这些结果,LA@PHT-Ca2+纳米酶在体内对癫痫大鼠模型具有显著的神经保护和抗炎作用,能够改善病理微环境,减轻癫痫引起的神经元损伤和炎症反应。
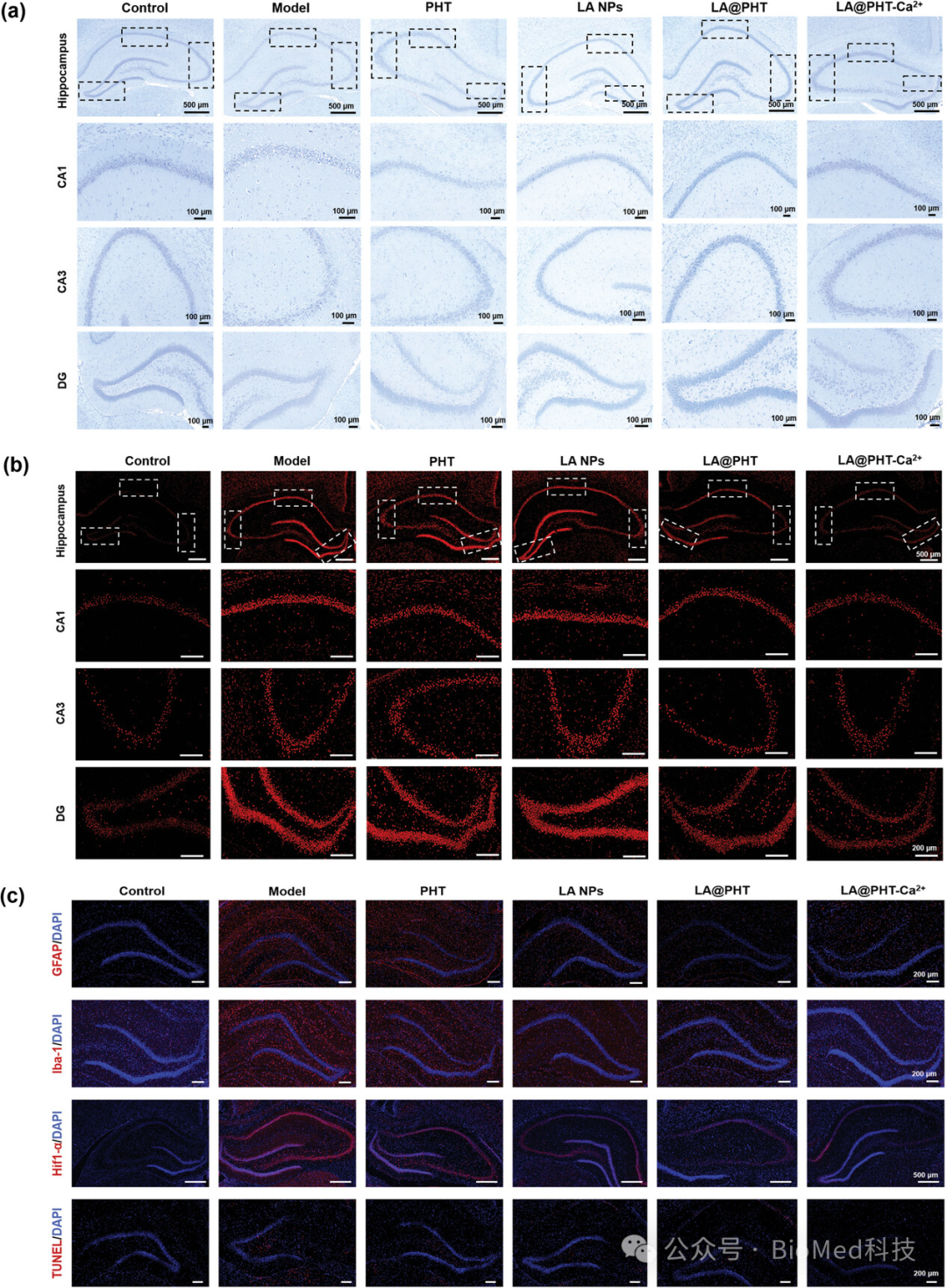
图6. 癫痫后大鼠脑组织的病理学分析
【小结】
该论文设计并制备了一种α-硫辛酸基纳米酶LA@PHT-Ca2+,用于在癫痫期间实现神经元保护和病理微环境调节。系统的体外实验表明,α-硫辛酸能够自组装成纳米颗粒,并通过钠依赖性多维生素转运体(SMVT)轻松穿越血脑屏障。同时,α-硫辛酸的类酶和氧化还原特性在清除各种活性氧种(ROS)方面展现出优势,使得纳米颗粒能够作为纳米酶减轻炎症反应并保护神经元免受氧化损伤。此外,钙离子(Ca2+)被证明能够干扰神经元的氧化磷酸化(OXPHOS),导致ATP产生减少和缺氧微环境改善,从而降低P-糖蛋白(P-gp)的表达并延长药物在细胞内的保留时间。在癫痫大鼠模型中的应用显示,LA@PHT-Ca2+因其治疗药物和炎症调节纳米酶的协同作用而展现出治疗效果。总之,这种α-硫辛酸基、装载PHT和复合Ca2+的纳米酶为治疗癫痫提供了一种综合策略,通过减轻癫痫症状和阻断炎症-癫痫发生恶性循环,实现了治疗效果。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202412633


