新理论认为,阿尔茨海默病本质上并非大脑疾病,而是自身免疫疾病
时间:1970-01-01 08:00:00 热度:37.1℃ 作者:网络
可能没有哪一种疾病能像阿尔茨海默病这样,引无数英雄竞折腰。即使强如辉瑞、强生、罗氏等这样的国际医药巨头也感到棘手,全球各大药企在针对这两个靶点的药物临床试验上花费百亿美元后,仍未获成功。
阿尔茨海默病(Alzheimer's disease, AD),俗称“老年痴呆症”,是一种严重的神经退行性疾病,患者通常会出现以记忆力衰退、学习能力减弱为主的症状,并伴有情绪调节障碍以及运动能力丧失,极大地影响个人、家庭乃至社会的发展。
目前,全球约有5000万人罹患阿尔茨海默病。随着人类平均寿命增长,老年化社会加剧,阿尔茨海默病的患病率也在不断上升,预计到2050年,阿尔茨海默病患者将增加至1.5亿以上。
令人遗憾的是,由于病因复杂,科学界至今仍未破译阿尔茨海默病发病的具体机制,主流观点认为病因是β-淀粉样蛋白(Aβ)、Tau蛋白沉积造成神经元大量死亡。
阿尔茨海默病领域争议不断
整个阿尔茨海默病药物研发领域,竞争激烈,而又争议不断。尤其是最近的一些争议事件,让阿尔茨海默病成为舆论焦点。
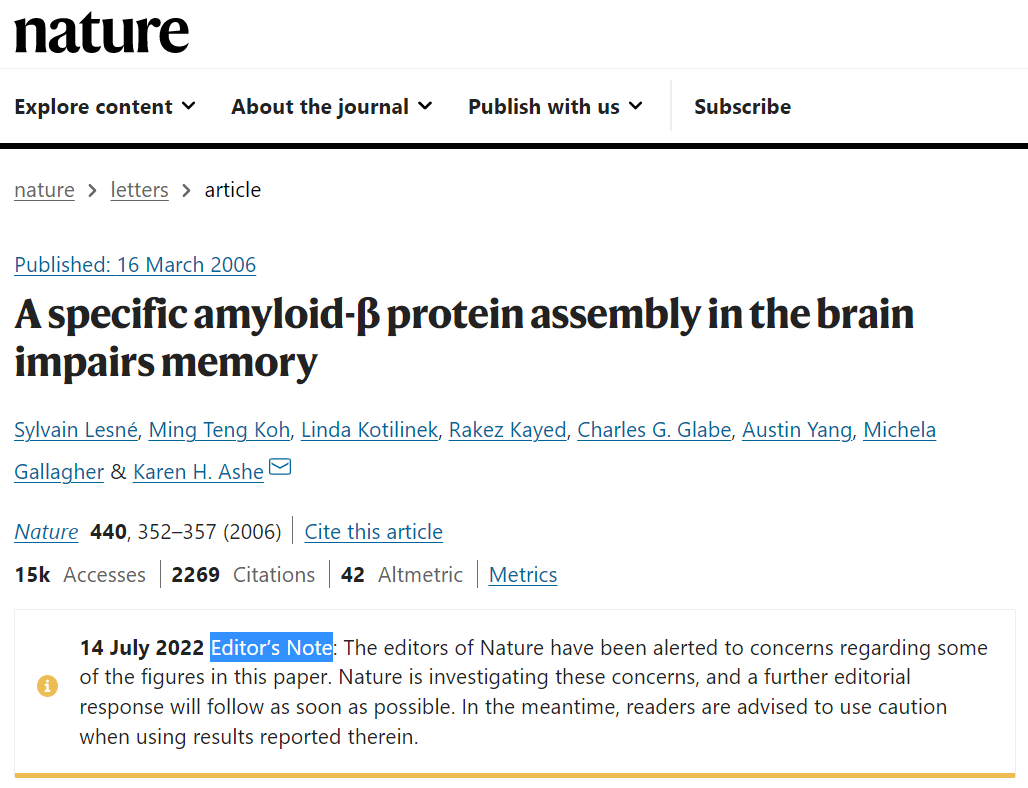
2022年7月22日,Science 发表了一篇历时6个月的调查报告,称美国明尼苏达大学神经学家 Sylvain Lesné 发表的20多篇论文中可能存在学术不端行为,其中就包括2006年在 Nature 发表的一篇阿尔茨海默病领域的重要论文。
调查报告指出,这篇 Nature 论文中发现的所谓的导致阿尔茨海默病的β淀粉样蛋白寡聚体 Aβ*56 很可能并不存在。这项研究很可能误导了全世界的阿尔茨海默病研究长达16年。
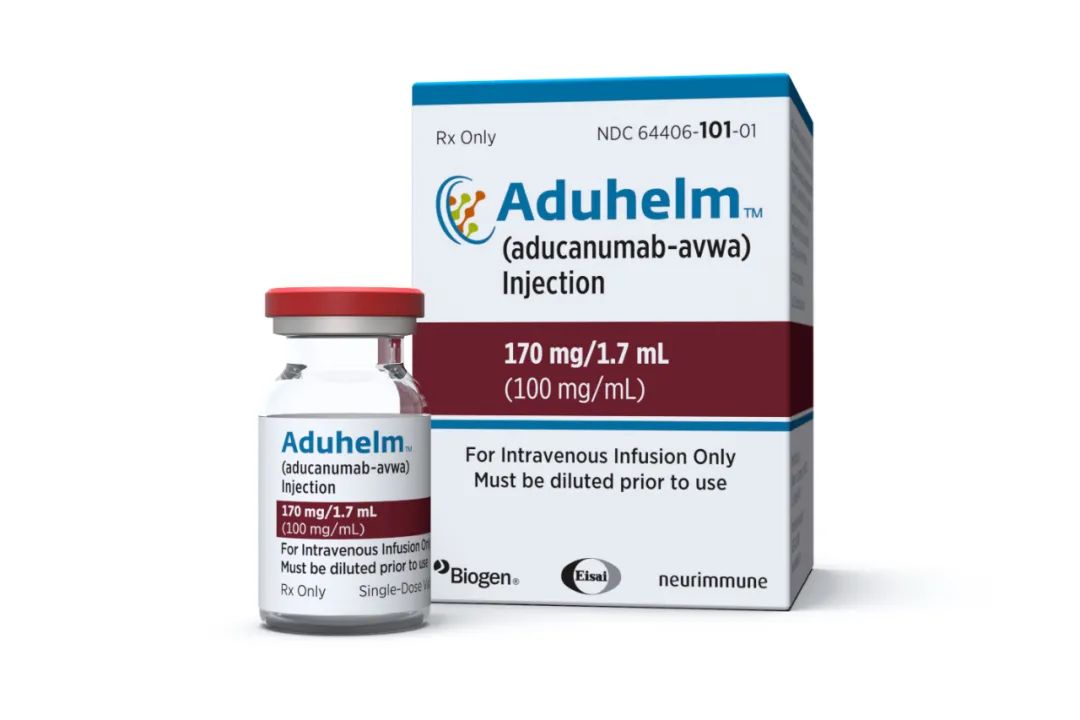
而在一年多前的2021年6月,FDA宣布加速审批渤健(Biogen)的单抗药物 aducanumab(商品名Aduhelm)上市,用于治疗阿尔茨海默病源性轻度认知障碍(MCI)及轻度阿尔茨海默病。这是自2003年以来,FDA 批准的首个阿尔茨海默病治疗新药,也是首个宣称能阻止疾病进展的药物。
 aducanumab
aducanumab
然而,这款药物的获批,引发了巨大争议,临床试验显示,它虽能够清除大脑中的β-淀粉样蛋白(Aβ),但没有足够证据表明其能够减缓或阻止阿尔茨海默病的疾病进展。不仅如此,JAMA Neurology 期刊随后发表的3期临床试验结果显示,该药物存在明显副作用,超过三分之一的患者在用药后出现了脑水肿。
然而,全世界仍有数千万人在承受阿尔茨海默病的折磨,接连不断的失败,到底问题出在哪儿?
摆脱β-淀粉样蛋白的陈规
多年来,科学家们一直致力于通过阻止这种名为β-淀粉样蛋白(Aβ)的神秘蛋白质形成蛋白质团队以及其对大脑的伤害,从而治疗阿尔茨海默病、阻止或减缓疾病进展。
遗憾的是,多年来对 Aβ 的重金投入,并未转化为有用的药物或疗法。或许,科学家们正陷入了对 Aβ 的过度专注,从而忽略其他可能的原因。
因此,跳出思维定势,重新审视阿尔茨海默病,正在成为阿尔茨海默病研究的新前沿。
近日,加拿大达尔豪斯大学的 Donald Weaver 等人在 Alzheimer's & Dementia: Translational Research & Clinical Interventions 期刊发表论文。
他基于自己团队30年的阿尔茨海默病研究,提出了一个新理论:阿尔茨海默病本质上并非大脑疾病,而是一种主要发生在大脑内的自身免疫疾病。

免疫系统存在于我们身体的每个器官中,它们协调工作,帮助修复损伤并保护免受外来入侵者的侵害。当你受伤时,免疫系统会帮助修复受损组织。当你经历病毒或细菌感染时,免疫系统回帮助对抗这些入侵者。
大脑中也同样如此,当头部遭受创伤时,大脑的免疫系统会启动修复。当大脑中出现细菌或病毒感染时,免疫系统也同样会奋起反击。
阿尔茨海默病是自身免疫疾病?
Donald Weaver 团队认为,β-淀粉样蛋白(Aβ)不是一种异常产生的蛋白质,而是一种正常存在的,是大脑免疫系统的一部分。
当发生大脑损伤或被细菌感染时,β-淀粉样蛋白(Aβ)是大脑综合免疫反应的关键因素。由于构成细菌细胞膜的脂质分子和大脑细胞膜的脂质分子具有高度相似性,Aβ无法区分谁是入侵细菌谁是大脑细胞,从而导致了对大脑细胞的错误攻击。这种错误攻击导致大脑细胞功能的慢性进行性丧失,最终导致痴呆症。而这一切都是因为我们身体的免疫系统无法区分入侵的细菌和大脑细胞。
因此,研究团队认为,阿尔茨海默病本质上是免疫系统对本应该保护的大脑进行了错误的攻击而导致的一种自身免疫疾病。
人类的大脑是一个非常特殊器官,有着公认的宇宙中已知最复杂的结构。在该研究的阿尔茨海默病模型中,研究团队发现,β-淀粉样蛋白(Aβ)有助于保护和增强免疫系统,但不幸的是,Aβ 同时还在自身免疫中发挥核心作用,因此导致了阿尔茨海默病的发展。
研究团队认为,尽管传统上的治疗自身免疫病的药物可能对阿尔茨海默病无效,但针对大脑的其他免疫调节途径,将可能从中找到新的有效治疗方法。
阿尔茨海默病的其他新理论
除了这种自身免疫疾病的理论外,近年来还有一系列的阿尔茨海默病新理论被提出来。
例如,有研究团队认为,阿尔茨海默病是一种线粒体结构异常疾病,线粒体是细胞内的能量工厂,将我们呼吸的氧气和我们所吃食物中的葡萄糖转化为生命所需的能量。他们认为,是大脑细胞中的线粒体结构异常导致了阿尔茨海默病。
此外,还有研究认为,阿尔茨海默病是特定的脑部感染导致的(例如口腔中的细菌的感染)。还有研究认为阿尔茨海默病可能是大脑对金属元素(可能是锌、铜、铁)的异常处理引起的。
2022年3月,军事医学研究院袁增强团队与北京大学孙露洋团队合作,在 Cell Metabolism 期刊发表论文。提出了一种阿尔茨海默病的表观遗传调控新机制,小胶质细胞代谢紊乱形成的“糖酵解-组蛋白乳酸化-PKM2”恶性循环能够导致小胶质细胞稳态失衡和神经炎症的发生,进而促进阿尔茨海默病发生发展。
阿尔茨海默病新疗法
目前,前世界有5000万人饱受阿尔茨海默病困扰,随着人口老龄化的加速,阿尔茨海默病正在一场公共卫生危机,我们需要创新理念、拓展新的方向,以实现对阿尔茨海默病的治疗。
2022年8月,韩国科学技术院(KAIST)的研究人员在 Nature Medicine 发表论文。该研究开发了一种新型融合蛋白药物——αAβ-Gas6,它通过与基于 Aβ 单抗完全不同的机制有效地清除大脑中的 Aβ。在阿尔茨海默病小鼠模型中,αAβ-Gas6 不仅能更好地清除 Aβ,而且还规避了与常规抗体治疗相关的神经毒性炎症副作用。
研究团队基于这项研究成果创立了一家名为 Illimis Therapeutics 的公司,研究团队计划通过该公司进一步开发各种Gas6融合蛋白,用于清除Aβ、Tau等,用来治疗包括阿尔茨海默病在内的多种神经系统疾病以及受有毒蛋白影响的自身免疫疾病的治疗,该方法有望成为一种新型治疗平台。

2022年9月,美国德克萨斯大学休斯顿健康科学中心安志强教授团队在 Science Translational Medicine 期刊发表论文。
该团队开发了一种四价 TREM2 激动性抗体,在体外和阿尔茨海默病小鼠模型中均显示出治疗作用,包括增加小胶质细胞介导的吞噬作用和改善动物认知能力等。研究表明,该抗体介导的 TREM2 靶向治疗可以有效减少阿尔茨海默病病理学。

2022年1月,挪威奥斯陆大学方飞团队与澳门大学路嘉宏团队合作,在 Nature Biomedical Engineering 期刊发表论文。
2019年,方飞团队在 Nature Neuroscience 上发表论文,证明了线粒体清除机制(线粒体自噬)受损在阿尔茨海默病发病过程中扮演关键角色。在此基础上,方飞/路嘉宏团队通过机器学习筛选海量小分子,发现2个先导小分子化合物山奈酚和丹叶大黄素能够在神经细胞中诱导自噬,具有治疗阿尔茨海默病潜力。

2021年12月,美国克利夫兰医学中心的程飞雄团队在 Nature Aging 期刊发表论文。
该研究发现,治疗肺动脉高压和男性勃起功能障碍的药物西地那非,与阿尔茨海默病发病风险显著降低有关。这项研究结果表明,西地那非老药新用或是治疗阿尔茨海默病的一个选项。

: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


