前列腺癌的致癌基因和治疗靶点——PRMT5
时间:2022-10-13 15:54:56 热度:37.1℃ 作者:网络
蛋白质精氨酸甲基转移酶5(PRMT5)在20年前被发现。第一个十年专注于PRMT5在健康有机体中细胞过程的调节。第二个十年中,很多证据表明PRMT5可能通过表观遗传和非表观遗传机制在多种癌症中发挥致癌基因的作用。下文关注前列腺癌的最新进展,包括PRMT5在雄激素受体(AR)表达、信号转导和DNA损伤中的作用,特别是DNA双链断裂修复。还讨论了被认为是PRMT5辅助因子的PRMT5相互作用蛋白如何与PRMT5合作,调节PRMT5活性和靶基因表达,以及PRMT5如何与其他表观遗传调控因子相互作用。因此,靶向PRMT5可能被用于开发多种治疗方法,以加强前列腺癌的治疗。
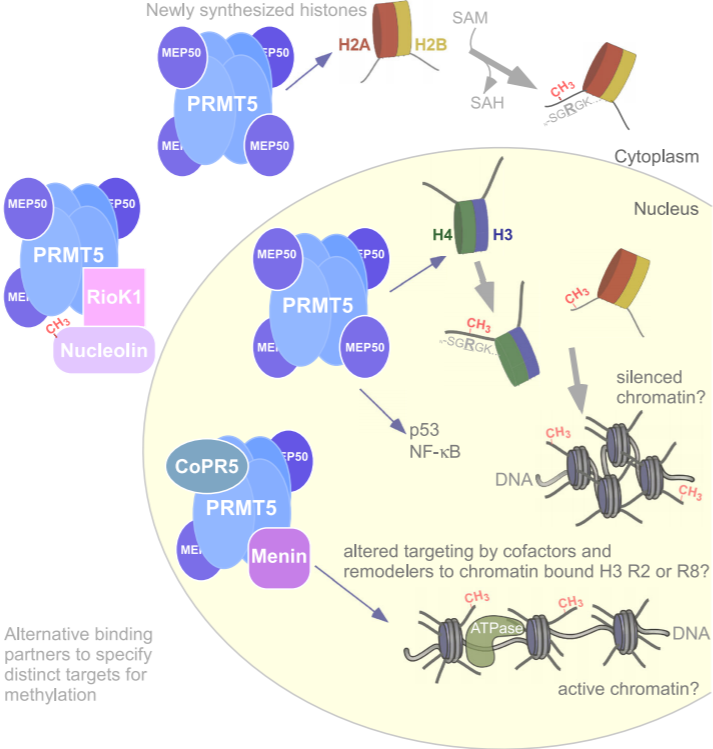
图1 PRMT5通过辅助因子形成八聚体靶向多个组蛋白和核靶点
PRMT5是PRMTs家族的II型酶,可以甲基化组蛋白和非组蛋白底物的精氨酸残基。精氨酸甲基化是跨物种普遍存在的翻译后修饰。到目前为止发现了九种精氨酸甲基转移酶。PRMT5是研究最广泛的II型酶,PRMT9是唯一的另一种II型酶。生化和结构研究表明,PRMT5与MEP50形成了一种八聚体络合物(图1),具有催化活性。除了基因转录的表观遗传调控,PRMT5翻译后甲基化了许多信号分子,如NF-κB, EGFR, p53等。因此,PRMT5是细胞增殖、分化、细胞周期进展、DNA损伤反应(DDR)和细胞死亡的关键调控因子。作为一种重要的调控蛋白,PRMT5在多种癌症中均有过表达。
机制研究表明,PRMT5可能通过(1)肿瘤抑制基因或细胞周期调节因子的表观遗传抑制或(2)信号分子的翻译后调节发挥致癌基因的作用。PRMT5作为一种表观遗传激活因子,促进前列腺癌细胞中DDR基因和雄激素受体(AR)的转录。此外,pICln作为PRMT5的一种新的辅助因子,激活独立于MEP50的靶基因的转录。这些新发现提示了潜在的基于PRMT5的前列腺癌靶向治疗方法。
1、前列腺癌中PRMT5驱动的雄激素受体(AR)信号调控
雄激素/AR信号是前列腺功能正常和前列腺癌生长和进展的主要驱动因素。由于AR信号在前列腺癌中的重要作用,AR仍然是该疾病的主要治疗重点。雄激素阻断疗法(ADT)抑制雄激素的产生或抑制AR信号,是转移性前列腺癌的标准治疗方法。然而,AR信号的可塑性通过多种AR再激活机制导致了治疗耐药性的出现和去势难治性前列腺癌(CRPC)的进展,包括功能获得性突变的出现,AR基因的扩增和非配体剪接变体的表达。因此,了解AR的表达和活性的调控机制对于开发前列腺癌治疗的新方法是必要的。
2、AR转录的表观遗传调控
表观遗传机制介导AR转录的正向和负向调控。早在2000年就有研究表明AR启动子DNA甲基化水平与AR表达呈负相关。从那时起,人们发现了组蛋白甲基化和非编码RNA表达等多种机制有助于AR转录。2012年首次报道了组蛋白甲基化对AR转录的潜在影响的论文。2017年,研究发现在hormone-naïve前列腺癌细胞系LNCaP中,PRMT5与AR启动子结合,并在AR启动子上对称地二甲基化H4R3。在细胞培养和LNCaP异种移植模型中,通过药物抑制或短发夹RNA介导的敲除靶向PRMT5可导致AR mRNA和蛋白表达减少,同时细胞增殖降低。如图2A,转录因子Sp1将PRMT5招募到AR启动子,因为PRMT5没有DNA结合域。在不同的AR再激活机制的CRPC细胞中靶向PRMT5可降低细胞增殖,下调AR、AR剪接变异体和AR靶基因。

图2 前列腺癌中PRMT5调控AR信号的机制
3、转录因子介导的AR转录调控
除了通过AR启动子近端组蛋白的甲基化直接调控AR转录外,PRMT5还可以通过调节AR调控转录因子间接控制AR转录(图2B)。例如,Sp1是激活AR表达的主要转录因子。在急性髓系白血病中,PRMT5下调可能通过miRNA miR-29b的减弱抑制导致Sp1表达下调。Sp1将PRMT5招募到AR近端启动子区来激活前列腺癌细胞中的AR转录。
和Sp1一样,c-Myc是AR转录的另一个阳性调控因子,也是前列腺癌的一个重要致癌基因。在胶质母细胞瘤中,c-Myc也可以招募PRMT5到其靶基因上。c-Myc已被证明上调PRMT5的转录,反之亦然,PRMT5已被证明上调淋巴瘤中的c-Myc表达,提示另一种潜在的正反馈循环机制。N-Myc是Myc家族的另一个转录因子,与前列腺腺癌向神经内分泌前列腺癌(NEPC)的进展有关。重要的是,在前列腺癌神经内分泌分化过程中,N-Myc同时与AR和EZH2相互作用,促进AR靶基因的转录抑制。在神经母细胞瘤中,PRMT5是N-Myc蛋白稳定性的关键调控因子。由于N-Myc在NEPC中的显著作用,PRMT5是否也调节前列腺癌中N-Myc的稳定性,靶向PRMT5是否可以通过下调N-Myc的表达来抑制NEPC的生长,也需要进一步的研究。
另一个参与前列腺癌AR转录调控的转录因子是NF-κB。也被证明能够激活和抑制AR。在几个模型中,NF-κB通过PRMT5甲基化增强NF-κB与靶基因的结合而激活。因此,PRMT5过表达的前列腺癌中,PRMT5很可能通过激活NF-κB,促进AR表达。有趣的是,p53作为转录抑制因子参与AR表达的调控,而在淋巴瘤模型中,PRMT5介导的甲基化使p53失活。综上所述,PRMT5在多个水平上参与AR表达的调控,包括通过与AR启动子结合直接转录激活和调节AR调控转录因子。
4、AR转录活性和靶基因表达的调控
除了调节AR的表达外,PRMT5还可以通过与AR蛋白相互作用,作为转录因子调节AR功能,直接调节AR活性(图2C, D)。有研究表明,PRMT5可能独立于PRMT5甲基转移酶活性,作为AR共激活剂。
5、前列腺癌中PRMT5介导的DDR调控
基因组不断地暴露在内源性和环境压力下,导致DNA损伤。DNA损伤反应(DDR)是一种进化保守的细胞反应,通过协调调节细胞周期阻滞、DNA损伤修复和凋亡来维持基因组的完整性。DNA双链断裂(DSBs)是最具细胞毒性的DNA损伤。DSB的不正确或不完全修复促进突变的积累和癌症的发展。相反,癌症疗法如放疗和化疗通过诱导大量的DSB和凋亡杀死癌细胞。因此,DDR蛋白的突变导致了癌症发病率的增加,而靶向DDR调控因子的治疗药物被单独用作抗癌药物或与化疗和放疗联合使用。
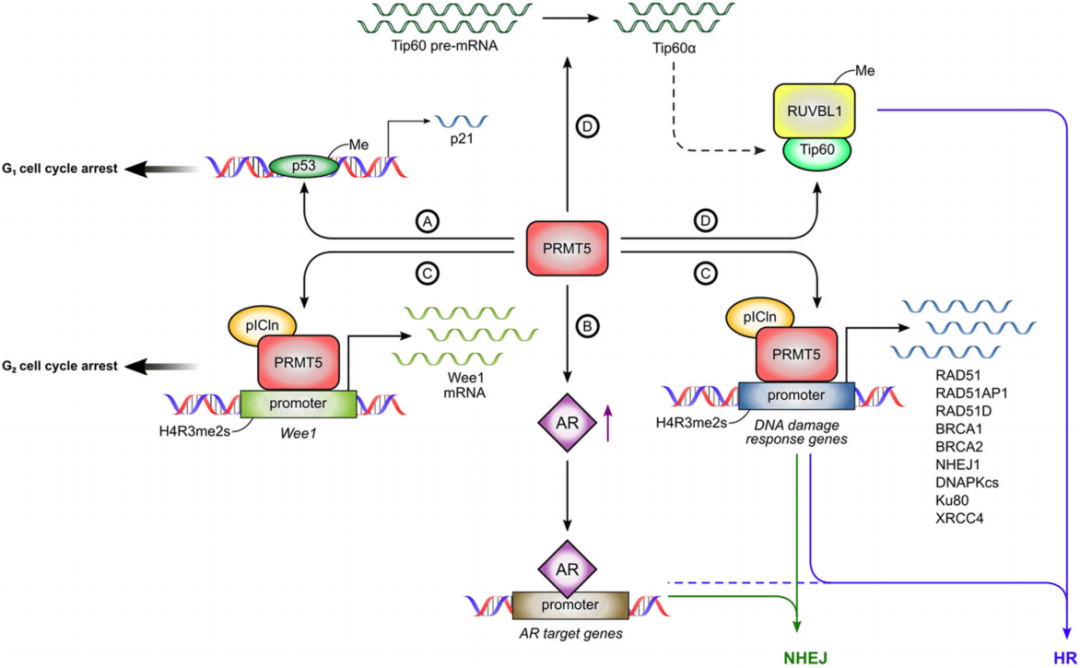
图3 PRMT5在前列腺癌DNA损伤反应中的作用
6、细胞周期的控制
如图3,p53是响应DNA损伤的细胞周期阻滞和凋亡的关键转录因子。然而,p53如何选择性地激活这些细胞反应仍然是该领域的一个核心问题。2008年,Jansson等证实PRMT5可以在精氨酸残基333、335和337处甲基化p53,激活p21的转录,并在DNA损伤剂依托泊苷的作用下促进G1细胞周期阻滞(图3A)。这一发现第一次证明了PRMT5在DDR中的直接作用。
此后,多项研究证明了PRMT5在DDR中起关键作用(图3A-D)。在包括前列腺癌在内的大多数癌细胞中,PRMT5的敲除诱导G1阻滞,这表明PRMT5在G1进展中起着积极的调节作用。在DNA损伤的情况下,PRMT5在调节细胞周期中起着不同的作用。在前列腺癌细胞中,由于WEE1的表观遗传激活,DNA损伤诱导的G2阻滞需要PRMT5。在其他癌细胞中,PRMT5通过RAD9的甲基化和KLF4的积累调节G2的阻滞。这些机制可能也有助于前列腺癌细胞中的G2阻滞。未来的研究将进一步确定PRMT5在前列腺癌细胞细胞周期阻滞中的作用。
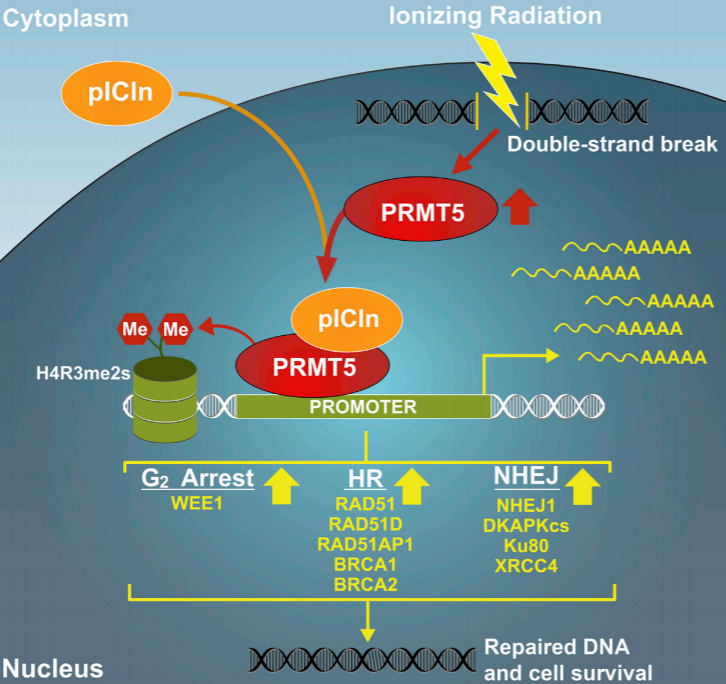
图4 PRMT5与pICln协同作用完成DNA双链断裂修复
7、DSB修复基因表达的表观遗传学调控
关于PRMT5在DDR中的作用的一个主要发现是,PRMT5在前列腺癌细胞中作为DSB修复基因的主表观遗传激活因子(图3C)。PRMT5对于修复电离辐射和乙泊苷诱导的DSB以及激活同源重组(HR)和非同源末端连接(NHEJ)都是必需的。PRMT5的敲除增加了独立于外部DNA损伤诱导物的自发性DSB,这表明PRMT5是预防或修复内源性DSB所必需的。如图4,随后的分析发现了几个与DDR相关的PRMT5靶基因,包括HR(RAD51, RAD51D, RAD51AP1, BRCA1和BRCA2)和NHEJ相关的基因(NHEJ1 / XLF和DNAPKcs / PRKDC)。当DNA受损时,PRMT5被上调,并被招募到DDR基因的启动子中,以促进转录。令人惊讶的是,PRMT5介导的这些基因的激活不依赖于典型辅助因子MEP50,而依赖于pICln。DSB被识别后,修复蛋白(如RAD51, BRCA1和BRCA2)短暂上调,通过HR或NHEJ促进修复。虽然这种短暂的上调是在基因毒性胁迫下细胞存活所必需的,但很少有人知道蛋白质是如何快速上调以促进DNA损伤的修复。DNA损伤引起的PRMT5表达上调和随后DSB修复基因的激活可能也在蛋白质水平上显著促进DSB修复。
PRMT5可能对前列腺癌细胞中的DSB修复特别关键,因为它在AR的转录中起调节作用,因为AR在转录上调控NHEJ中几个靶基因的表达(图3B)。在前列腺癌细胞中靶向PRMT5可以降低AR和参与NHEJ的AR靶基因。此外,与其他来源的细胞(如乳腺癌或胶质母细胞瘤)相比,PRMT5介导的Ku80/XRCC5、XRCC4和DNAPKcs/PRKDC在表达AR的前列腺癌细胞中的调控作用更强。因此,在前列腺癌细胞中,PRMT5可以通过调节AR的表达直接和间接调控DDR基因的表达。事实上,与大多数其他癌症相比,前列腺癌中参与NHEJ的PRMT5和AR靶基因之间的相关性更强。由于PRMT5不包含任何DNA结合域,AR是否也将PRMT5招募到DNAPKcs/PRKDC的启动子上,还有待研究。
8、DSB修复通路的调控
无论通路选择如何,DSB都能被有效修复。路径的选择影响修复的速度和准确性。HR和NHEJ是DSB修复的两种主要途径。Tip60催化H4K16的乙酰化可以使局部染色质放松,促进53BP1从DSB中移位,使BRCA1结合,形成RPA丝,随后通过HR修复DSB。
最近,研究发现,在骨肉瘤细胞中,PRMT5可能通过甲基化Tip60复合体RUVBL1上的R205,促进HR而非NHEJ,从而促进DSB修复(图3D)。机制上,ruvbl1的甲基化增加了Tip60的乙酰化酶活性导致H4K16ac增加。适当拼接Tip60需要PRMT5,从而促进Tip60乙酰转移酶活性,降低53BP1与DSB的结合,促进HR。PRMT5缺陷的造血祖细胞全长Tip60水平降低,Tip60乙酰转移酶活性降低,HR缺陷。
综上所述,PRMT5是前列腺癌中DDR的关键调控因子。PRMT5调节与DDR相关的其他蛋白的功能(p53,E2F1,FEN1,RAD9 ,KLF4 ,TDP1)。未来对这些PRMT5底物的表征以及对其他底物和靶基因的鉴定将使人们对PRMT5在前列腺癌细胞DDR中的表观遗传和非表观遗传作用有新的认识。
9、相互作用蛋白对PRMT5活性和靶基因表达的调控
除了MEP50外,PRMT5还能与其他蛋白相互作用,这些相互作用蛋白可能调节酶活性和底物特异性。利用纯化重组蛋白的研究表明,MEP50是甲基转移酶活性所需的PRMT5的专性辅因子,而RioK1和pICln等蛋白改变底物特异性。然而,在前列腺癌中,pICln而不是MEP50介导了PRMT5对AR和DDR基因启动子组蛋白的活性。
PRMT5和pICln结合多个DNA损伤反应基因的启动子,以对称二甲基化组蛋白H4R3,这种PRMT5/pICln和组蛋白甲基化的募集在DNA损伤时得到加强。机制上,pICln和MEP50的整体表达不因DNA损伤而改变。pICln在细胞核中积累,而MEP50在细胞质中定位。由于pICln和MEP50均可增强PRMT5活性,而H4R3甲基化既参与靶基因的激活也参与靶基因的抑制,其相互作用蛋白的选择可能决定了PRMT5靶基因表达的激活或抑制。在CRPC细胞中,PRMT5/pICln对靶基因表达的转录激活也表现为AR转录的激活。因此,PRMT5中心复合体的组成和组蛋白精氨酸甲基化的类型可能决定了靶基因的转录激活与抑制。未来的研究需要对PRMT5靶基因及其与辅因子、组蛋白修饰的关系进行全基因组分析。
10、PRMT5靶向治疗前列腺癌的潜力
尽管前列腺癌治疗良好,10年生存率超过90%,但局限性高危前列腺癌和转移性前列腺癌仍然是主要的临床挑战。局限性高危前列腺癌的金标准治疗是放射治疗(RT)联合雄激素阻断疗法(ADT),而转移性hormone-naïve前列腺癌(HNPC)患者使用一线ADT治疗,CRPC患者使用第二代AR信号抑制剂(ASI)阿比特龙和恩杂鲁胺治疗。不幸的是,30-50%的高危前列腺癌会复发,并最终发展为转移性疾病。尽管大多数 HNPC最初对ADT有积极反应,但几乎所有 HNPC 病例都在2年内进展到CRPC。此外,有证据显示,在ASI之后,近20%的CRPC进展为NEPC。神经内分泌前列腺癌(NEPC)是一种侵袭性癌症,中位生存期为一年。目前,NEPC被认为是该病的末期,没有有效的治疗方案。
此外,RT和ADT/ASI治疗有显著的不良反应,降低了生活质量。因此,迫切需要开发新的治疗策略或提高现有的治疗效果。鉴于PRMT5在前列腺癌细胞辐射诱导的DSB修复和AR信号通路调控中的重要性,靶向PRMT5可能被探索为一种新的AR靶向治疗转移性前列腺癌的方法,或作为一种治疗局限性前列腺癌的放射致敏方法。
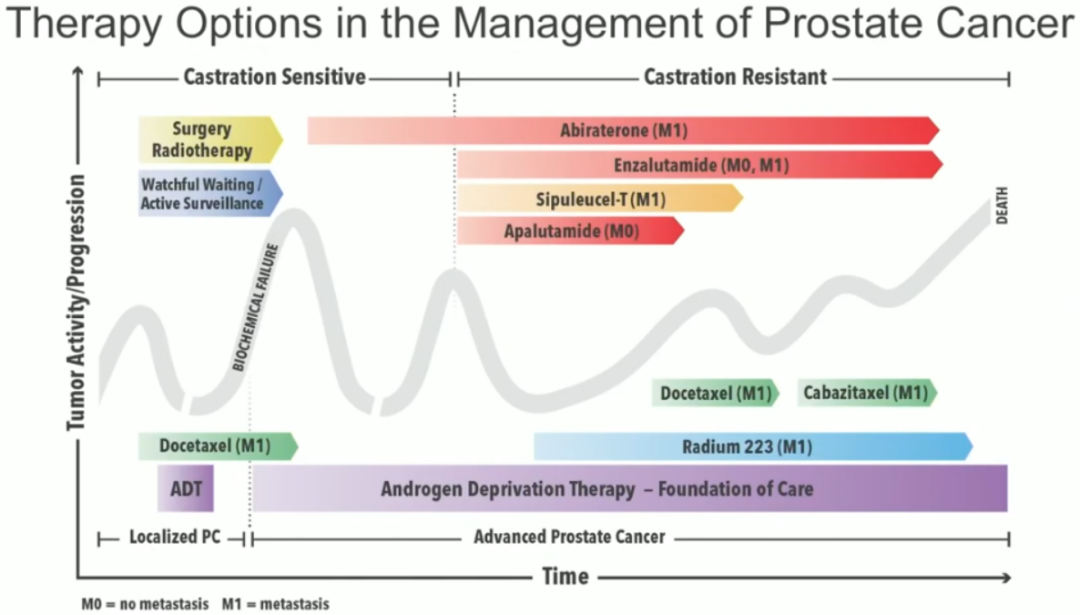
图5 前列腺癌的几种有限的治疗选择
11、靶向PRMT5作为前列腺癌治疗的单一疗法
AR是前列腺癌发展和进展的主要驱动因素,靶向AR仍然是转移性前列腺癌治疗的主要手段。最近的研究发现PRMT5在多个水平上调控AR信号,这表明靶向PRMT5可能被用作治疗前列腺癌的一种新方法。目前,有4种抑制剂在美国处于临床试验: GSK3326595、JNJ-64619178、PRT543和PRT811。GSK3326595和JNJ-646191是PRMT5的催化抑制剂,GSK3326595在底物结合口袋与肽底物竞争,JNJ-64619178可以对SAM和底物竞争。这些试验招募了血液系统恶性肿瘤和实体瘤患者,预计将在2021 - 2023年完成。
鉴于PRMT5的下调显著抑制了前列腺癌细胞的生长,并抑制了小鼠异种移植瘤的生长,在临床前模型中,PRMT5的抑制剂可以使PRMT5下调。由于PRMT5不仅调节AR转录,还调节AR活性和靶基因表达,因此这些抑制剂靶向PRMT5可能会对目前的ADT和ASI疗法提供加成或协同作用。由于HNPC/CRPC的生长和存活依赖于AR信号,靶向PRMT5也可能通过下调AR信号抑制CRPC细胞的生长。有趣的是,MTAP的缺失使细胞严重依赖PRMT5,这可能是PRMT5特异性治疗的一个特别有用的患者层。由于10-70%的前列腺癌组织已经减少MTAP表达,这部分患者单独使用PRMT5抑制剂可能得到有效治疗。未来对这些PRMT5抑制剂的临床前评估应该包括有和没有MTAP缺失的前列腺癌细胞。如果这些临床前研究证实了PRMT5抑制剂的治疗潜力,那么未来的临床试验将能够评估这些PRMT5抑制剂对转移性前列腺癌的治疗效果。
— 结束语和未来展望 —
人类PRMT5基因的克隆于1999年被报道。然而,PRMT5在人类癌症中的作用只是近年来才有报道。最近的研究结果表明,PRMT5在前列腺癌的DDR和AR信号通路中起着关键作用。值得注意的是,前列腺癌组织中PRMT5的表达明显高于良性增生组织,且PRMT5的表达在蛋白和mRNA水平上与AR高度相关。虽然PRMT5通常被认为是人类癌症中肿瘤抑制因子和细胞周期调节因子的表观遗传抑制因子,但最近的证据,已经证明PRMT5也作为DDR基因和AR的表观遗传激活因子发挥作用。最近的几个RNA-seq研究也发现了相当数量的基因被PRMT5敲除激活或抑制,尽管这些基因是否是PRMT5的直接靶标仍有待确定。另一个令人惊讶的发现是pICln,而不是MEP50,作为PRMT5转录激活DDR基因表达的潜在辅助因子。
由于PRMT5激活AR转录需要Sp1和Brg1的参与,PRMT5可能与其他转录调控因子形成高阶复合体,以位点特异性的方式决定转录输出。考虑到PRMT5的许多正常细胞作用,催化抑制剂靶向PRMT5可能会导致一些不必要的副作用。尽管PRMT5抑制剂的靶向传递可能会绕过这个问题,但发现pICln作为PRMT5激活AR和DDR基因转录的新辅助因子,表明靶向PRMT5与pICln的相互作用可能提供一种特殊而独特的方法来作为单一疗法或作为放射敏化剂治疗前列腺癌。
随着我们对前列腺癌生物学和病理学的理解不断发展,新的治疗方法不断开发,探索PRMT5在前列腺癌发展和进展中的作用是有必要的。一个新出现的临床挑战是NEPC的发展。由于大多数NEPC细胞失去AR的表达或活性,确定PRMT5靶向是否可以通过下调AR促进NEPC的发育是非常必要的。相反,靶向PRMT5联合目前的铂化疗可能为NEPC提供更好的治疗方法。同样,联合靶向AR表达(PRMT5抑制剂)和AR活性(如阿比特龙、恩杂鲁胺和达洛鲁胺)可能对抑制CRPC和防止向NEPC发展具有附加甚至协同作用。
总之,PRMT5在前列腺癌中的作用已经开始显现。上面讨论的证据清楚地表明,靶向PRMT5可能被探索为一种新的AR靶向方法。未来还需要更加清楚的阐明PRMT5在前列腺癌发展、进展和治疗干预过程中的作用和潜在机制。
参考文献:
1. Chang-Deng Hu et al; PRMT5: A putative oncogene and therapeutic target in prostate cancer. Cancer Gene Ther. 2022 March ; 29(3-4): 264–276.
2.Nicole Stopa et al;The PRMT5 arginine methyltransferase: many roles in development, cancer and beyonds. Cell. Mol. Life Sci. (2015) 72:2041–2059.
3.Chang-Deng Hu et al;PRMT5 Cooperates with pICln to Function as a Master Epigenetic Activator of DNA DoubleStrand Break Repair Genes. https://doi.org/10.1016/j.isci.2019.100750.
4.https://grandroundsinurology.com/androgen-targeted-therapy-across-the-continuum-of-prostate-cancer/.


