Cell封面:国内学者发现米色脂肪局部热疗就可能减肥
时间:2022-03-10 09:24:45 热度:37.1℃ 作者:网络
肥胖是是糖尿病、高血压、高血脂、脂肪肝、心血管疾病和某些癌症等疾病的重大风险因素,严重危害人类健康。米色脂肪(Beige fat)是一类新发现的脂肪,其静息时表现出白色脂肪的特质,而在寒冷或β肾上腺素能受体激动剂等激活的情况下,具有棕色化潜力,促进产热和能量消耗,改善机体糖脂代谢,显示出巨大的可塑性。成年人肩胛骨附近也分布有米色脂肪,因此是防治肥胖与代谢性疾病的重要组织靶点。
尽管冷刺激或β肾上腺素受体激动剂是激活米色脂肪的有效方法,然而这些方法在人体中作用有限,并且可能具有潜在的副作用,危害身体健康。因此,迫切需要发现新靶点和新策略,以安全有效的方式激活米色脂肪对抗肥胖。
北京时间2022年3月5日,华东师范大学生命科学学院马欣然、徐凌燕研究员携手上海交通大学附属第六人民医院胡承教授与华东师范大学生命科学学院张强研究员,在Cell杂志上发表了题为“Local Hyperthermia Therapy Induces Browning of White Fat and Treats Obesity”的论文。
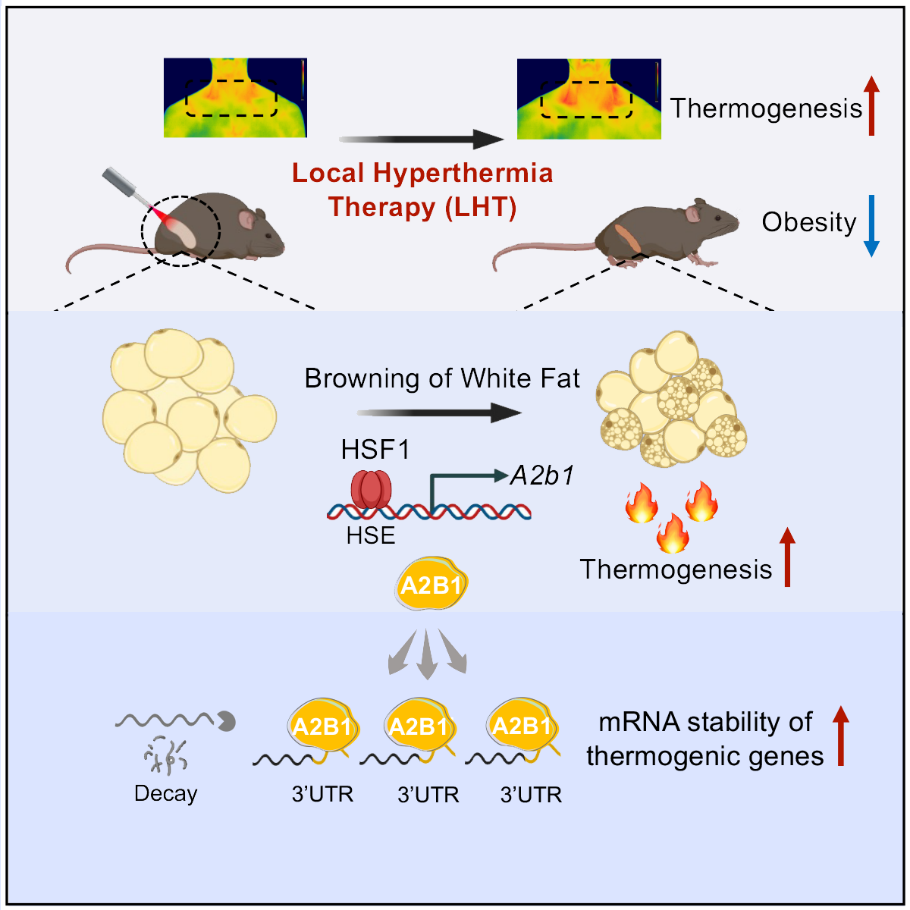
该研究报道了米色脂肪局部热疗可通过HSF1-A2b1转录轴激活产热,减轻肥胖并改善代谢紊乱的作用和分子机制。同时该论文被选为Cell的封面故事(Cover Story),将于3月17日正式刊出。

Cell 3月刊封面论文设计图:局部热疗促进白色脂肪棕色化,改善代谢健康。封面创意取自Pheonix故事(希腊神话的不死鸟和郭沫若先生笔下的凤凰涅槃传说)。白色脂肪(White fat)经历热疗(Hyperthermia)后发生棕色化转变(Browning),迸发出能量(Pheonix),为人类带来健康。
HSF1是经典的热休克转录因子,传统上被认为在热激等多种应激条件下转录激活分子伴侣HSPs表达,维持细胞内蛋白质稳态。近年来发现HSF1具有更广泛的生理功能及调控靶基因。马欣然/徐凌燕团队在前期研究中发现HSF1在米色脂肪和骨骼肌中可激活线粒体关键基因Pgc1α及其下游代谢程序,并且利用雷公藤红素Celastrol激活HSF1促进小鼠能量代谢,增强代谢组织线粒体功能并改善肥胖及糖脂稳态(Ma et al., Cell Metabolism, 2015; Xu et al., Cell Death Dis, 2016)。然而有研究表明Celastrol的靶点可能并不只限于HSF1,例如Celastrol可能会作用于中枢影响食欲,以及在肝脏中清除损伤线粒体、抑制炎症。因此,找到新的靶向性策略有效激活脂肪中HSF1成为了研究关键。
鉴于HSF1在热激下被激活的特性,研究人员将目光转向了热疗法。作为一种治疗手段,热疗法古已有之。我国中医早已使用药物熏蒸、艾炙、火罐等方法治疗疾病,热疗技术更是具有广泛的临床应用。近年来,热疗法包括桑拿、热瑜伽、热水浴也已被证明可以在一定程度上改善代谢。然而,全身的热疗可能会增加神经系统与心血管疾病风险,且尚不清楚米色脂肪是否参与热疗带来的代谢获益。
基于前期研究成果,马欣然/徐凌燕团队聚焦米色脂肪,联合张强研究员,采用米色脂肪注射基于聚多巴胺纳米颗粒构筑的光热水凝胶,通过红外光照射,实现米色脂肪在温和温度下(41±0.5oC)高效的局部热疗。通过温敏荧光染料、红外热成像技术,及HSF1脂肪特异性敲除小鼠,测试了米色脂肪局部热疗对脂肪组织及整体代谢的影响,发现局部热疗不仅促进体外培养的米色脂肪细胞产热,在小鼠和人类中局部热疗也足以激活脂肪组织产热。并且,研究人员证实了长期局部温和温度热疗可在不影响中枢交感神经系统和免疫系统的情况下,以HSF1依赖的方式抵抗和治疗肥胖,改善胰岛素敏感性和肝脏脂质沉积,并且不产生明显的副作用,说明局部热疗是一种安全的减肥方式。并且通过AAV腺相关病毒介导米色脂肪特异性过表达激活型HSF1也能起到同样的减肥和改善代谢紊乱的效果。此外,该疗法不仅可以预防和抵抗肥胖,同样可以对重度肥胖小鼠起到治疗作用。
接下来,为进一步探索和完善HSF1代谢调控网络,研究人员利用ChIP-Seq技术,在全基因组范围内筛查了米色脂肪中HSF1直接调控的靶基因,发现HSF1可能通过促进下游分子HNRPA2B1 (A2B1) 转录发挥调控作用,并利用AAV腺相关病毒介导的米色脂肪特异性过表达/敲减A2B1小鼠及A2B1敲除小鼠进行了验证。体外进一步的机制研究表明A2B1通过维持脂肪组织中关键代谢基因Pgc1α、Ucp1、Elovl3、Cytc等mRNA稳定性促进白色脂肪棕色化和能量代谢。这些结果证实了局部热疗通过激活HSF1,促进A2b1转录,维持关键代谢基因mRNA的稳定性,促进米色脂肪棕色化,改善肥胖及代谢稳态。结合该团队之前的研究结果(Cell Metabolism, 2015),提示HSF1可以对线粒体和产热关键基因Pgc1α等进行转录和转录后双重调控,从而深化和完善了HSF1的代谢调控网络。
最后,为了评估HSF1与人类代谢性状关联性,马欣然/徐凌燕课题组联合上海交通大学附属第六人民医院胡承教授,通过万余人的基因组变异分析,发现HSF1突变体p.Pro365Thr与人群中多种代谢性状的改善关联,如较低的BMI,血清甘油三酯水平,胰岛素敏感性等,并且HSF1的该功能性SNP能够在细胞和小鼠中促进A2B1的表达,说明HSF1在人类代谢中也发挥着重要作用,靶向HSF1-A2B1的治疗方法将具有重要临床意义。
本工作示意图(Graphic Abstract)
总的来说,该研究创新性地发现除了寒冷刺激,米色脂肪可以通过HSF1感应局部温和热效应并激活产热,安全有效地抵抗和治疗肥胖并改善胰岛素抵抗和肝脏脂质沉积等代谢紊乱。此外,该研究首次在基因组层面发现HSF1-A2B1转录轴,进一步完善了HSF1代谢调控网络。并在上万人群研究中明确了HSF1与代谢性状的关联性,从而为干预肥胖提供了新靶标和新策略。
该研究以华东师范大学为第一单位,与上海交通大学附属第六人民医院合作完成。华东师范大学马欣然研究员、徐凌燕研究员、上海交通大学附属第六人民医院胡承教授、华东师范大学张强研究员为该研究共同通讯作者,华东师范大学博士后李雨、副研究员王冬梅为共同第一作者。该研究得到华东师范大学李大力研究员、程义云教授、上海交通大学附属瑞金医院王计秋研究员大力支持和协助。
该研究受到国家自然科学基金委优青和面上项目、国家重点研发计划、上海市科委等基金资助。
附:华东师范大学马欣然研究组、上海市交通大学附属第六人民医院胡承研究组、上海交通大学医学院附属瑞金医院王计秋研究组招聘博士后/科研助理
马欣然课题组主要围绕脂肪和肝脏组织脂质代谢调控机制,系统解析关键脂质调控分子在转录/表观遗传调控层面对脂质代谢稳态的维持机制,以及对肥胖和脂肪肝发生发展的影响。研究成果发表在Cell、Cell Metab、PNAS、J Hepatol、Hepatology、Cell Res等期刊。博士后申请材料发送至:xrma@bio.ecnu.edu.cn (华东师范大学)
胡承课题组从2型糖尿病及其并发症的遗传机制出发,解析新基因通过脂肪、肝脏、胰岛、中枢神经系统等参与代谢性疾病发病的机制。研究成果发表在Cell、Nat Genet、Diabetes、J Clin Invest、J Hepatol等期刊。博士后及科研助理申请材料发送至:alfredhc@sjtu.edu.cn (第六人民医院)
王计秋课题组从事肥胖症的发病机制与临床干预研究,近年重点关注肥胖遗传与脑肠食欲调控、营养吸收方向。研究成果发表在Nat Med、Nat Cell Biol、Sci Adv、Circulation、Cir Res、Diabetes等学术期刊。
相关论文信息:
https://doi.org/10.1016/j.cell.2022.02.004


