又不需要男人了?国人首次实现“孤雌生殖”,小鼠可活到成年,并生育后代
时间:2022-03-10 08:22:36 热度:37.1℃ 作者:网络
《西游记》中有这样一个国度:那儿没有男人,当女子成年之后,会去饮用子母河中的水,不出几日便可喜得一女。“女儿国奇遇”的故事大家都耳熟能详,但身处明代的吴承恩万万不会想到,自己的奇思妙想竟会在500多年后的今天得以实现!

82年版《西游记》中女儿国剧照
与“女儿国”故事中非常接近的一种生殖方式称为孤雌生殖(parthenogenesis),指在没有交配、不经过精子与卵母细胞融合的情况下,由雌性独立产生子代。
孤雌生殖的方式,常见于一些植物以及部分无脊椎动物,比如蜜蜂和蚂蚁,蜂后和蚁后未受精的卵子可以发育成雄蜂或雄蚁。在一些低等脊椎动物中也发现了孤雌生殖的现象,主要存在于鱼类、两栖类、爬行类和鸟类。

意大利水族馆中,以孤雌生殖方式出生的小星鲨“伊斯佩拉”
众所周知,以人类为代表的哺乳动物,是有性生殖繁衍而来,需要精子和卵细胞结合形成受精卵,再由受精卵发育形成一个完整的个体。受到印记基因的阻碍,自然界里不存在无性繁殖的哺乳动物,所以“女儿国”的现象在哺乳动物中理应不存在。
2004年,东京农业大学成功地将两只雌性小鼠的卵细胞核结合起来,诞生了10只没有父亲的小鼠。而这10只幼崽中,仅有1只存活到成年,她被称为“辉夜姬”,是世界上首例孤雌生殖的哺乳动物。这项研究被发表在Nature上,曾轰动一时。
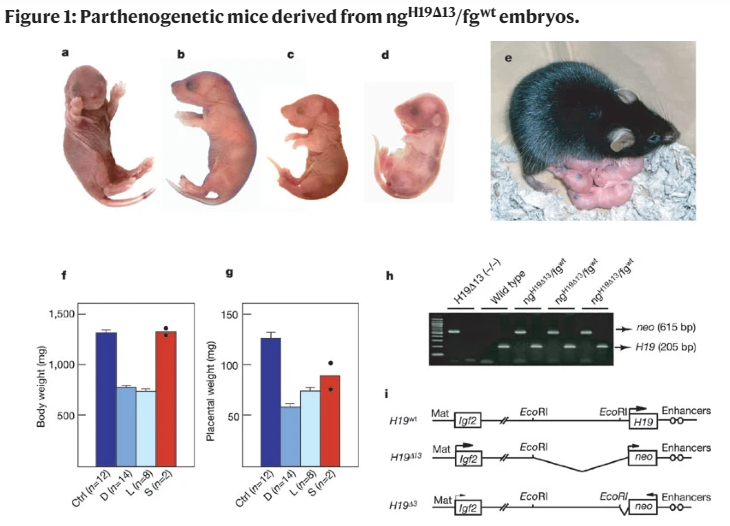
而就在本周(2022年3月7日),《美国科学院院报》(PNAS)上刊登了上海交通大学医学院附属仁济医院魏延昌团队的研究成果。研究学者采用基因编辑的方式,通过改写印记控制区域的甲基化情况,实现了仅用单个、未受精卵母细胞,就能培育出哺乳动物的后代,且小鼠可以活到成年并生育子代。

https://doi.org/10.1073/pnas.2115248119
这是在单性生殖后代实验中,首例采用「单个」未受精的卵母细胞发育而来的哺乳动物。东京农业大学繁育的“辉夜姬”虽然没有父亲,但还是有两个母亲的,而我们上海交大孤雌生殖小鼠仅有个“单亲妈妈”。
了解“小鼠是如何实现孤雌生殖”之前,首先要知道“什么是印记基因(imprinted genes)”。
印记基因,是在哺乳动物的遗传物质当中,存在的一类比较特殊的基因。尽管具有父母双方来源的等位基因,但是后代只转录或表达其中一方的遗传信息,另一个不表达或表达甚微。
正是印记基因的存在,使得自然界中哺乳动物无法完成孤雌生殖。孤雌生殖会打破了这种平衡。在孤雌胚胎中,既不存在来自父系的印记基因,又会使得母体的特异性印记双倍建立(小鼠为二倍体基因组),这也是为什么孤雌生殖细胞几乎不可能发育成胚胎。
为了实现孤雌细胞的发育,研究学者必须要对小鼠卵母细胞的基因进行改写。
首先,他们在卵母细胞中找到了7个重要的印记控制区域(2个来自父系:H19和Gtl2;5个来自母系:lgf2r,Snrpn,Kcnq1ot1,Nespas,Peg10)。接着,使用dCas9-Dnmt3a对2个来自父系的印记控制区域进行甲基化编辑,使用dCpf1-Tet1对5个来自母系的印记控制区域进行甲基化编辑。在基因编译后,卵细胞会直接进入接受精子后的正常受精状态,成为孤雌胚胎。
孤雌小鼠的基因编辑
实验中,研究学者总共构建了389个经过修饰的孤雌胚胎,体外胚胎培养的过程中,仅有49.4%的发育成囊胚。于是,研究学者将这192个囊胚移植到14个雌性小鼠体内,最终只有3只小鼠成功诞生。
3只小鼠中,有两只因体重过轻(0.783g和0.832g),出现生长迟缓,没能撑过一天。唯一存活下的一只“鼠坚强”,体重达到1.101g,与野生型小鼠体重接近(1.147±0.042g),并活到成年,有正常的生殖能力。

孤雌胚胎的发育情况
这个研究证明,孤雌生殖在哺乳动物中是可行的,是单性生殖领域的重要进步。
难道在未来的某一天,人类繁衍不再需要男人了吗?当然不是。从这项实验来看,孤雌生殖存在较多的缺陷,比如生殖效率极低,该研究领域仍有许多未知亟待探索。另外,将该技术应用到人类,面临着许多伦理方面的争议和障碍。
至于标题为什么用了“又”字?请看下文:Cell: 人造精子成真!人类的繁衍不需要男人了?
参考来源:[1] Kono, T., Obata, Y., Wu, Q. et al. Birth of parthenogenetic mice that can develop to adulthood. Nature 428, 860–864 (2004). https://doi.org/10.1038/nature02402
[2] Wei Y, Yang CR, Zhao ZA. Viable offspring derived from single unfertilized mammalian oocytes. Proc Natl Acad Sci U S A. 2022 Mar 22;119(12):e2115248119. doi: 10.1073/pnas.2115248119. Epub 2022 Mar 7. PMID: 35254875



