Immunity:乳酸菌竟会促癌?!乳酸菌产生的吲哚会激活抑制免疫的巨噬细胞,促进胰腺癌生长
时间:2022-02-26 22:21:45 热度:37.1℃ 作者:网络
乳酸菌一直是我们所熟知的益生菌,可维持肠道菌群平衡,刺激肠道运动,改善排便等等,似乎百利而无一害,各种乳酸菌饮料,乳酸菌素片也是应运而生。
但是根据近日的科学研究结果,反转来了,乳酸菌并不总是有益的。对于胰腺导管腺癌(PDAC)患者而言,乳酸菌可能是有害的。
来自加拿大多伦多大学及其教学医院的Tracy L. McGaha教授团队在《细胞》旗下的《免疫》上发表重要研究成果[1]。
他们发现乳酸菌会通过代谢食物中的色氨酸,产生吲哚,激活肿瘤相关巨噬细胞(TAM)上的芳香烃受体(AhR),抑制肿瘤内浸润的CD8+T细胞释放干扰素杀伤肿瘤细胞,从而促进PDAC的生长。
这项研究意味着,胰腺导管腺癌患者可能应该限制乳酸菌或高色氨酸食物的摄入量。此外,这项研究成果为更个性化的胰腺癌治疗提供了新的方向,或许在不久的将来能通过膳食调节或者有效的抑制剂就能改善胰腺癌病人的生存情况。

论文首页截图
我们知道,胰腺癌临床症状隐匿,是诊断和治疗都很困难的消化系统恶性肿瘤,素来被称为“癌症之王”。胰腺导管腺癌作为最常见的一类胰腺癌,占比高达九成,侵袭性强,预后差。
而且导管腺癌对传统放化疗及靶向药物均不敏感,就连已在多种实体瘤治疗中取得突破进展的免疫检查点抑制疗法,在导管腺癌的临床实践中也是效果欠佳。
直到科学家在导管腺癌长期幸存者的肠道中发现微生物群落多样性增加,研究人员猜测这些改变的微生物菌群或许与肿瘤微环境中免疫细胞的生存和功能相关。
此外通过粪便菌群移植实验,科学家发现将来自于长期幸存者的粪菌移植到荷瘤小鼠体内,一段时间后小鼠肿瘤明显变小。反之,移植短期幸存者的粪菌则会大大增加肿瘤中CD4+Foxp3+调节性T细胞的数量,帮助肿瘤细胞免疫逃逸,促进肿瘤生长[2]。
以上种种证据表明肠道菌群会影响导管腺癌的进展,并影响肿瘤微环境中免疫细胞的组成和功能。但是,肠道里的菌群是怎么影响到胰腺肿瘤的进展的呢?
一种免疫学上重要的细菌代谢物——吲哚,跃入了科学家的视线。
由必需氨基酸色氨酸代谢而来的吲哚对黏膜屏障的完整性至关重要,它还可通过激活转录调节因子AhR,调控T细胞、树突状细胞和巨噬细胞的功能,来抑制炎症[3]。
巨噬细胞是PDAC免疫浸润的主要组成部分,为肿瘤生长提供基质支持[4]。而且重要的是,与其他细胞类型相比,AhR在髓系细胞中的表达更高[5],这提示着或许髓系细胞具有对AhR配体更高的敏感性。
基于当前这些发现,McGaha团队猜测,微生物群或许可以通过诱导TAM中的AhR活性,来驱动PDAC肿瘤微环境中的免疫抑制?
为了测试这一猜想,McGaha团队在TAM中敲除AhR基因或从药理学上抑制AhR活性后,发现PDAC模型小鼠的肿瘤变小,存活时间明显延长。而且AhR抑制剂CH223191与PD-L1抑制剂联用能够有效改善小鼠的生存状况。
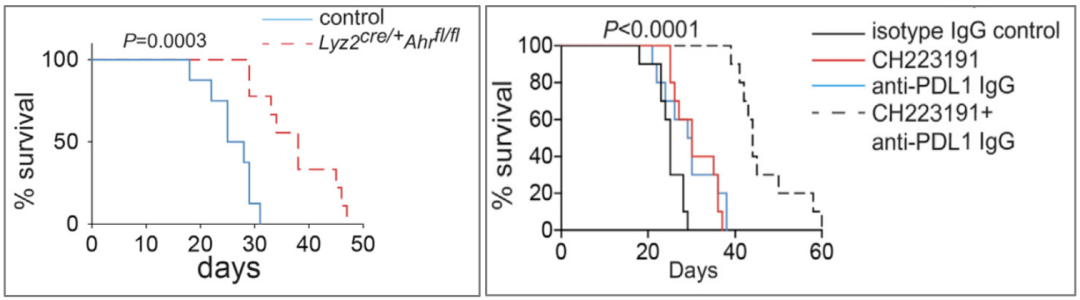
TAM中敲除AhR基因(左)或从药理学上抑制AhR活性(右)有效改善小鼠的生存状况
此外,AhR功能缺失后,TAM上高表达炎性基因和免疫激活相关的基因(IL-1β、MHCII、CD40等)。同时在TAM绝对数量不变的情况下,在肿瘤浸润免疫细胞中的比例却大大降低了,说明肿瘤里浸润的其它免疫细胞增加了,比如T细胞。
流式检测发现,无论从浸润比例或绝对数量上来说,CD8+T细胞确实增加了。并且增加的T细胞主要为CD62LnegCD44hi的效应型或记忆型,高表达干扰素(IFN-γ)和颗粒酶(GZMB)。
质谱流式和单细胞测序结果也进一步验证了AhR会调控肿瘤浸润免疫细胞的基因表达谱,使TAM和T细胞高表达干扰素应答相关基因。当去除CD8+T细胞或使用抗体阻断IFN-γ后,TAM中敲除AhR的抗肿瘤效果竟然消失了,说明敲除AhR的TAM自身免疫功能被激活后,又次级调控了T细胞的功能,促使其释放更多的IFN-γ杀伤肿瘤。
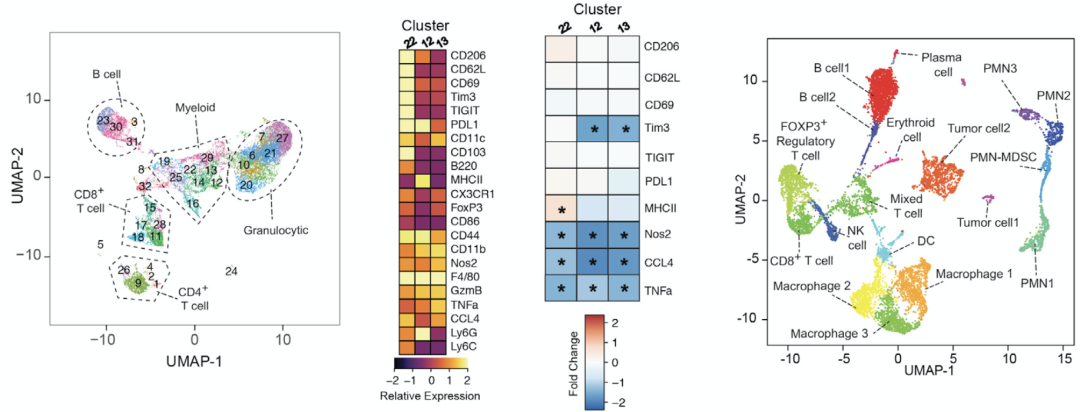
质谱流式和单细胞测序结果显示AhR调控肿瘤浸润免疫细胞的基因表达谱
那么在肿瘤微环境中是什么物质激活了AhR,阻断了TAM调控T细胞释放IFN-γ杀伤肿瘤的呢?
考虑到乳酸菌代谢色氨酸生成的吲哚是AhR的配体,McGaha团队分别用乳酸菌不耐受的氨苄青霉素(Amp)和耐受的万古霉素(Vanc)治疗肿瘤,结果显示使用Amp抑制乳酸菌之后,能够有效的提高TAM中PD-L1和MHCII的表达,吸引更多IFN-γ+TNF-α+CD8+T细胞浸润,提高免疫应答效果,抑制肿瘤生长。
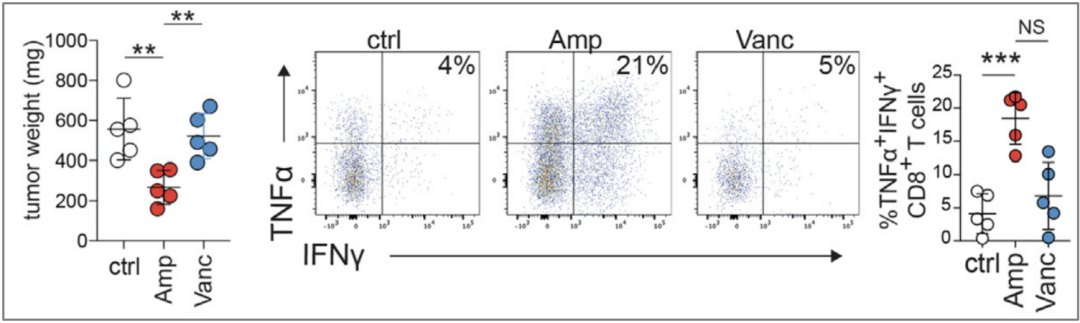
Amp有效抑制肿瘤生长,吸引更多IFN-γ+TNF-α+CD8+T细胞浸润
通过16S核糖体测序分析经抗生素处理的肿瘤小鼠的粪菌,McGaha团队发现,Amp处理提高了粪便微生物的多样性,同时降低了乳酸菌的相对丰度;Vanc处理则正与之相反。继续分析粪菌中乳酸菌的种类,McGaha团队发现Vanc处理后,粪菌中乳酸菌占比最丰富的一类为鼠乳杆菌(L. murinus),而且它可以产生吲哚。
于是,研究人员尝试在无菌小鼠肠道中移植可以产生吲哚的L. murinus和不可产生吲哚的其它类粪菌,监测其对胰腺癌生长的影响,结果显示可产生吲哚的L. murinus才能促进Arg1,Ido1,IL-10等促癌基因的表达,减少CD8+T细胞的浸润,增加髓源抑制性细胞(MDSC)的浸润,抑制肿瘤免疫,促进肿瘤生长。由此可见,吲哚在肿瘤发展中发挥着关键作用。
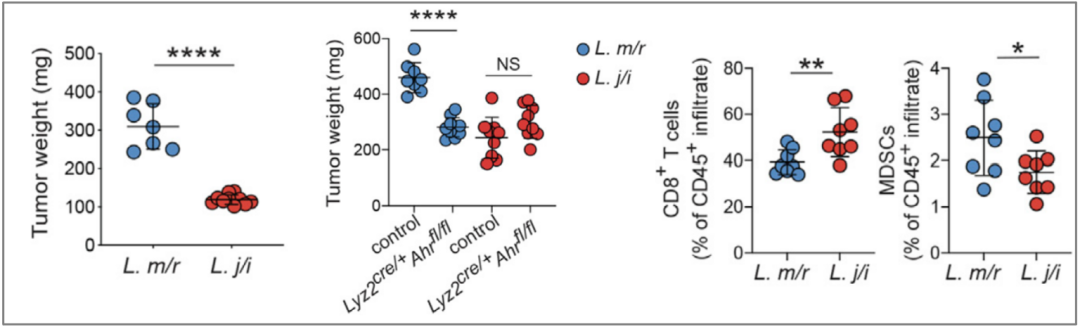
可产生吲哚的L. murinus才能促进肿瘤生长,减少CD8+T细胞的浸润,增加MDSC的浸润
既然吲哚是乳酸菌通过代谢色氨酸产生的,而色氨酸是通过食物获取的,那么饮食的改变是否会影响胰腺癌的进展?
通过给小鼠喂食缺乏色氨酸的饲料,McGaha团队发现饮食中缺乏色氨酸的小鼠,肿瘤重量仅是对照组的一半,而补充吲哚之后又能显著的增加肿瘤重量。而且免疫因子和促癌基因的表达情况,也会随饮食的改变而发生相应的变化。
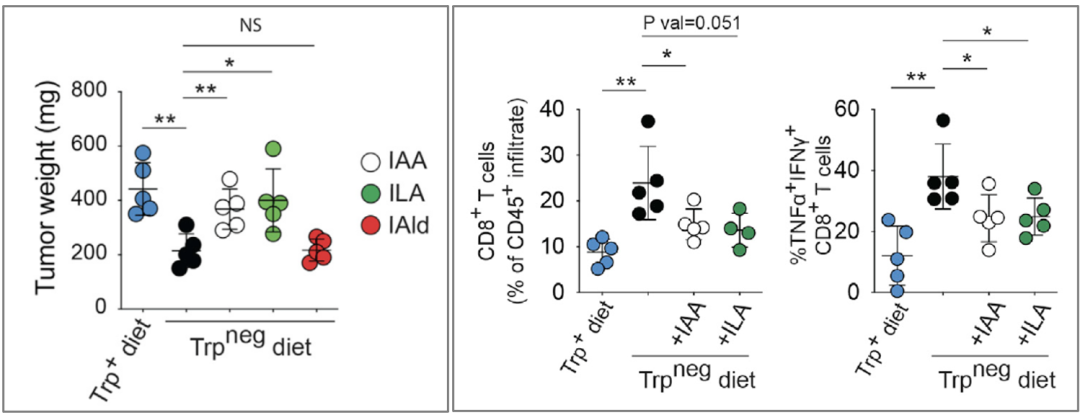
饮食中缺乏色氨酸的小鼠肿瘤显著变小(左),杀伤性T细胞浸润明显增多(右),补充吲哚后可逆转食疗效果
最后,通过分析肿瘤病人单细胞测序结果,McGaha团队进一步确定了AhR活性与病人存活情况的负相关性。人源的胰腺癌细胞实验也验证了AhR对胰腺癌细胞生长的促进作用。
McGaha团队的发现无疑是让人兴奋的,采用无痛无创的食疗来改善癌症病人的存活情况,自然是我们喜闻乐见的。与此同时,我们也需要一些思考。
色氨酸作为人体必需氨基酸,除了被代谢为吲哚激活AhR外,还有其它重要功能。比如,色氨酸作为神经递质(血清素)和神经调节剂(色胺)的合成原料,那么缺乏是否会引起神经系统障碍?
此外由色氨酸代谢来的吲哚除了激活AhR受体外,还可诱导肠内分泌L细胞释放胰高血糖素样肽,促进胰岛素分泌、减缓胃排空[6],色氨酸缺乏如何平衡在这方面的影响?

另外,尽管McGaha团队表明AhR的药物抑制可以改善小鼠肿瘤治疗,但是在哺乳动物中,色氨酸代谢并非是调节AhR功能的关键途径[7]。而且由于癌症病人的异质性,不同程度的肿瘤免疫浸润和微生物类群的组成等原因,抑制AhR在癌症中的应用是否存在局限性?
不过,一项针对AhR的首次人类临床试验已经在晚期肺癌、结直肠癌和尿路上皮癌患者中启动(标识号:NTC04069026),这项试验将提供一个关于AhR是否是癌症治疗的合法靶点的决定性测试。
就让我们拭目以待吧。
参考文献:
[1]Hezaveh, K., Shinde,R.S., Klo¨ tgen, A., Halaby,M.J., Lamorte, S., Ciudad, M.T.,et.al. (2022). Tryptophan-derived microbial metabolites activate the aryl hydrocarbon receptor in tumor-associated macrophages to suppress anti-tumor immunity. Immunity 55, 324–340
[2]Riquelme, E., Zhang, Y., Zhang, L., Montiel, M., Zoltan, M., Dong, W., Quesada, P., Sahin, I., Chandra, V., San Lucas, A., et al. (2019). Tumor microbiome diversity and composition influence pancreatic cancer outcomes. Cell. 178, 795–806.e12.
[3]Monteleone, I., Rizzo, A., Sarra, M., Sica, G., Sileri, P., Biancone, L., MacDonald, T.T., Pallone, F., and Monteleone, G. (2011). Aryl hydrocarbon receptor-induced signals up-regulate IL-22 production and inhibit inflammation in the gastrointestinal tract. Gastroenterology 141, 237–248. 248.e1.
[4]DeNardo, D.G., and Ruffell, B. (2019). Macrophages as regulators of tumour immunity and immunotherapy. Nat. Rev. Immunol. 19, 369–382.
[5]Shinde, R., and McGaha, T.L. (2018). The aryl hydrocarbon receptor: connecting immunity to the microenvironment. Trends Immunol. 39, 1005–1020.
[6] Roager, H.M., and Licht, T.R., (2018). Microbial tryptophan catabolites in health and disease. Nature Communications. 9, 3294
[7]Flaveny, C.A., and Perdew, G.H. (2009). Transgenic humanized AHR mouse reveals differences between human and mouse AHR ligand selectivity. Mol. Cell. Pharmacol. 1, 119–123.


