EMA建议对辉瑞的Paxlovid进行有条件授权
时间:2022-02-03 21:20:06 热度:37.1℃ 作者:网络
欧洲药品管理局 (EMA) 近日表示,其人用药品委员会 (CHMP) 建议对辉瑞公司的 Paxlovid 进行有条件的营销授权,建议批准该口服抗病毒药物用于治疗不需要补充氧气但有更大风险发展为严重疾病的 COVID-19 成年患者。
CHMP 研究了 II/III 期 EPIC-HR 试验的数据,该试验涉及约 2080 名未住院的 COVID-19 患者,这些患者至少有一种潜在疾病使他们面临重症风险。研究中的患者分为接受 Paxlovid 的患者和接受安慰剂的患者,这些患者在症状出现后五天内给予治疗药物。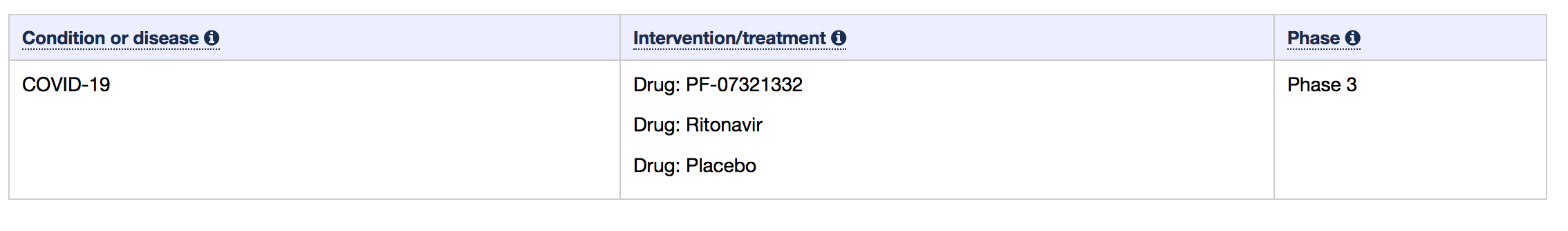
图1.EPIC-HR 试验的研究设计
辉瑞上个月报告的试验结果显示,与安慰剂相比,Paxlovid 在症状出现后三天内服用可将住院或死亡风险降低 89%,在五天内服用可降低 88%。
CHMP 对数据的审查发现,在治疗后的一个月内,Paxlovid 组中 0.8% 的患者住院时间超过 24 小时,而安慰剂组为 6.3%。此外,服用辉瑞药物的患者没有死亡,而安慰剂组中有 9 人死亡。EMA 指出,该研究中的大多数患者都感染了 SARS-CoV-2 病毒的 Delta 变体,但实验室研究表明 Paxlovid 也应该对 Omicron 和其他变体具有活性。
与此同时,EMA 审查得出的结论是,Paxlovid 具有良好的安全性,引起的副作用通常是轻微的。
本月早些时候,辉瑞表示将在未来五年内在法国投资 5.2 亿欧元(5.79 亿美元),包括增加 Paxlovid 的生产设施。
口服抗病毒药物 Paxlovid 目前已在包括美国和英国在内的 10 多个国家获得批准或授权紧急使用。意大利、德国和比利时是少数几个购买了这种药物的欧盟国家之一。
原始出处:
https://firstwordpharma.com/story/5488301


