Redox Biology:血小板表面Ero1α/PDI电子传递系统调控血小板聚集的分子机制
时间:2022-01-30 22:18:31 热度:37.1℃ 作者:网络
血小板是数量第二多的血液成分,其主要生理功能是感受血管的损伤,在伤口处粘附并聚集,封堵伤口并阻止血液的流失。但是,血小板的过量和异常活化会导致严重的心血管疾病,包括心肌梗死、中风等。心血管疾病在全球范围内均是人口死亡的最主要原因。因此,阐明血小板活化和血栓形成机制具有重要的临床意义和社会价值。近年来的研究显示,蛋白质二硫键异构酶(Protein disulfide isomerase, PDI)在血小板活化和血栓形成过程中发挥关键调控作用。临床实验表明,PDI可以作为新的抗血栓药物的靶点。
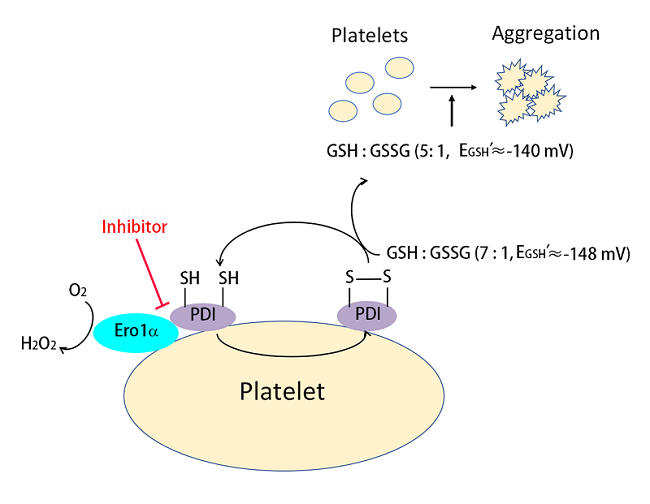
图:血小板表面Ero1α/PDI电子传递系统调控血小板聚集的分子机制
PDI是内质网中催化新生肽链合成过程中二硫键正确形成的关键分子。内质网氧化酶Ero1α和PDI组成内质网中最主要的蛋白质氧化折叠通路。PDI的活性中心的半胱氨酸残基可分别以氧化态(S-S)或还原态(-SH)形式存在。PDI以何种氧化还原状态调控血小板活化尚不清楚。此外,Ero1α和PDI是否可以在血小板表面组成电子传递系统,从而调控血小板功能也是本领域亟待解决的问题。
2022年1月20日,中国科学院生物物理研究所王志珍/王磊课题组在《Redox Biology》发表题为"The extracellular Ero1α/PDI electron transport system regulates platelet function by increasing glutathione reduction potential"的文章,首次揭示了血小板表面存在Ero1α/PDI电子传递系统,并阐明了其调控血小板聚集的分子机制。
研究人员发现氧化态而非还原态PDI能促进血小板整合素αIIbβ3介导的血小板聚集和粘附。Ero1α和还原态PDI共同作用可以增强血小板聚集,说明Ero1α可以氧化PDI来调控血小板聚集。Ero1α小分子抑制剂能够抑制血小板内源的Ero1α特异性氧化PDI,而不影响其它蛋白质的氧化还原状态。血小板表面的Ero1α/PDI系统进一步氧化还原型谷胱甘肽(GSH)生成氧化型谷胱甘肽(GSSG),从而建立起一个适合血小板聚集的最佳GSH/GSSG电势。进一步研究发现,芦丁(rutin)等小分子抑制剂正是通过阻断Ero1α/PDI电子传递系统起到抑制血小板聚集的作用,提示靶向血小板表面的Ero1α/PDI系统可以作为抗血小板和抗血栓药物的新靶点。该项研究成果已经申请了中国发明专利。
中国科学院生物物理研究所王磊研究员和王璐博士(特别研究助理)为论文的共同通讯作者,王璐为论文第一作者。该研究得到国家自然科学基金、国家重点研发计划、中国科学院战略性先导科技专项、中国科学院青年创新促进会和中国博士后科学基金的资助。
文章链接:
https://www.sciencedirect.com/science/article/pii/S2213231722000167?via%3Dihub


