如何解析新冠核酸检测中的异常扩增曲线?
时间:2022-01-30 16:19:05 热度:37.1℃ 作者:网络
实时荧光定量PCR技术是目前检测新型冠状病毒核酸的主要方法,该技术是通过监测PCR反应过程中所加入荧光基团的荧光信号,利用已知浓度的标准品绘制标准曲线,对未知样品进行定量分析的一种核酸定量技术。在 PCR 反应体系中加入荧光基团,利用荧光信号积累实时监测整个 PCR 进程,使每一个循环变得“可见”,最后通过循环阈值( Cycle threshold,Ct) 和标准曲线的关系对起始模板进行定量分析。
PCR扩增过程中,每一轮循环均检测一次荧光信号的强度。随着反应循环次数的不断增加,所扩增的目的基因片段呈指数规律增长,反应中产生的荧光信号强度与PCR产物的数量呈正比。仪器实时检测和采集的荧光信号,随着时间和循环数的不断增加,产生一条反映实时荧光信号强度变化的曲线,称为扩增曲线。扩增曲线以循环数为横坐标,荧光强度为纵坐标。
样本扩增曲线是反应PCR进程的镜子,我们可以通过观察扩增曲线来评估PCR扩增效率,分析实验是否顺利进行。扩增曲线的正常与否,反映出实验中存在的诸多因素和问题,对新冠核酸检测结果判读至关重要。
一、 正常状态扩增曲线
正常PCR扩增曲线呈“S”型,分为基线期、指数期、平台期。扩增曲线良好的指标是曲线拐点清楚,扩增曲线整体平行性好,基线平而无上扬现象。
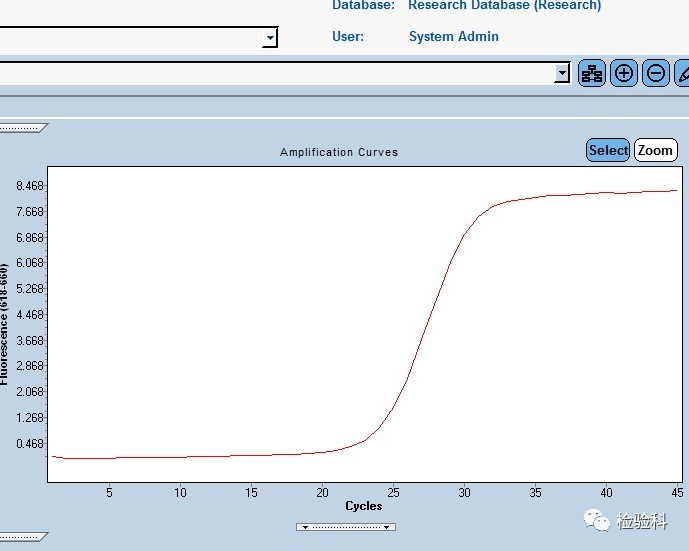
理论上,PCR每个循环后扩增产物量即增加一倍,扩增曲线应表现为荧光值随着循环数增加而不断上升,而实际上扩增曲线的荧光值并不会随着循环数的增加而无限上升。这是由于PCR扩增进行到一定阶段,反应体系中的原料发生消耗和变性,如dNTP和酶等原料相对于模板大大减少,同时酶活性逐渐达到饱和;引物二聚体和反应亚产物(如焦磷酸)的产生也会抑制扩增反应;引物和已扩增的DNA片段间的竞争等,都会导致PCR的扩增效率逐步降低,直至为0。因此,扩增曲线表现为扩增到一定的循环数后,荧光值不再随着循环数发生变化,而是保持平坦,出现平台期。
二、 异常状态扩增曲线
1.扩增曲线抬升,与阈值线相交产生了CT值
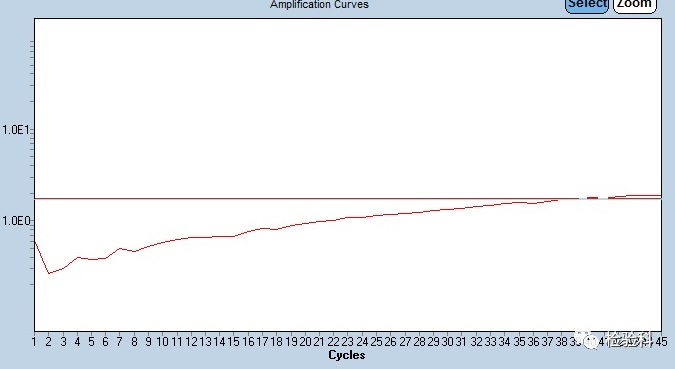
原因分析:
(1)软件在进行基线自动扣除的时候出现错误,引起了扩增曲线抬升。
(2)选用的耗材、试剂或者操作的原因导致背景荧光信号有所波动,造成反应孔的自动基线扣除错误。
(3)探针浓度过高,体系中有荧光物质污染,扩增效率低。
解决方案:
(1)采取手动调整基线的方法,重新定义基线即可正常(即将基线起点改为荧光信号稳定的循环数,基线终点设置成扩增曲线起峰的前一个循环数)。
(2)重新提取样本、重新配置试剂(可采用不同厂家试剂检测),注意人员操作。
(3)稀释模板重新扩增。
2.扩增曲线不平整,有向上或者向下的尖峰
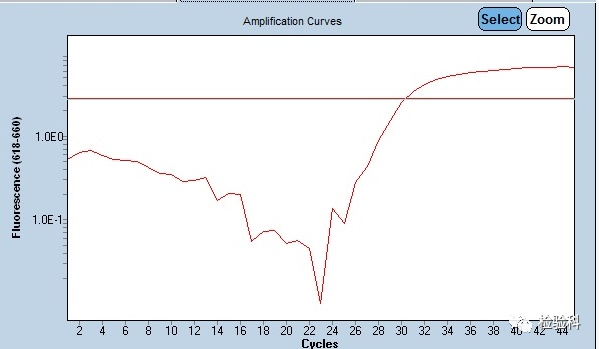
原因分析:
(1)仪器不稳定导致的扩增曲线异常(也可能突然停电或者电压不稳)。
(2)尖峰向下,可能是卤素灯老化所致发射光源不稳定(指卤钨灯光源的激发器)。
(3)尖峰向上,考虑仪器或者孔位问题,还要考虑反应体系是否存有气泡。
解决方案:
(1)检查仪器性能,检查实验室电压情况。
(2)定期仪器保养维修,避免配件老化问题出现。
(3)检查问题孔位,排除孔位问题。
(4)配制反应体系,分装避免产生大量气泡。模板加完,微孔板离心再扩增。
3.扩增曲线末尾起跳
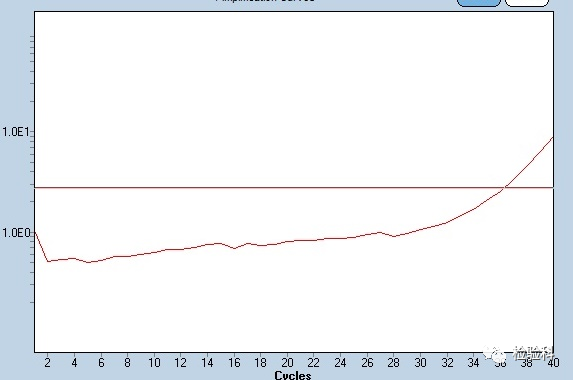
原因分析:
(1)阴性对照曲线末尾起跳,表示存在交叉污染。
(2)复检样本,排除非特异性扩增的可能性。
(3)正常样本曲线末尾起跳,怀疑模板存在交叉污染;或者样本浓度低、加样量不准确导致扩增效率低。
(4)所用的试剂设计不合理,或存在交叉污染, 或操作环境中有气溶胶造成污染。
解决方案:
(1)检查阴性对照,是否存在污染。
(2)复检样本,如果复检后曲线为阴性直线则说明之前的末尾起跳为非特异性扩增,如果复检后曲线与之前一末尾起跳表示该样本中待检病毒核酸的浓度偏低。
(3)更换试剂,建议使用不同厂家试剂比对。
(4)对操作环境进行处理, 或更换新的环境、加样器、枪头以及所有的引物、试剂等。
4.扩增曲线分布混乱
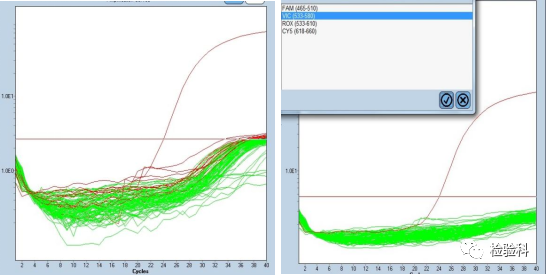
原因分析:
荧光波长范围存在重叠,影响PCR检测通路采集荧光信号。
解决方案:
进行荧光补偿,再分析可正常。
5.扩增曲线扩增不完整
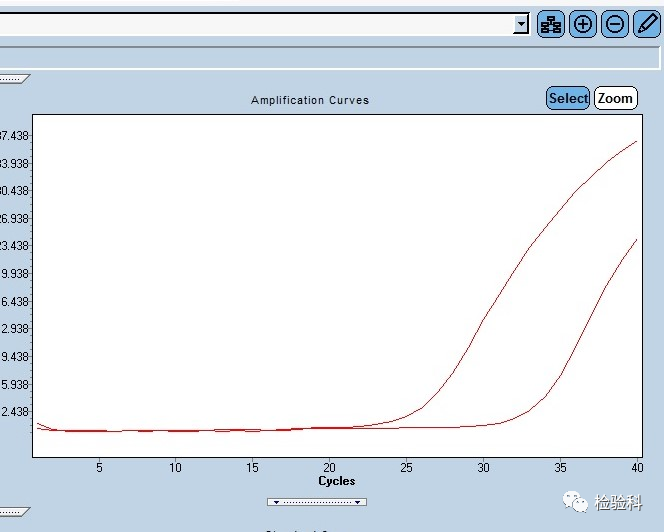
原因分析:
(1)模板污染导致降解,或者样本浓度低、加样量不准确导致扩增效率低。
(2)模板浓度太高,或者存在抑制成分。
(3)荧光染料浓度低,或者仪器问题荧光收集异常。
(4)Taq酶无活性或活性降低。
(5)试剂配制没充分混匀,分装不均匀。
解决方案:
(1)重新提取样本,排除提取效率变低,加样量不足因素。
(2)稀释模板,重新扩增。
(3)检查试剂,更换新试剂,双试剂检测。
(4)试剂配制充分混匀,分装准确。
(5)检查仪器。
6.扩增曲线压低
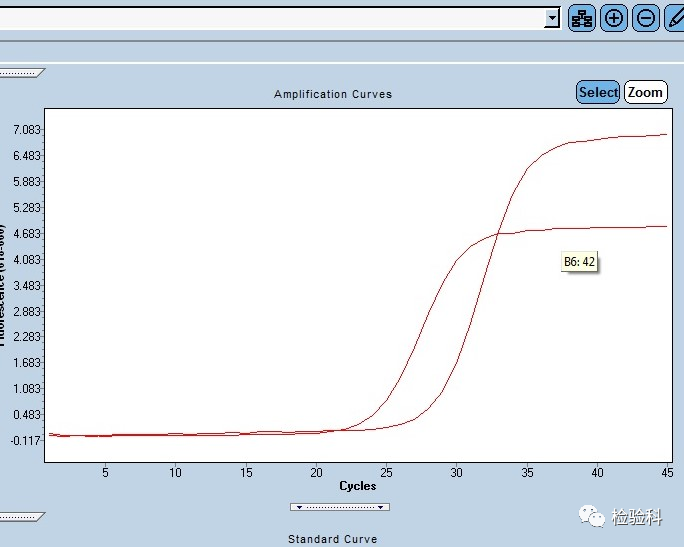
原因分析:
(1)模板浓度太高。
(2)试剂问题,限制PCR反应速率和性能。
解决方案:
(1)稀释模板,重新扩增。
(2)检查试剂,更换新试剂,双试剂检测。
7.扩增曲线前边下降,后边正常
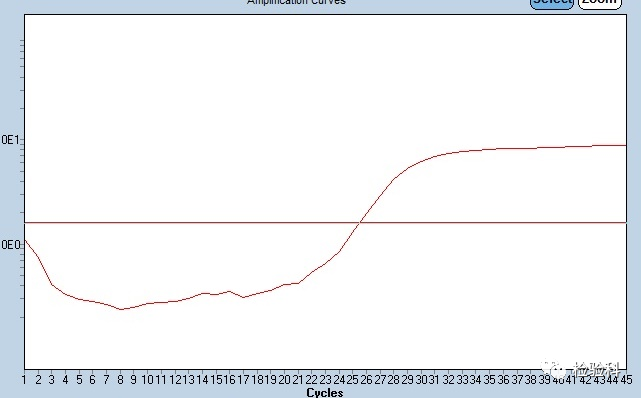
原因分析:
(1)PCR前期过程中,试剂和模板没有得到充分的混匀,导致信号的不稳定,反应几个循环之后,模板和反应液开始混匀,荧光信号就变得稳定。
8.内参基因扩增曲线未起
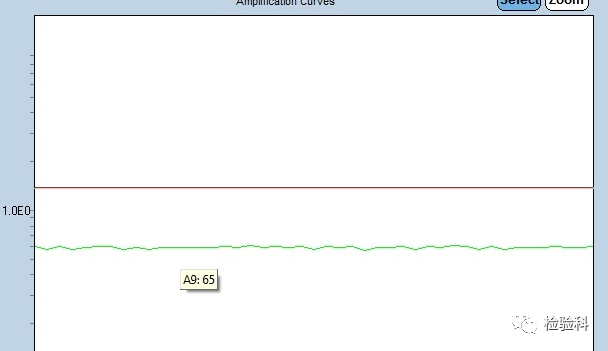
原因分析:
(1)试剂配制没充分混匀,分装不均匀,有效成分低。
(2)模板提取失败,或者污染降解。
(3)采样不准,没有样本。
解决方案:
(1)检查试剂,更换新试剂,双试剂检测。试剂配制充分混匀,分装准确。
(2)重新提取样本。
(3)重新采样检测。
9.标准曲线异常,线性关系不佳R2<0.9(下图为正常曲线)
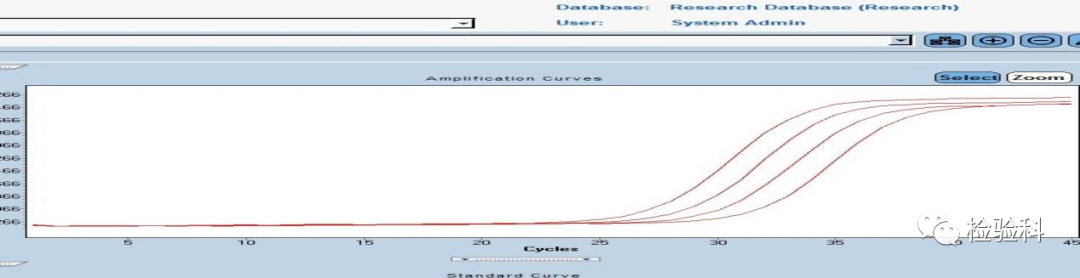
原因分析:
(1)标准品加样误差,标准品出现降解。
(2)模板中存在抑制物。
(3)试剂缺陷,引物或探针不佳,重新设计。
解决方案:
(1)充分混匀标准品。
(2)使用新的标准品。
(3)检查耗材,更换试剂,避免环境存在抑制物。
10.扩增曲线变形
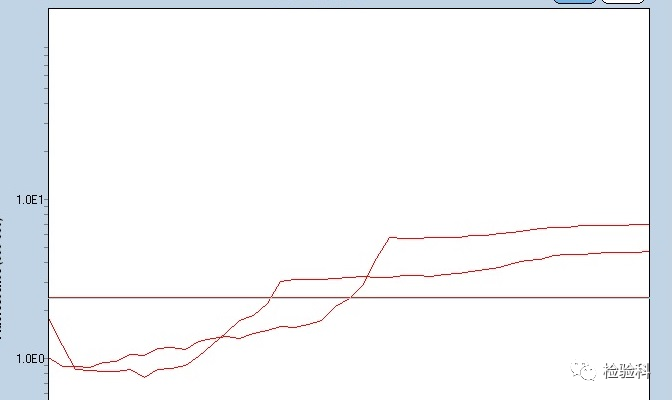
原因分析:
(1)PCR反应板封膜不严或质量不好,在PCR过程中受到水蒸气的影响。
(2)反应体系或模板存在抑制物。
解决方案:
(1)PCR反应板封膜压实,选择配套耗材,有瑕疵的及时更换。
(2)重新提取,重新配制试剂在检测。
(3)复检样本。
11.扩增曲线不平,与基线相切

原因分析:
(1)10个循环左右开始有抬高趋势,一般前15个循环的荧光信号作为荧光本底信号,此时反应体系和模板处于不稳定状态。
(2)基线自动扣除的时候出现错误,引起了扩增曲线抬升。
(3)反应体系不均一,干扰荧光信号采集。
12.扩增曲线先抬高再降低 (参考图)
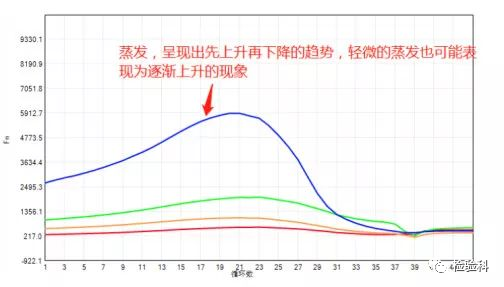
原因分析:
严重的蒸发会呈现先上升后下降的曲线,轻微的蒸发会是一种缓慢的上升,这类异常曲线可检查检测后的反应管液面是否有下降的现象来证明。
解决方案:
上机检测前检查96微孔板封膜完好,保证无缝隙后上机扩增。
三、 总结
综上所述,在新型冠状病毒核酸检测PCR实验过程中,许多方面的因素都可干扰PCR扩增曲线,影响新型冠状病毒核酸检测结果的判读。当我们遇到扩增曲线异常的情况,需要我们正确解读分析这些异常曲线,找出存在的问题及合理的解决方案,为患者出具准确的新型冠状病毒核酸检测的结果报告。


