补个身还顺便把血糖血脂降了肝护了?秘密武器就藏在西洋参里!
时间:2022-01-05 08:11:08 热度:37.1℃ 作者:网络
糖尿病(DM)是一种普遍的慢性代谢性疾病,也是全球公共卫生问题,其中T2DM已成为公共卫生的主要威胁,因为90-95%的糖尿病患者患有T2DM。其主要特征是胰岛素分泌不足和/或进行性胰岛素抵抗。根据国际糖尿病联合会(IDF)的数据,2019年全球糖尿病患者人数为4.63亿,预计到2045年将增加到7亿。关于T2DM治疗,已有一系列抗糖尿病药物,包括盐酸二甲双胍、磺脲类、葡萄糖苷酶抑制剂、噻唑烷二酮等。然而长期使用这些化学合成药物可能会导致一些副作用,如水肿,体重增加,恶心和潜在的腹泻。因此,为T2DM患者找到具有抗糖尿病活性的、有效的、安全的、负担得起的天然物质至关重要。
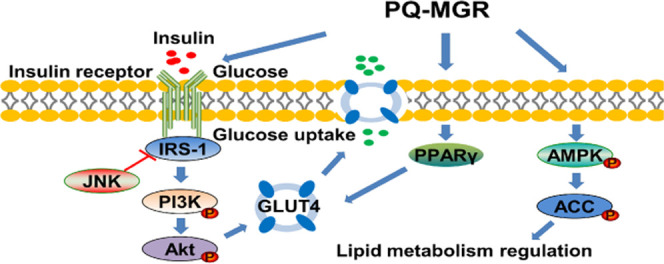
胰岛素抵抗(IR)是2型糖尿病发展的驱动因素。胰岛素受体底物-1/磷酸肌醇3-激酶/蛋白激酶B(IRS1/PI3K/Akt)信号通路,在胰岛素信号转导中起重要作用。此外,JNKs介导IRS1的丝氨酸磷酸化,导致IRS1酪氨酸磷酸化缺陷和磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号传导响应于胰岛素受体激活,从而导致胰岛素抵抗。AMP活化蛋白激酶(AMPK)是代谢紊乱的关键靶标之一。乙酰辅酶A羧化酶(ACC)是参与脂肪酸合成的限速酶,是AMPK信号通路的基本下游效应器。AMPK的活化可以刺激ACC磷酸化的增加。因此,调节IRS-1 / PI3K / Akt和AMPK / ACC信号通路可被视为治疗T2DM的有效治疗策略。
药理学研究表明,西洋参(Panax quinquefolius L.)具有多种药理特性,如抗糖尿病、抗氧化、抗炎、抗肿瘤作用等,已被广泛用于草药和保健食品,是世界上最畅销的草药之一。西洋参的主要生物活性成分是人参皂苷,包括中性人参皂苷(例如,Rb1, Rb2, Rc, Rd, Rg3, Rh2和 C-K)和丙二酰人参皂苷(例如,m-Rb1、 m-Rb2, m-rc, m-rd, m-Rg1和 m-Re)。一系列实验研究表明,西洋参性中性人参皂苷具有显着的抗糖尿病作用,被认为是负责西洋参抗糖尿病活性的主要化学成分。例如,人参皂苷Rb1据报道,可降低空腹血糖 (FBG) 水平和甘油三酯积累,改善胰岛素和瘦素敏感性。人参皂苷 Rb2能明显改善葡萄糖代谢,抑制糖异生和肝脂积累等。

而丙二酰人参皂苷(MGR)是天然的人参皂苷,存在于新鲜和风干的西洋参中。先前发表的研究表明,PQ-MGR的含量占皂苷总量的50%以上。然而,丙二酰人参皂苷不容易分离,鉴定或检测,因此缺乏丙二酰人参皂苷的化学和药理学研究。本研究将首次报道PQ-MGR的降血糖和降血脂作用,并首次探索其在高脂饮食/链脲佐菌素(HFD/STZ)诱导的小鼠糖尿病条件下的潜在机制。

用HPLC-ESI-MS/MS分析化学成分,在PQ-MGR中鉴定出14种丙二酰人参皂苷。

采用高效液相色谱(HPLC)法检测PQ-MGR提取物中丙二酰人参皂苷的含量m-Rb1的含量约占丙二酰基人参皂苷总量的77.4%。因此,m-Rb1是PQ-MGR提取物中最丰富的丙二酰人参皂苷。然而,中性人参皂苷的含量相对较低,并且根本没有被HPLC检测到。

1、PQ-MGR对体重、FBG、OGTT和血清胰岛素水平的影响
如图2A所示,糖尿病对照组小鼠体重明显低于正常对照组(p<0.05)。与糖尿病对照组相比,PQ-MGR治疗组小鼠体重增加。根据监测治疗期间体重和日常行为的监测变化,各组均未发现毒性反应。

PQ-MGR对葡萄糖代谢的影响以空腹血糖(FBG)水平为指标,每周在食物去除12 h后测定FBG水平。如图2B所示,与正常对照组小鼠相比,糖尿病小鼠在第0周出现显著的高血糖(p<0.001)。经300和100 mg/kg PQ-MGR治疗后,在第1 ~ 4周,300 mg/kg PQ-MGR治疗组的FBG水平显著低于糖尿病对照组,在第5周,FBG水平进一步降低了45.74%(p <0.001)。在用PQ-MGR 100mg / kg治疗的组中,FBG水平仅在第5周显着降低(p <0.05)。实验结果表明,PQ-MGR对T2DM小鼠有降血糖作用。
口服葡萄糖耐量试验(OGTT)结果及OGTT曲线下面积(OGTT- auc)如图2C,D所示。HFD/STZ诱导的糖尿病对照组的初始血糖水平显著高于正常对照组和PQ-MGR治疗组(p <0.001)。在葡萄糖给药后30分钟,所有小鼠的血糖水平都飙升。与30 min相比,100和300mg / kg PQ-MGR处理的小鼠在给药后120 min后显示出36.74%(p<0.05)和42.76%(p <0.01)的血糖水平降低。 此外,计算浓度曲线(AUC)下面积发现PQ-MGR治疗显示AUC值明显低于糖尿病对照组。本研究结果表明,PQ-MGR治疗可改善HFD / STZ诱导的T2DM小鼠的糖耐量和血糖稳态。
血清胰岛素水平和HOMA-IR指数的变化数据见图2E,F。与正常对照组相比,糖尿病对照组的胰岛素水平显着降低(p<0.01),HOMA-IR指数增加(p<0.01)。治疗5周后,PQ-MGR治疗组在所有选定剂量下的空腹胰岛素水平均有显著改善(p < 0.05)。PQ-MGR处理组的HOMA-IR指数也显着降低。这些结果表明,施用PQ-MGR可以改善胰岛素抵抗。
2、PQ-MGR对血脂水平的影响
如图3所示,与正常对照组相比,糖尿病模型组小鼠血清总胆固醇(TC)、甘油三酯(TG)、LDL-C和非酯化脂肪酸(NEFA)水平显著升高。PQ-MGR治疗组的TG、TC、LDL-C和NEFA水平显著低于糖尿病对照组,尤其是高剂量PQ-MGR治疗组。但PQ-MGR治疗组与糖尿病对照组HDL-C水平无变化。因此,这些结果表明PQ-MGR可能调节T2DM小鼠的脂质代谢。

3、PQ-MGR对肝损伤的影响
如图4A、B所示,HFD / STZ诱导的糖尿病小鼠产生严重的肝损伤,其特征在于血清天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)水平显著升高。连续治疗5周后,与糖尿病对照组相比,PQ-MGR治疗组的ALT和AST水平显着降低。这些结果表明PQ-MGR能有效修复T2DM小鼠的肝损伤。

SOD是一种清除自由基的重要抗氧化剂。如图4C所示,与正常对照组相比,糖尿病对照组血清SOD活性明显下降(p<0.01),提示脂质过氧化引起的肝损伤严重。PQ-MGR (300 mg/kg)处理后,与糖尿病对照组相比,血清SOD活性显着增加(p<0.05)。然而,PQ-MGR(100mg / kg)处理提高SOD活性,但差异不显著。
4、PQ-MGR对T2DM小鼠组织病理学的影响
肝内苏木精和伊红(H&E)染色如图5A所示。正常对照组小鼠肝脏呈有序的肝小叶结构,肝细胞丰富,细胞核清晰;糖尿病对照组小鼠肝脏呈脂肪变性和大泡细胞。口服PQ-MGR后,这些严重肝损伤均有明显改善。如图5B所示,正常对照组的胰岛呈圆形或椭圆形,边界清晰。相反,糖尿病对照组胰岛细胞受损、萎缩,呈不规则轮廓、空泡、炎症浸润等不典型细胞改变。治疗5周后,高剂量PQ-MGR对HFD/STZ诱导的糖尿病小鼠具有预防萎缩、结构损伤和胰岛丢失的作用。脂肪组织HE染色如图5C所示。T2DM小鼠脂肪组织的大小急剧增加,与正常对照组相比结构不清晰。相比之下,PQ-MGR处理组的细胞体积和结构变化明显减轻。此外,油红O染色显示PQ-MGR显着减小了肝内脂滴的大小和聚集(图5D)。

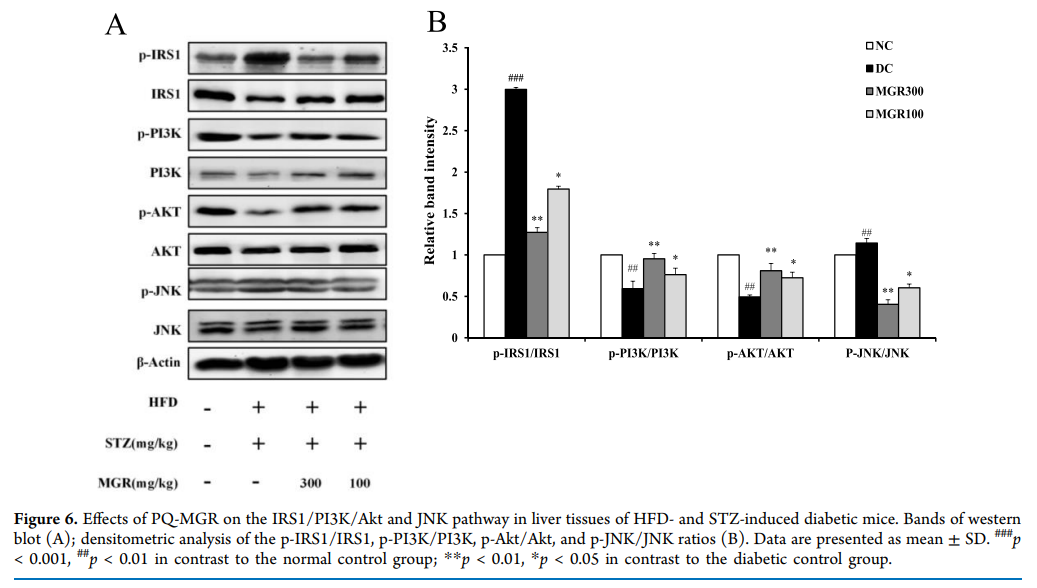
5、PQ-MGR对IRS1/PI3K/AKT和C-Jun N端激酶(JNK)信号通路的影响
为了进一步探讨PQ-MGR抗糖尿病作用的机制,采用western blotting检测肝脏中IRS1/PI3K/AKT和JNK信号通路的蛋白表达水平。如图6所示,与糖尿病对照组相比,PQ-MGR处理组PI3K Thr458和AKT ser473蛋白的磷酸化表达显著增加,而p-IRS1 Ser307和p-JNK Thr183/185的磷酸化表达显著降低。上述结果表明,PQ-MGR通过抑制JNK活性和激活IRS1 / PI3K / AKT信号通路来改善胰岛素抵抗。
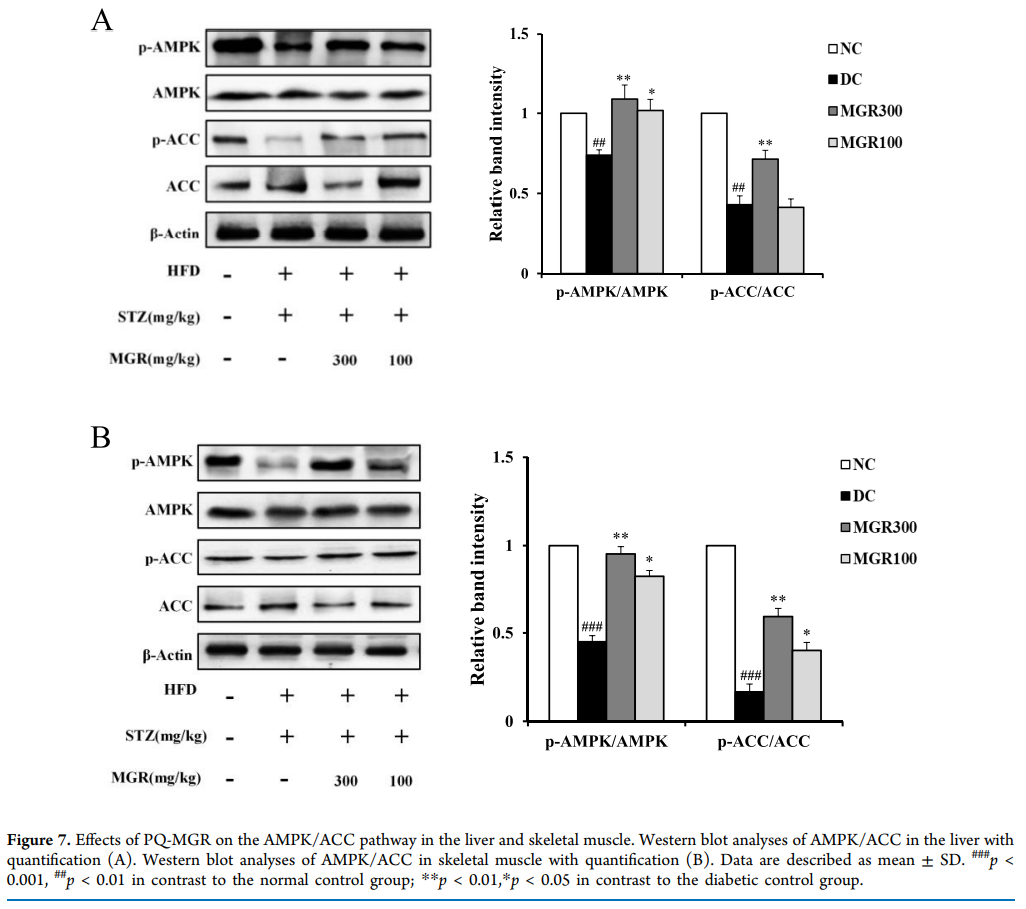
6、PQ-MGR对肝肌和骨骼肌AMPK/ACC通路的影响
AMPK 是前脂肪细胞分化和脂肪生成的关键调节因子。为了研究AMPK/ACC通路的调控是否与PQ-MGR的低脂血症效应有关,采用western blot方法检测肝脏和骨骼肌中AMPK/ACC信号通路的蛋白表达水平。结果,糖尿病对照组的磷酸化AMPK水平显着降低,而PQ-MGR处理组的磷酸化AMPK水平显着增强。此外,PQ-MGR增加了糖尿病对照组中磷酸化的ACC水平,而ACC是AMPK的下游底物(图7)。
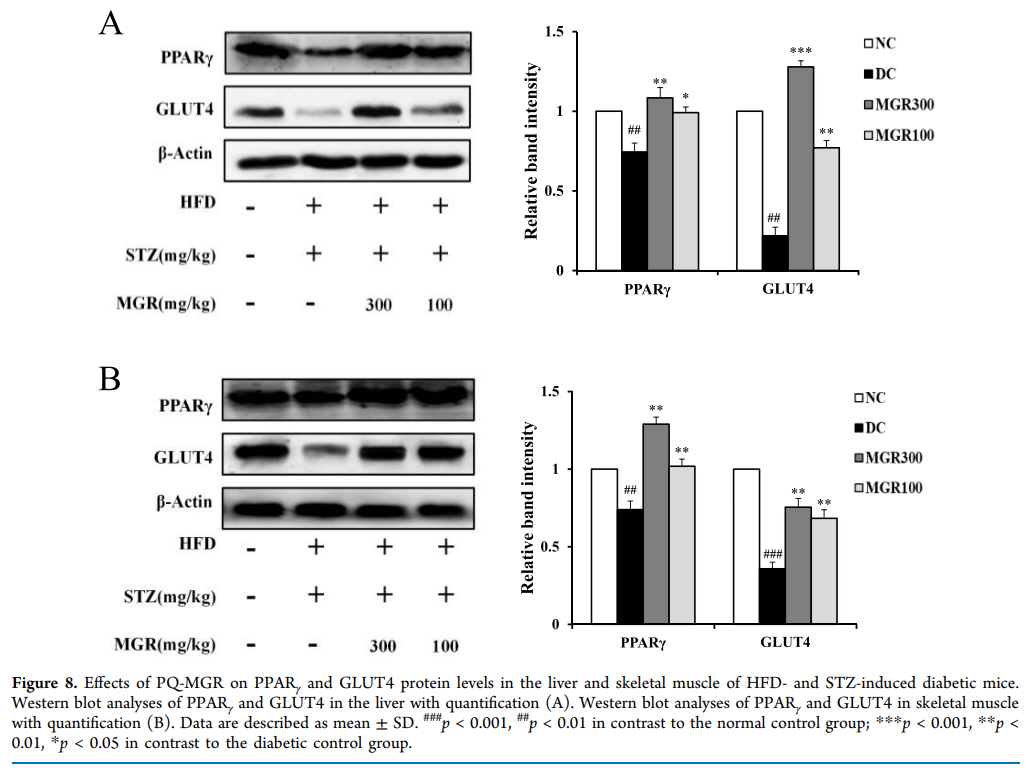
7、PQ-MGR对骨骼肌和肝脏GLUT4和PPARγ的影响
检测骨骼肌和肝脏中GLUT4和PPARγ蛋白的表达水平,见图8。与正常对照组相比,糖尿病对照组GLUT4和PPARγ表达水平显著降低。然而,经PQ-MGR处理后,糖尿病治疗组骨骼肌和肝脏中GLUT4和PPARγ蛋白表达显著增加。
综上,我们的研究结果表明,用PQ-MGR治疗可以显着降低HFD / STZ诱导的T2DM小鼠的空腹血糖和血清脂质水平,并改善胰岛素抵抗。进一步的机制研究表明,PQ-MGR的降糖作用可能与IRS1/PI3K/AKT和PPARγ/GLUT4信号通路有关。AMPK/ACC 信号通路的激活可能与 PQ-MGR 的降血脂活性有关。因此,我们认为PQ-MGR可以作为一种潜在的治疗T2DM的功能性食品。
原文来源:
Zhi Liu, et al. Hypoglycemic and Hypolipidemic Effects of Malonyl Ginsenosides from American Ginseng (Panax quinquefolius L.) on Type 2 Diabetic Mice.
ACS Omega. 2021 Dec 14; 6(49): 33652–33664. Published online 2021 Dec 6. doi: 10.1021/acsomega.1c04656

