Nature Cancer:张华凤/高平合作揭示ENO1通过抑制铁死亡来促进肝癌的新机制
时间:2021-12-15 09:01:54 热度:37.1℃ 作者:网络
代谢异常是肿瘤的重要特征之一。近年来肿瘤代谢领域的快速发展极大地拓展了人们对代谢重编程和肿瘤发生发展的认知。关键的生理/病理过程,例如外界刺激、致癌信号等,通过调节代谢酶的经典功能满足细胞的代谢需求。这些代谢酶除了它们既定的作用外,还具有支持恶性转化的非经典功能(non-canonical function/moonlighting function)。深入了解代谢酶的非经典功能将拓宽人们对肿瘤代谢领域的理解,并揭示癌症治疗的新靶点。
近日,中国科学技术大学张华凤课题组和高平课题组(现华南理工大学)在 Nature Cancer 期刊在线发表了题为:ENO1 suppresses cancer cell ferroptosis by degrading the mRNA of iron regulatory protein 1 的研究论文。
该研究报道了ENO1作为RNA结合蛋白降解mRNA的机制,阐明了ENO1结合并降解铁调蛋白(Ironregulatoryprotein 1,IRP1)基因的mRNA,从而调控细胞内铁离子的代谢稳态,影响铁死亡而促进肝癌的发生发展,为治疗肝癌相关疾病提供了潜在的新靶点。

研究团队首先发现肝癌细胞中高表达的ENO1可以作为RNA结合蛋白(RNA binding protein,RBP)发挥作用,通过将ENO1调控的RNA-seq数据与发表的CLIP-Seq数据进行比对分析,并结合肝细胞肝癌(HCC)中相关基因的表达情况,研究团队将目光进一步锁定在铁调蛋白IRP1基因上。
进一步研究发现ENO1蛋白结合IRP1 mRNA,并通过招募RNA降解因子CNOT6促进IRP1 mRNA的降解,结合前人关于ENO1在原核生物中降解RNA的发现,研究结果揭示了ENO1功能在物种间的保守性。IRP1在线粒体铁代谢的稳态调控及肝脏生理功能中发挥重要作用,但是IRP1与线粒体之间的调控在肿瘤中的作用并不清楚。
进一步分析线粒体内铁代谢相关蛋白,研究团队发现负责将铁从细胞质运送到线粒体内的通道蛋白Mfrn1受到IRP1的显着上调。利用体外培养的肿瘤细胞以及敲除小鼠诱导的肝癌模型体系,作者进行了系列实验,进一步证明了IRP1和Mfrn1在肝癌中作为抑癌因子发挥作用。机制分析发现,ENO1通过1RP1和Mfrn1影响过氧化脂质的累积和铁死亡过程,从而影响肿瘤细胞增殖,揭示了肝癌细胞中ENO1/IRP1/Mfrn1调控轴与铁死亡之间的潜在联系。
临床病人样本分析表明,IRP1和Mfrn1在肝癌中呈低表达趋势,且IRP1和Mfrn1表达越低的病人其生存预后越不理想。
综上,该研究阐明了代谢酶ENO1结合并降解RNA的新功能,结合其在原核生物中降解RNA的前人发现,揭示了ENO1在RNA降解功能上的保守性;同时本研究解析了ENO1/IRP1/Mfrn1调控轴在肿瘤中的作用,揭示了肿瘤发病的新机制,为肝癌等相关疾病的治疗提供了潜在新靶点。
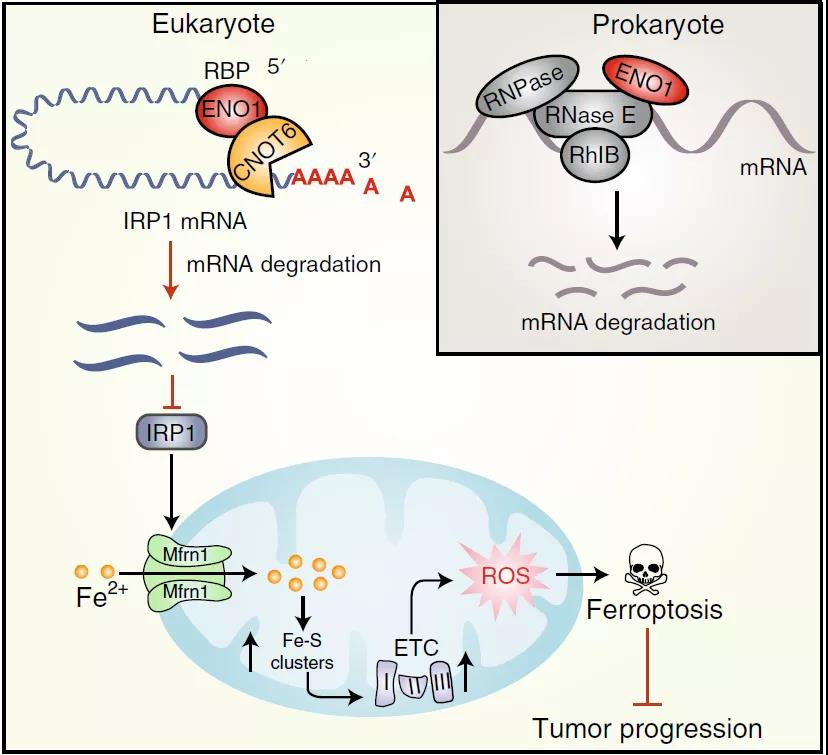
模式图:代谢酶ENO1通过发挥RNA结合功能抑制铁死亡而促进肝癌
中国科学技术大学的张通博士和华南理工大学的孙林冲副研究员为论文的共同第一作者,张华凤教授和高平教授为论文的共同通讯作者。研究工作得到了中国科学技术大学基础医学院周荣斌教授,地球和空间科学学院黄方教授,中国科大第一附属医院荚卫东教授以及安徽医科大学蔡永萍副教授的大力帮助,并得到了来自中科院、国家基金委、科技部、中国科学技术大学等部门的基金支持。
原始出处:
Zhang, T., Sun, L., Hao, Y. et al. ENO1 suppresses cancer cell ferroptosis by degrading the mRNA of iron regulatory protein 1. Nat Cancer (2021). https://doi.org/10.1038/s43018-021-00299-1.


