CSBJ:肠道微生物组特征可区分2型糖尿病和非酒精性脂肪肝
时间:2021-12-06 16:01:31 热度:37.1℃ 作者:网络

背景及目的:非酒精性脂肪性肝病(NAFLD)有明显的肝脏表现,从非酒精性脂肪肝到更严重的情况,包括非酒精性脂肪性肝炎(NASH)、晚期纤维化和肝硬化。由于病变范围很广,缺乏特定的药物治疗,而且需要组织学检查才能做出明确的诊断,因此人们试图利用遗传学、影像学、血清学和OMICS方法来确定治疗NAFLD的具体靶点。然而,有必要进一步评价用这种方法识别的潜在的非侵入性生物标志物。此外,合并症的存在使该病的特征进一步复杂化。例如,NAFLD与2型糖尿病(T2D)密切相关:T2D患者NAFLD的患病率很高(55%),NAFLD也是T2D的危险因素。此外,这种并发症的存在往往与较差的预后和较高的死亡率相关。新出现的证据表明,这两种代谢性疾病的特点是存在肠道微生物群的改变。以往关于这些条件及其与肠道微生物群关系的研究大多集中在非侵袭性的NAFLD微生物标志物的鉴定上,并试图确定肠道微生物在NAFLD的病理生理学中的作用。然而,T2D对表现NAFLD特征的肠道微生物群的额外影响还没有得到充分的研究。因此识别特异性肝损伤或糖代谢受损的微生物组特征可能有助于理解肠道微生物区系在NAFLD和T2D之间的关系中所起的作用。
方法:我们研究了一个经活检证实的亚洲NAFLD队列(n=329;187名NAFLD患者,101名NAFLD和T2D患者,41名既没有NAFLD又没有T2D的患者)。
研究队列:我们分析了三个独立的韩国队列,目的是区分NAFLD和T2D的肠道微生物群。首先,“Boramae NAFLD队列”由韩国首尔市政府首尔国立大学Boramae医学中心招募(NCT02206841)。对288名经活检证实为NAFLD的参与者和41名未患NAFLD的参与者的粪便样本进行了研究。参与者的临床和生化特征列在表1和表2中。这项研究是根据1975年赫尔辛基宣言的伦理指导方针进行的,并得到了首尔国立大学Boramae医学中心机构审查委员会的批准(IRB No.26-2017-48)。所有研究参与者都获得了书面知情同意。第二,从忠南国立大学医院(CNUH;n=185;36例T2D和149例对照)招募了一个有效的T2D队列。这一队列的人口统计数据如表3所示。这项研究得到了CNUH机构审查委员会的批准(IRB No.2015-09-942-006)。所有参与者均提供书面知情同意书,所有操作均按相关指南和规定进行。最后,来自健康的韩国双胞胎队列(n=752)的数据来自欧洲核苷酸档案馆,研究登录号:ERP010289,并用于肠道分型。
2.2.纳入/排除标准:
2.2.1.Boramae NAFLD队列:有肝脏脂肪变性放射学证据的参与者有资格参加这项研究。随后的纳入/排除标准如下。纳入标准:成人(≥18岁),超声检查结果与肝脏脂肪浸润一致,且前6个月内血清丙氨酸氨基转移酶(ALT)活性升高原因不明。排除标准:乙型或丙型病毒性肝炎、自身免疫性肝炎、原发性胆管炎或原发性硬化性胆管炎、胃肠道癌或肝细胞癌、药物性脂肪变性或肝损伤、肝豆状核变性或血色素沉着、酗酒(男性:>30g/d,女性:>20g/d)、前一个月内使用抗生素、近5年内诊断为恶性肿瘤、人类免疫缺陷病毒感染、伴有脂肪营养不良或免疫抑制的慢性疾病。其次,至少有以下两个危险因素的患者接受肝活检:1)T2D,2)中心性肥胖(腰围男性为90 cm或女性为80 cm),3)循环甘油三酯浓度高(150 mg/dL),4)循环高密度脂蛋白胆固醇(HDL)低浓度(男性<40 mg/dL或女性<50 mg/dL),5)胰岛素抵抗,6)高血压,7)临床怀疑NASH或纤维化。没有非酒精性脂肪肝的参与者也接受了肝脏活检,因为他们要么是潜在的肝脏捐赠者,要么需要接受肝脏肿块的检查。在41名没有NAFLD的对照组参与者中,40人是肝移植供者,1人因怀疑肝脏肿块而需要活检。这名参与者在组织学检查的基础上被诊断为局灶性结节增生(FNH)。前一个月内服用抗生素的参与者也被排除在下游分析之外。
结果:本研究确定了肠杆菌、龙芽孢杆菌和限制感觉梭菌为与NAFLD和T2D的严重程度相关的主要分类群,而反刍球菌和巨型单胞菌是NAFLD特有的。特别是,与严重的肝脏病理和T2D相关的分类群也与糖尿病的标志物显著相关,如空腹血糖和Hb1Ac。肠型分析显示,与韩国健康的双胞胎队列(n=756)相比,患有NAFLD的参与者中类杆菌的比例明显较高,反刍菌的比例较低(n=756)。但T2D与NAFLD不能明确区分。对独立的T2D队列(n=185)的分析使我们能够验证NAFLD队列中确定的T2D特异性细菌特征。功能推断分析显示,与单纯NAFLD组相比,NAFLD和T2D组的内毒素生物合成途径显著丰富。

表1 NAFLD队列的临床特征,根据NAFLD的组织学谱进行分类。
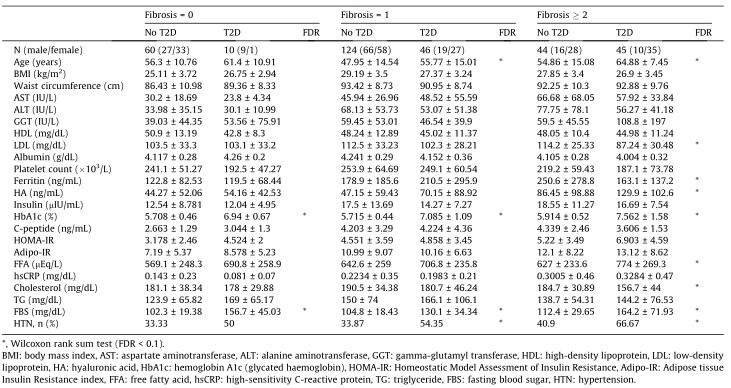
表2 NAFLD队列的临床特征,根据肝纤维化的严重程度进行分类。

表3 验证T2D队列的临床特征。
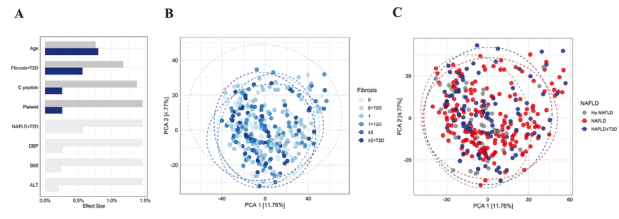
图1 NAFLD-T2D队列中微生物群落的变化。(A)队列特征对属一级微生物群落变化的解释力。蓝色和深灰色条表示单个和累积效果大小。浅灰色条表示在个体基础上显著但未包括在正向逐步RDA模型中的变量。基于Aitchison变换,对(B)纤维化和(C)NAFLD进行主成分分析(PCA)。N=329,FDR<0.1。
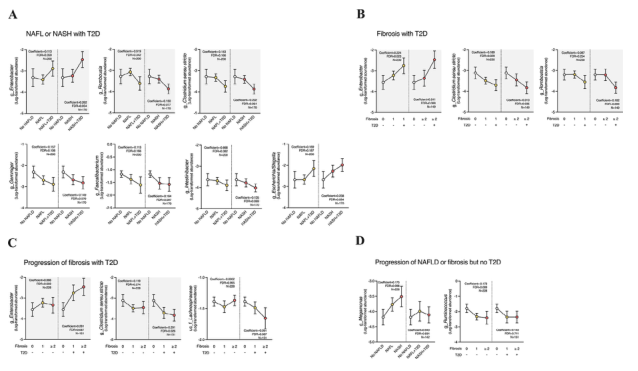
图2 NAFLD队列中微生物类群丰度的比较,根据NAFLD和T2D参与者的肝活检组织学或T2D参与者的肝纤维化严重程度进行分类。与NAFLD显著相关的属被描述为平均连通图。(A)NAFL或NASH与T2D有关,(B)纤维化仅与T2D有关,(C)T2D与纤维化的进展有关,以及(D)NAFLD或纤维化的进展与T2D无关。具有背景颜色的特征表示组之间的重叠特征。在调整年龄后,使用多变量关联分析识别关联性,并使用Benjamini-Hochberg方法计算校正的显著性水平(FDR<0.2)。N=329。

图3 病害相关类群丰度与寄主参数的关系。用Spearman相关法计算了10个病害相关类群的相对丰度与20个寄主参数之间的相关系数(按年龄调整)。曲线图的颜色表示Spearman‘s Rho的大小(n=329,*FDR<0.1)。缩写:FBS,空腹血糖;HbA1c,糖化血红蛋白;HDL,高密度脂蛋白;CRP,高敏C反应蛋白;脂肪IR,脂肪组织胰岛素抵抗;C肽,连接肽;HOMA.IR,胰岛素抵抗的稳态模型评估;GGT,γ-谷氨酰基转移酶;AST,天冬氨酸氨基转移酶;ALT,丙氨酸氨基转移酶;TG,甘油三酯;FFA,游离脂肪。
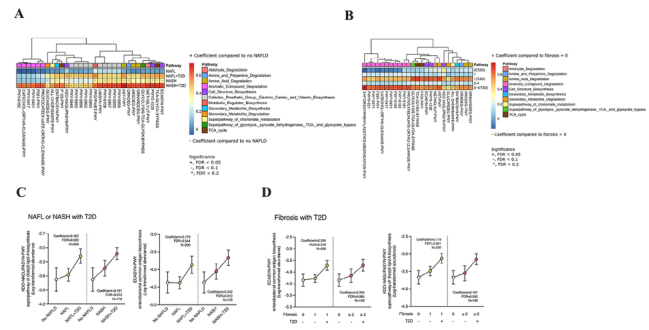
图4 推测NAFLD参与者的微生物代谢途径,根据NAFLD和T2D参与者的肝活检组织学或T2D参与者的纤维化严重程度进行分类。使用PICRUSt2预测微生物群落中代谢途径的活性,并使用MetaCyc数据库进行注释。(A)NASH±T2Dvs患者中有31条代谢通路显著上调。那些没有非酒精性脂肪肝的人,如热图所示。(B)纤维化评分为?2±T2D的参与者中有25条代谢途径上调。曲线图的颜色表示系数的大小。根据(C)非酒精性脂肪肝(NAFLD)患者的肝脏组织学和(D)肝纤维化的严重程度,T2D与两条与脂多糖合成有关的代谢途径也显示出相关性。在调整年龄因素后,使用多元关联分析方法对数据进行分析,并使用Benjamini-Hochberg方法计算FDR。N=329;+,FDR<0.05;?,FDR<0.10;*FDR<0.20。
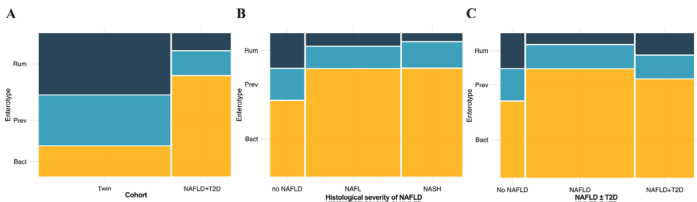
图5 朝鲜族人群的肠型。(A)健康的朝鲜族双胞胎(n=752)和NAFLD-T2D(n=329)队列中每种肠型的比例。(B)每种肠型在NAFLD-T2D队列中的比例,根据NAFLD单独存在(n=228)和(C)NAFLD+T2D(n=329)进行分类。FDR<0.1。

图6 使用独立的T2D队列验证已鉴定的NAFLD-T2D相关细菌特征。(A)队列变量对属水平上微生物群落变化的解释能力。蓝色和深灰色分别表示单个和累积效果大小。浅灰色条表示在个体基础上显著但未包括在正向逐步RDA模型中的变量。(B)基于Aitchison变换的T2D主成分分析(PCA)。(C)在验证队列中,使用和不使用T2D的参与者在细菌分类群丰度方面的差异。(D)47条推测的代谢途径在患有T2D的参与者中显著上调。(E)与LPS生物合成相关的途径的比较。N=185,FDR<0.1。
结论:这些发现可能有助于开发与特定细菌特征相关的代谢性疾病的有效治疗方法。
Si J, Lee G, You HJ,et al.Gut microbiome signatures distinguish type 2 diabetes mellitus from non-alcoholic fatty liver disease.Comput Struct Biotechnol J 2021;19


