全球首款口服小分子PD-(L)1人体试验数据披露
时间:2021-11-14 08:01:25 热度:37.1℃ 作者:网络
近日,Incyte公司在Journal for ImmunoTherapy of Cancer上报告了口服小分子PD-L1抑制剂INCB086550的I期(NCT03762447)临床数据。据了解,这是首个口服小分子PD-(L)1人体试验数据。

此项开放标签研究纳入的是晚期实体瘤成年患者(≥18 岁),这些患者接受标准疗法后发生疾病进展或对标准疗法不耐受、不适用。试验首先采用的是改良的3+3剂量递增方案,之后为剂量扩展方案。主要终点包括:INCB086550的安全性和耐受性,确定药理活性剂量和/或MTD(最大耐受剂量)以及RP2D(II期临床研究推荐剂量)。次要终点包括PK、药效学,以及由研究者确定的ORR和DCR(CR、PR或SD≥12周)。
截至2021年4月9日,共有79例患者接受了INCB086550治疗。其中57.0%为女性,62.0%接受过≥2线的既往治疗,16%接受过IO(肿瘤免疫)治疗。
结果显示,68例疗效可评估患者的ORR为11.8%(95%CI,5.2%–21.9%;CR,1.5%;PR,10.3%),DCR为19.1%(95%CI,10.6%–30.5%)。
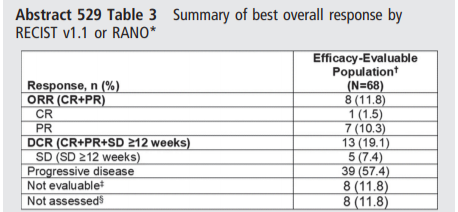
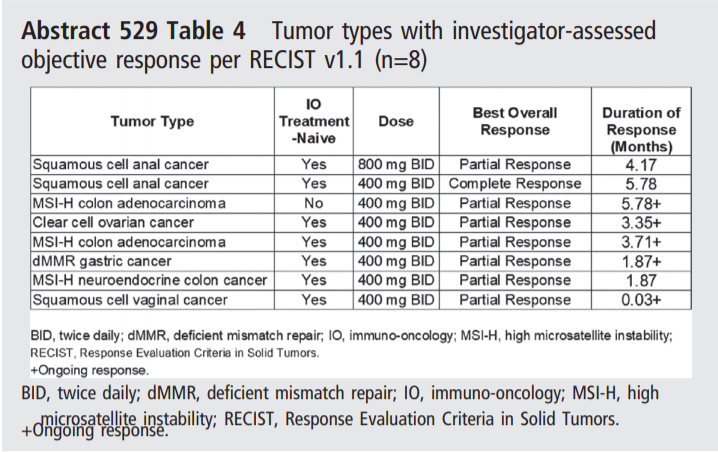
以下为不同瘤种出现客观缓解具体情况。在剂量≥400mg BID时,8例患者出现客观缓解。其中400mg BID中,5例未接受IO治疗的MSI-H肿瘤患者中有3例出现客观缓解。
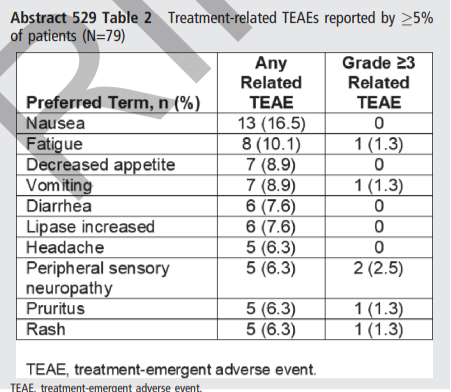
在安全性方面,46例(58.2%) 患者出现与治疗相关的TEAE(治疗中出现的不良事件);10例 (12.7%) 出现≥3级治疗相关TEAE。10例 (12.7%) 患者出现周围神经病变TEAE,均≤3级,分别有21例(26.6%),5例(6.3%)和13例(16.5%)患者因TEAE而中断治疗、降低剂量、停药。5例(6.3%) 患者死于TEAE,均被认为与研究药物无关。
同时,2021.11.12,CDE承办了 贝达药业1类新药 BPI-371153胶囊的临床申请。BPI-371153胶囊为创新、口服的小分子 PD-L1抑制剂。
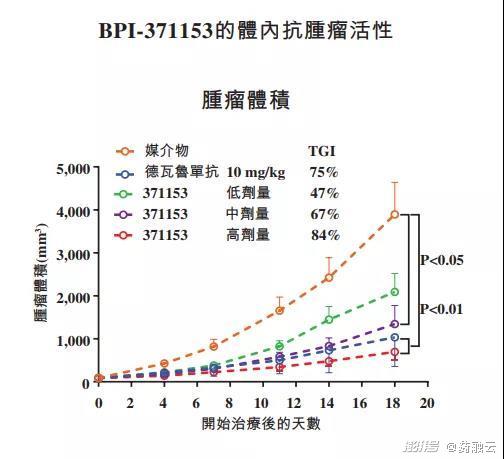
临床前数据显示,BPI-371153在刺激抗肿瘤免疫应答中具有良好的效用。在体外,BPI-371153释放了PD-L1对T细胞的免疫抑制作用,因此恢复了T细胞的活化。在体内,BPI-371153在转基因小鼠中显示出与德瓦鲁单抗(抗PD-L1抗体)相似的抗肿瘤活性(见下图)。目前正在对BPI-371153开展新药临床试验准备研究,并预计将于2021提交新药临床试验申请。
根据此前贝达药业申报港股申请书公开信息,BPI-371153是一种创新、口服的小分子PD-L1抑制剂,在临床前研究中可实现与抗PD-L1抗体相当的抗肿瘤免疫应答。贝达计划开发BPI-371153 用于治疗对抗PD-(L)1治疗有应答的多种癌症适应症。
PD-1/PD-L1单抗存在很多缺点,如生产成本高、口服生物利用度缺乏、组织滞留时间长和膜透性较差等,而小分子抑制剂可以避免这些问题,是业界关注的一个重要方向。


