“超级食物”再升级?降血糖血脂,还能改善氧化应激!
时间:2021-11-01 23:01:43 热度:37.1℃ 作者:网络
近年来,肥胖这一全球公共卫生问题继续迅速蔓延。作为一种慢性代谢疾病,肥胖是由许多因素(如饮食、环境和遗传学)的相互作用引起的,例如代谢紊乱引起的细胞内应激和炎症。饮食干预可以帮助治疗肥胖和超重。
内质网(ER)应激的慢性激活已被证明在肥胖胰岛素抵抗的发展中起重要作用。内质网应激被认为是胰岛素抵抗在分子、细胞和机体水平的一个重要特征。因此,维持内质网稳态对细胞的正常功能和生存至关重要。
近年来,藜麦种子因其优质蛋白和广泛氨基酸谱而迅速受到人们的关注。此外,藜麦具有抗寒、耐盐和抗旱的特性,可在世界各地广泛种植。因此,从藜麦蛋白的营养和功能特性来看,可以作为人类食品的理想选择。藜麦可产生多种具有广泛生物活性的代谢产物,包括皂苷、植物甾醇、酚类和生物活性肽,这使藜麦种子成为对抗肥胖、代谢综合征和T2DM的膳食干预的重要候选物质。 一项临床研究表明,每天摄入50克藜麦可以降低超重和肥胖参与者的血清甘油三酯和代谢综合征的发生率。动物实验还表明,藜麦可显著改善肥胖小鼠肝脏脂质积累和糖稳态,使动物HOMA-IR和血脂正常,糖脂代谢发生改变。此外,细胞实验表明藜麦多糖通过抑制脂肪转录因子(如PPAR+、C/EBP®、C/EBP+、C/EBP+、SREBP1C 和 AP2 表达,显著抑制了 3T3-L1 的分化。然而,藜麦抗肥胖作用的具体机制尚不清楚。

本研究旨在阐明藜麦饮食对高脂饮食(HFD)诱导肥胖小鼠的影响,以及藜麦饮食对ERS的调节作用,揭示藜麦抗肥胖作用的机制。

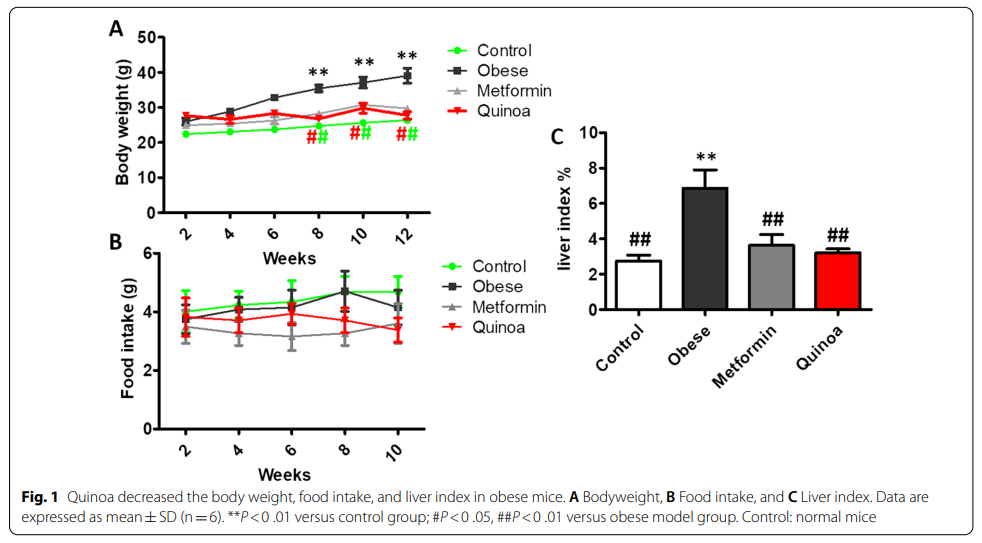
1、补充藜麦会降低肥胖小鼠的体重、食物摄入量和肝脏指数
为了观察藜麦对肥胖的抑制作用,先给小鼠喂食HFD 12周,然后给小鼠喂食2 g/kg体重的藜麦12周。肥胖小鼠的体重高于对照组小鼠(图1A)。经过12周的藜麦和Met治疗,小鼠体重和增重均显著降低(P<0.01,图1A) 同时,藜麦治疗有效地降低了肥胖小鼠的肝脏指数和食物摄入量(图1C)。与肥胖模型组相比,藜麦组在第6周至第10周的摄食量有所下降(P<0.01,图1B)。与模型组小鼠相比,藜麦显著降低了肥胖小鼠的体重、食物摄入量和肝脏指数。
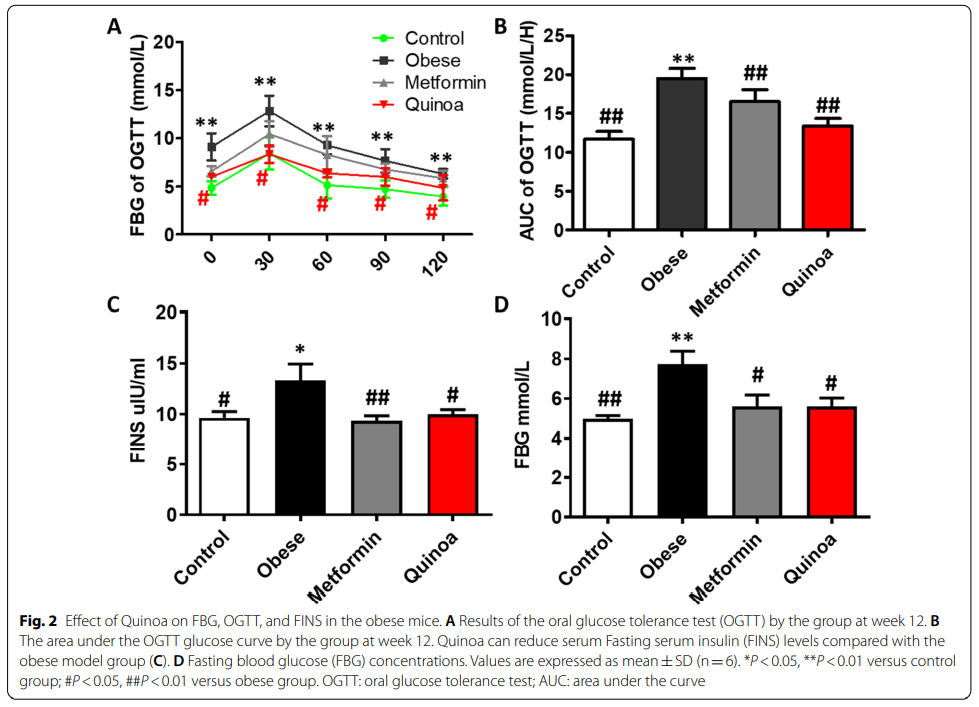
2、藜麦对肥胖小鼠血糖特征的影响
在实验中,模型对照组中的FBG水平明显高于正常对照组。与模型对照组相比,藜麦和二甲双胍显著降低肥胖小鼠的FBG(P<0.05)(图2D)。图2A, B显示了第12周进行OGTT的结果。相对于模型对照组,藜麦和二甲双胍可显著降低给糖前和给糖后30、60、90和120 min 血糖水平(P<0.05),与正常对照组水平相近。藜麦组和二甲双胍组的AUC在第6周和第12周显著小于模型对照组(P<0.05)。结果表明,藜麦降低了肥胖小鼠的FBG,提高了胰岛素敏感性。如图2C所示,肥胖小鼠血清FINS水平明显高于正常小鼠(P < 0.01)。经过12周的藜麦治疗,测定血清FINS和FBG水平(P<0.01,图2D)。服用藜麦12周增强胰岛素敏感性。
3、藜麦对肥胖小鼠血脂和脂肪质量的影响
血清TG、TC和LDL-C在肥胖模型组中的浓度明显高于对照组。相对于模型对照组,藜麦和二甲双胍治疗降低了血清TG、TC和LDL-C浓度(图3A-C) 。与模型对照组相比,藜麦组和二甲双胍组血清HDL-C浓度升高(P <0.01,图3D)。在第6周和第12周,模型对照组的脂肪含量大约是正常对照组的两倍(P<0.05)。在第6和12周,与模型对照组相比,藜麦治疗降低了脂肪量(P<0.05)。与模型对照组相比,二甲双胍也显著降低了脂肪量(P <0.05)(图3E, F)。结果表明,藜麦能抑制HFD喂养的肥胖小鼠的脂肪积累,并具时间依赖性。

3、藜麦对肥胖小鼠的氧化应激、肝功能的影响
如图4A所示,HFD诱导肥胖小鼠血清中MDA含量明显高于正常小鼠(P<0.05),GSH活性显著低于正常小鼠(P<0.05,4B)。干预12周后,藜麦可有效降低血清MDA含量(p < 0.05),提高GSH活性(p < 0.01)。此外,我们观察了藜麦对肥胖小鼠肝肾功能的影响。如图4C、D所示,肥胖小鼠的肝功能相关指标明显高于正常小鼠(p < 0.05)。给药12周后,藜麦组和二甲双胍组均能显著降低血清ALT、AST含量(P<0.05),这表明藜麦补充可在一定程度上减少肝细胞损伤。肾脏中也发现了类似的现象((图4E, F)。干预12周后,藜麦可显著降低血清尿素氮和肌酐水平,在抗肥胖的同时具有良好的肾脏保护作用。
肝脏HE染色结果见图4G。正常小鼠肝小叶结构清晰,肝索排列于中心静脉中央,肝细胞排列规则。与正常小鼠相比,药物未处理肥胖小鼠的肝脏结构显示脂滴数量增加,并伴有肝细胞肥大、淋巴细胞浸润和微血管脂肪变性。藜麦治疗12周后,肝组织的组织病理表现得到了改善。

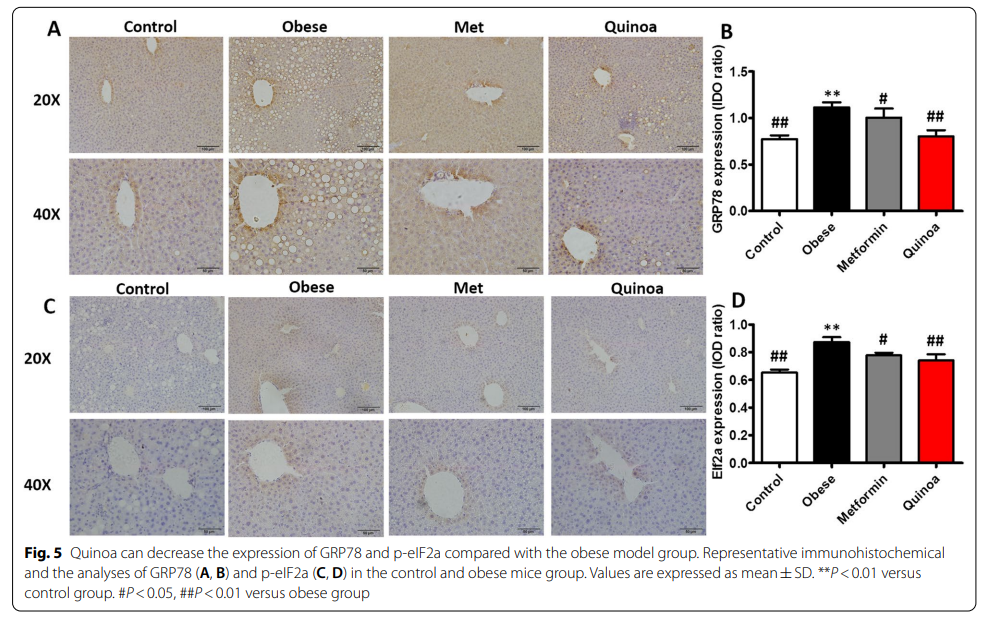
4、磷酸化的eIF2α和GRP78在肝脏免疫组化中的表达
观察GRP78(图5A, B)和p-eIF2α(图5C, D)表达。与正常ICR小鼠相比,肥胖小鼠肝脏p-eIF2α(图5D)和GRP78(图5B)表达增加。藜麦处理12周后,肝脏IHC中eIF2α和GRP78表达降低。
5、肥胖小鼠中磷酸化p-eIF2α、GRP78和CHOP蛋白的表达
肥胖小鼠中p-eIF2α、GRP78和CHOP的表达高于正常小鼠(图6)。与未用药的T2DM小鼠相比,藜麦治疗后,所有内质网应激标志物的表达均降低。

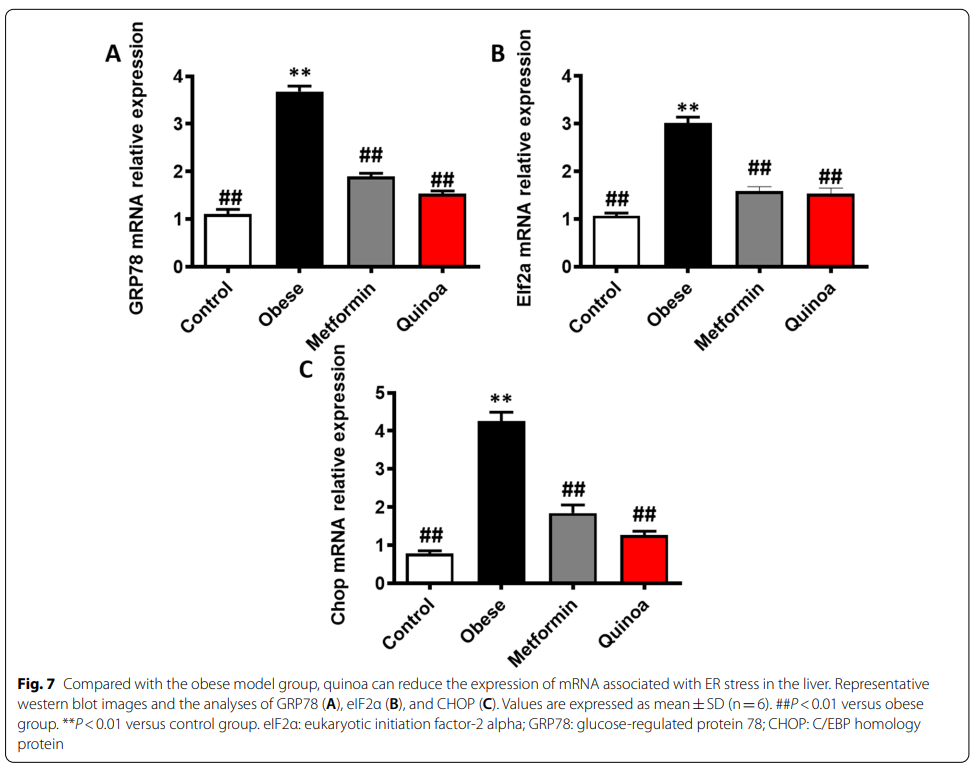
6、藜麦对肥胖小鼠内质网应激标志物mRNA表达的影响
如图7所示,肥胖模型组GRP78、eIF2α、CHOP mRNA相对表达量明显高于对照组(p < 0.01)。与未服用药物的肥胖小鼠相比,藜麦治疗减少了eIF2+、GRP78和Chop的基因表达。特别是,用低剂量藜麦治疗12周显著减少了eIF2+、GRP78和CHOP的相对表达(P<0.01)。
综上,藜麦饮食可以显著降低血糖、甘油三酯、胆固醇、低密度脂蛋白水平,提高葡萄糖耐受性,并改善肥胖小鼠肝组织的组织变化。此外,藜麦可以改善氧化应激指标,如GSH和MDA。此外,藜麦可以降低肥胖小鼠肝脏中ER应激标记eIF2+、GRP78和CHOP的mRNA表达。
总的来说,我们的研究结果表明,高脂肪消耗会改变肝脏内质网的稳态。此外,研究结果表明藜麦治疗能降低体重和体脂量,改善高脂饮食诱导肥胖小鼠模型的血糖和血脂分布。其潜在机制与藜麦通过eIF2α、GRP78和CHOP调控肝组织内质网应激有关。因此,我们认为藜麦有潜力成为治疗肥胖及其相关代谢异常的药物,包括高脂血症、高血糖和胰岛素抵抗。
原文来源:
An et al. Supplementation of quinoa regulates glycolipid metabolism and endoplasmic reticulum stress in the high-fat diet-induced female obese mice. Nutr Metab (Lond) (2021) 18:95
https://doi.org/10.1186/s12986-021-00622-8


