Mol Metab:瘦素通过其发热作用和稳定血清甲状腺激素水平来抵消甲状腺功能减退患者的体温过低
时间:2021-10-28 11:01:40 热度:37.1℃ 作者:网络

1.背景:循环甲状腺激素(TH)水平受到下丘脑垂体-甲状腺(HPT)轴的严格调控。下丘脑促甲状腺激素释放激素(TRH)的分泌导致垂体释放促甲状腺激素(TSH),促甲状腺激素刺激甲状腺激素的产生和分泌。无论是在下丘脑还是垂体,TH都可以分别对TRH或TSH予以负反馈调节,以抑制自身的分泌。这种对HPT轴和TH血清水平的严格控制还受到多种其他环境或内源性激素信号的影响,例如食物短缺、瘦素水平升高或环境温度低。然而,HPT轴调节在体温控制中重置的反馈机制仍不完全清楚。在这里,我们旨在确定甲状腺机能减退小鼠对不同环境温度的温度调节反应及其潜在的机制。
2.方法:甲状腺功能低下的雌性C57BL/6N小鼠和瘦素缺陷型Ob/Ob小鼠在室温或恒温条件下均能诱导出不同的致热攻击反应。通过代谢室、18F-FDG-PET/MRI、红外热像、代谢谱、组织学、基因表达和Western blot分析生热和代谢效应。
2.1代谢室:使用气候控制的间接量热系统(德国巴德洪堡的TSE系统)测量了临时独居小鼠的氧耗、二氧化碳产生、能量消耗、底物利用(呼吸交换率,RER)和家笼活动。如前所述,使用ANCOVA和以体重为协变量的基于R的CALR软件包进行分析
2.2血清参数的测定:根据制造商的说明书(DRG Instruments GmbH,Germany),使用商业ELISA试剂盒测定血清TT4和fT3浓度。使用小鼠瘦素ELISA(CrystalChem,Elk Grove Village,USA)测定血清瘦素。低于定量限的值(T4为25 nmol/l,T3为1.4 pg/ml)分别设置为12.5 nmol/l或0.7 pg/ml。
2.3 I型碘甲状腺原氨酸脱碘酶(DIO1)活性:肝脏(约50 mg)均质于0.5ml PED50缓冲液(0.1M磷酸钠,2 mM EDTA pH 7.2,50 mM二硫苏糖醇(DTT))中。根据制造商的说明(荷兰Veenendaal的Bio-Rad实验室),以牛血清白蛋白(BSA)为标准,用Bio-Rad蛋白分析法测量蛋白质浓度。将1 0e500倍稀释的匀浆在37℃下孵育30min,最后体积为0.15ml,加入0.1 mM的RT3,在PED10(0.1M磷酸钠,2 mM EDTA pH 7.2,10 mM DTT)中加入约1105cpm[3,3050-125I]RT3,在岛津高效液相色谱系统上重复测定DIO1活性,结合Waters SymmetryC18色谱柱(。每组中的一个样本在500 mM PTU存在下孵育,以抑制代表组织空白的D1活性。通过从没有PTU测量的活性中减去在组织空白中测量的活性来计算DIO1活性,并以每毫克蛋白每分钟产生的pmol 3,30T2表示。
2.4定量实时PCR(QPCR):为了定量基因表达,使用LightCycler System LC480和LightCycler-DNA Master SYBR Green I Kit(罗氏,曼海姆,德国)进行qPCR。以Rplp0为参考基因,用Delta-Delta Ct方法计算基因表达。通过将正常甲状腺对照组的平均值设置为1,然后计算所研究的各组小鼠的每个个体值来计算相对基因表达量。
2.5组织形态学:收集腹股沟和性腺WAT(分别为iWAT和gWAT)和肩胛内BAT(IBAT),在4℃、4%多聚甲醛(pH7.4)中固定24h,石蜡包埋切片,苏木精-伊红染色。使用Axio观察者显微镜(Carl Zeiss,耶拿,德国)进行显微镜检查。使用ZEN2012软件(德国耶拿的Carl Zeiss)获得图像。
2.6 BAT激活的18F-FDG PET/MRI:小动物PET/磁共振(MR)成像研究使用专用的高分辨率扫描仪(nanoScan, medio医学成像系统,匈牙利)进行。麻醉小鼠(4%诱导,1.8%异氟醚维持,60%/40%氧/空气)腹腔注射14.5?1.3 MBq [18F]-FDG,注射后30 - 60分钟进行列表模式扫描。数据重建如前所述[9]。通过在iBAT、iWAT和肝脏中手动绘制PET/ mr基础兴趣体积(VOIs)来确定[18F]FDG的标准摄取值(suv)。为了排除与甲状腺功能减退状态相关的[18F]-FDG分布可能的非特异性改变,计算SUV比值(SUVR)以使iBAT/iWAT摄取与肝脏摄取正常化。
2.7 棕色脂肪、尾巴和直肠温度的测量:为了测量表面BAT和尾部温度,在研究结束时在光阶段和室温下(VarioCA®hr;Infratec,Dresden,Germany)进行红外热成像。当动物在笼子底部自由移动时,拍摄每只小鼠的三张图像。由于红外图像已经显示野生型小鼠通过尾部散热,尾根温度与之相当,因此我们确定这些小鼠的尾部温度为距尾根2.5厘米,距尾根0.5厘米。
3 结果:在维持室温的甲状腺功能低下小鼠中,高瘦素水平通过棕色脂肪组织生热和白色脂肪组织褐变引起致热效应,从而稳定体温。在常温状态下生活导致瘦素水平的正常化和中央体温调定点的降低,导致棕色脂肪组织、白色脂肪组织和骨骼肌的生热作用减少,体温显著下降。此外,瘦素缺乏的ob/ob小鼠的体温下降表明,除了其生热作用外,瘦素对HPT轴发挥刺激作用,以稳定甲状腺功能减退症小鼠剩余的血清TH水平

图1 饲养温度对甲状腺功能正常(EU)和甲状腺功能低下(HO)小鼠血清甲状腺激素水平及体温调节的影响。(A)实验期间住房温度和甲状腺状况的示意图血清T4(甲状腺素)和T3(3,30,5-三碘甲状腺原氨酸)水平以及(C)肝Dio1(脱碘酶1)基因表达。(D)PTU(6-正丙基-2-硫氧嘧啶)处理4周并放置在30℃或21℃后,正常甲状腺对照组和甲状腺功能低下小鼠的DIO1活性。。(E)对PTU在不同温度下处理4周后体温的调节。(F)PTU治疗4周后甲状腺功能正常对照和甲状腺功能减退小鼠的最终体温。所有参数均在正常甲状腺对照组和PTU治疗的甲状腺功能低下小鼠21℃或30℃ (n=4-5 /组)。数据用均数±标准差表示。采用多因素方差分析,采用Sidak’s事后多重比较检验,p*<0.05, **p<0.01, ***p<0.001。

图2 瘦素调节甲减小鼠的尾部表面温度对环境温度的反应:(A)体重增加,(B)平均体重,(C)脂肪和瘦肉质量,(D)正常甲状腺对照(EU)和6-正丙基-2-硫氧嘧啶(PTU)处理的甲减小鼠(HO)在21℃或30℃饲养4周的瘦素血清水平。(编号:4-5/组)。(E)测量21℃或30℃甲状腺功能正常对照组和甲状腺功能低下小鼠尾部表面温度的红外热像仪的代表性图像。(F)测量距尾部1.5 cm处的尾部温度。(编号:4-5/组)。(G)治疗方案在ob/ob的示意图。(H)甲状腺功能正常和甲状腺功能低下/肥胖小鼠的体温发育和(I)保持在21℃或30℃(n=3-4/组)的体温。(J)反映尾部表面温度的典型红外图像和(K)在21℃或30℃饲养的甲状腺功能正常和甲状腺功能低下/肥胖小鼠的尾部温度的量化,测量距离尾部0.5 cm。数据用均值-扫描电镜表示。用多因素方差分析和Sidak’s后多重比较检验了21℃和30℃条件下甲状腺功能正常和甲状腺功能低下小鼠的统计学意义,分别为*p<0.0 5,**p<0.0 1和*p<0.001.0 5,**p<0.0 5,*p<0.0 1,*p<0.0 5。
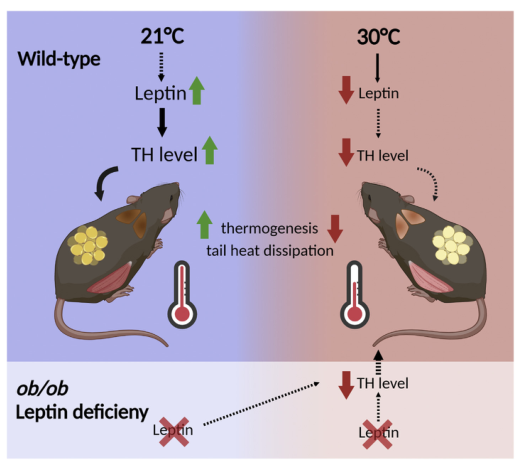
图3 该模型显示,在21℃时,甲状腺功能减退小鼠体内高水平的瘦素可引起高热效应,并通过稳定TH水平,导致BAT、WAT和肌肉的发热。在30℃时,甲状腺功能低下小鼠的甲状腺激素(TH)水平通过正常瘦素血清水平下降。因此,没有高热效应、完整的尾部血管收缩、TH水平低,会损害BAT、iWAT和肌肉的产热作用。这一现象反映在瘦素缺乏的ob/ob小鼠身上,其中甲状腺功能减退症与TH水平的迅速下降和体温的显著降低有关,而与住房温度无关。这张图片是由BioRender.com制作的。
4.结论:这项研究发现了一种以前未知的内分泌环路,其中瘦素与HPT轴协同作用,以稳定甲状腺功能减退小鼠的体温。
原文出处:
Weiner J, Roth L, Kranz M, Brust P,et al.Leptin counteracts hypothermia in hypothyroidism through its pyrexic effects and by stabilizing serum thyroid hormone levels.Mol Metab 2021 Oct 02


