指南与共识 | 糖皮质激素在慢性疼痛治疗中应用的专家共识(2020版)
时间:2021-10-23 20:01:27 热度:37.1℃ 作者:网络
疼痛是一种与组织损伤相关联的、令人不愉快的感觉和情感体验。当疼痛持续存在超过3个月,或超过相关疾病一般病程或损伤愈合所需要的一般时间,即形成慢性疼痛。慢性疼痛常伴随焦虑、抑郁等精神和心理问题,是致残、致死的重要原因,已成为当前影响人类健康和社会发展的主要问题之一。药物、微创介入和手术是治疗或缓解慢性疼痛的重要手段,而全身或局部使用糖皮质激素(glucocorticoids,GCs)则常被用于慢性疼痛的治疗。
糖皮质激素属于甾体类化合物,是肾上腺皮质激素的一种,内源性糖皮质激素由肾上腺皮质束状带分泌。自1948年首次用于类风湿性关节炎治疗以来,使用糖皮质激素治疗包括疼痛性疾病等曾风靡一时,但随之凸显的副作用很快限制了其临床使用。近年来,糖皮质激素在慢性疼痛治疗中应用有明显进展,为合理指导、规范糖皮质激素在慢性疼痛治疗中的应用,更好发挥药物疗效,有效降低副作用,保证患者安全,中华医学会麻醉学分会组织专家对《糖皮质激素在慢性疼痛治疗中应用的专家共识》进行了更新。
一、糖皮质激素的药理作用及慢性疼痛治疗机制
(一)糖皮质激素药理机制
糖皮质激素分泌受下丘脑-垂体-肾上腺轴(HPA)调节,内源性糖皮质激素包括可的松(cortisone)和氢化可的松(hydrocortisone),可的松需在肝脏代谢成氢化可的松才能发挥直接作用。糖皮质激素经由特异性基因调控和非基因调控两条途径产生广泛的生理和药理效应[1],包括调节物质代谢、应激反应、器官功能及抗炎、抗毒、抗过敏、免疫抑制、允许作用等。
1. 特异性基因调控途径:也称糖皮质激素的经典作用途径,通过胞内受体介导实现。糖皮质激素进入细胞后,与糖皮质激素受体(GR)结合,GC-GR复合体转移至细胞核内与DNA结合,启动mRNA转录,产生后序效应,特点是特异性,起效慢,持续时间长。
2. 非基因调控途径:不涉及胞内受体,也无关任何基因转录和蛋白质合成,糖皮质激素使用后数秒至数分钟即出现效应,不被DNA转录或蛋白质抑制剂抑制,与大分子偶联后不进入细胞仍能发挥作用。包括特异性非基因组效应和非特异性非基因组效应。前者在较低浓度或生理浓度时就快速出现效应,且具有特异性,后者通常在较高浓度时产生,可能与药物的亲脂性和极性有关。糖皮质激素与膜非特异性脂质或蛋白结合,改变了膜的理化特性或微环境,引起膜电位或离子流的变化。
任何糖皮质激素使用后都发生快速非基因组效应和延迟基因组效应,非基因作用也可调节其自身的基因效应。
(二)糖皮质激素治疗疼痛的药理机制
1.抗炎作用:糖皮质激素的抗炎作用是多种信号系统多方面作用的结果。既有快速的非基因组效应,又有延迟的特异性基因组效应。糖皮质激素对胸腺细胞、淋巴细胞、巨噬细胞等多种免疫细胞具有非基因组调节作用,可快速抑制中性粒细胞、巨噬细胞等免疫细胞脱颗粒和炎症介质释放,抑制炎症瀑布[2, 3];可抑制磷脂酶A2,阻断前列腺素形成,稳定细胞膜;GC-GR复合物可上调抗炎基因的转录、抑制促炎因子的表达[4]。此类抗炎效应有利于在炎症早期减少渗出、水肿、毛细血管扩张,解除对疼痛敏感结构的受压状态,改善微循环,降低伤害性感受器的敏感性,缓解红肿热痛和痛觉敏化。在炎症后期,基因组效应可抑制毛细血管和纤维母细胞增值,减少粘连和疤痕形成,预防和治疗慢性疼痛的发生。
2.免疫抑制作用:糖皮质激素抑制T淋巴细胞的增殖和Tc细胞的活化,抑制吞噬细胞对抗原的吞噬、处理,影响细胞免疫;促进淋巴细胞的解体和破坏,抑制抗体生成,影响体液免疫。
神经调节作用:伤害性神经元和纤维、胶质细胞上均存在GR[5],糖皮质激素可通过基因和非基因途径稳定神经元细胞膜,抑制神经元和神经纤维异位放电,阻断神经肽的合成,抑制磷脂酶A2活性,直接或间接调节伤害性神经兴奋性和神经性水肿[4, 6],与局麻药联合使用可延长其镇痛作用,降低阿片类药物用量[7]。
二、糖皮质激素治疗慢性疼痛的适应证与禁忌证
(一)适应证
1. 肌肉软组织无菌性炎性疼痛:肌腱和韧带劳损、肌筋膜炎、滑囊炎、腱鞘炎、肌腱附着点炎等。
2. 无菌性炎性骨关节痛:退行性骨关节炎、创伤性关节炎、粘连性肩关节囊炎等。
3. 脊柱相关性疼痛:颈腰椎间盘突出、椎管狭窄、脊柱小关节炎等。
4. 神经病理性疼痛:神经根炎、枕神经痛、三叉神经痛、带状疱疹后神经痛、腕管综合征、复杂区域疼痛综合征、坐骨神经痛、术后切口疼痛综合征等。
5. 风湿胶原病性疼痛:类风湿性关节炎、巨细胞动脉炎、风湿性多肌痛、强直性脊柱炎等。
6. 癌性相关痛:骨转移性痛、放射性神经炎性痛、椎管内肿瘤压迫等。
7. 其他疼痛性疾病:痛风性关节炎等。
(二)禁忌证
1. 对糖皮质激素过敏。
2. 严重的精神病和癫痫。
3. 活动性消化性溃疡。
4. 未控制的全身或注射部位感染。
5. 皮质醇增多症。
6. 严重高血压、糖尿病。
三、糖皮质激素治疗慢性疼痛的常用制剂
常用于慢性疼痛治疗的外源性糖皮质激素药物包括,泼尼松(prednisone)、泼尼松龙(prednisolone)、甲泼尼龙(methylprednisolone)、曲安奈德(triamcinolone)、倍他米松(betamethasone)、地塞米松(dexamethasone)。根据作用时间不同,糖皮质激素可分为短效、中效、长效,其各自药理学特性见表1。口服、静脉、肌内注射均具有全身治疗作用,针剂也常用于局部治疗。治疗慢性疼痛所用糖皮质激素多为中、长效制剂,中效糖皮质激素的HPA轴抑制作用相对较弱,可长期使用,而长效糖皮质激素虽然抗炎指数高,但生物半衰期长,对HPA轴的抑制作用强而持久,适合短期、局部使用。不同制剂选择使用时还需考虑溶媒(如乙醇)和附加剂(如苯甲醇)的刺激及毒性作用[4]。
1) 口服制剂:泼尼松、泼尼松龙、甲泼尼龙最为常用,属中效糖皮质激素。其生物半衰期较短,可长期使用。肝功能不全者不宜选用泼尼松,因其需在肝脏代谢为泼尼松龙后才可发挥药理作用。
2) 溶液型针剂:水溶性无色澄清液体,如地塞米松磷酸钠、倍他米松磷酸钠,易吸收,起效快,对组织刺激小,可静脉注射及关节腔等局部用药,但维持有效浓度时间短。
3) 悬液型针剂:呈乳白色微细颗粒混悬状,如曲安奈德、复方倍他米松、醋酸泼尼松龙、醋酸可的松,注射后缓慢吸收,作用时间延长,但局部刺激性通常较水溶剂大。可肌肉或关节腔等注射,但严禁静脉注射(导致毛细血管栓塞)。混悬液稳定性不如水溶剂,注意使用前要先摇匀,使用时需要注意与其他制剂或药物配伍禁忌。
4) 冻干粉针剂:白色疏松块状物,溶解后用法及疗效特点同溶液型针剂。常用的有氢化可的松琥珀酸钠、甲泼尼龙琥珀酸钠(甲强龙)。
5) 乳糜型针剂:常用地塞米松棕榈酸酯注射液,白色乳浊液,是一种地塞米松新型缓释剂,可静脉和关节腔等局部注射,成人每两周注射一次,副作用少而轻。
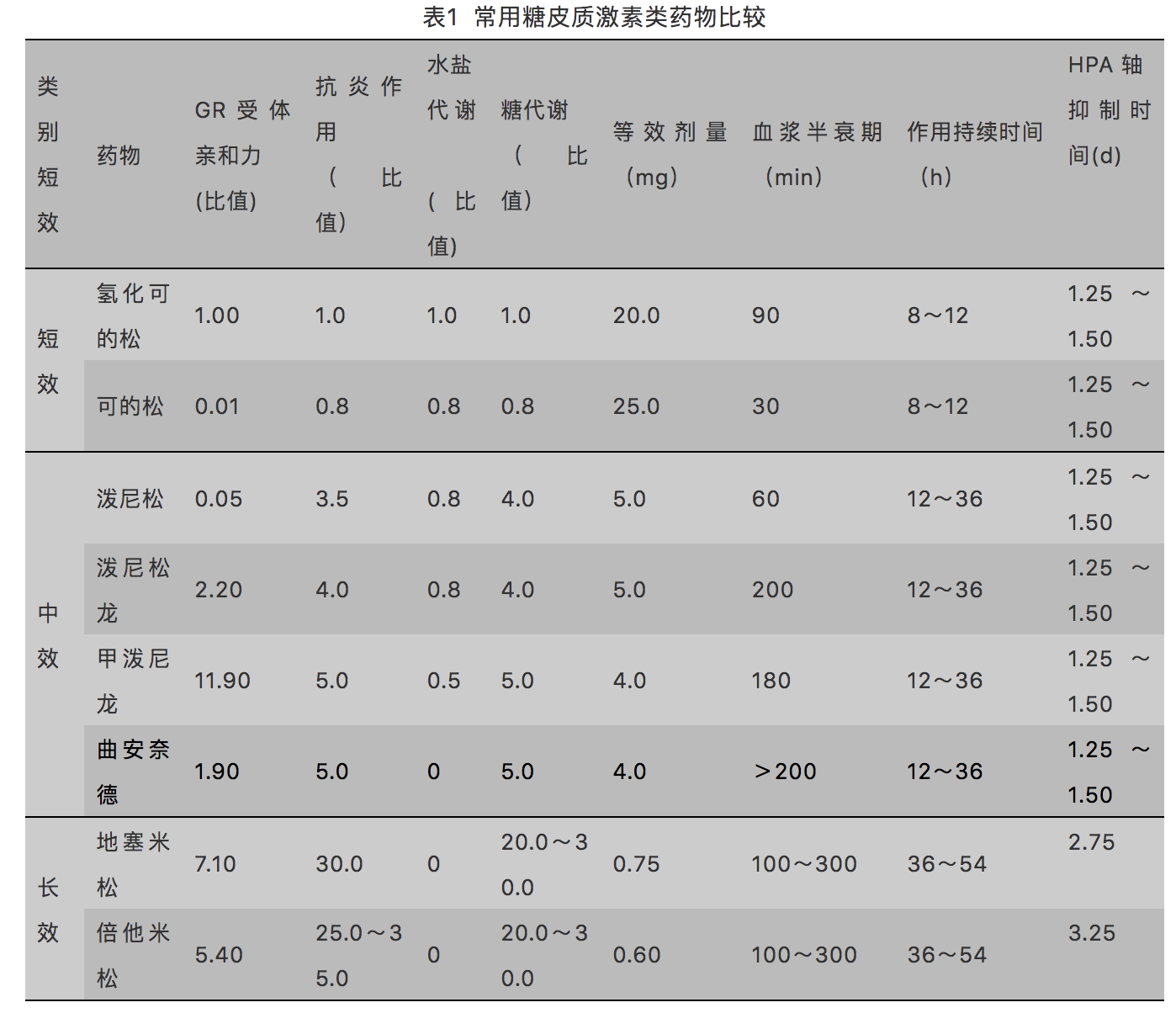
注:短效:t1/2 < 12h,中效:t1/2=12~36h,长效:t1/2 > 36h;表中水盐代谢、糖代谢、抗炎作用的比值均以氢化可的松为1计;等效剂量以氢化可的松为标准计
四、糖皮质激素治疗慢性疼痛的给药原则、途径和方式
(一)给药原则
1) 最低有效剂量、个体化给药,控制给药剂量和总量;
2) 局部给药时注意间隔时间;
3) 选择正确的注射部位与方式,局部注射时提倡在影像辅助下的精准给药;
4) 预防、监测、治疗全身和/或局部药物不良反应。
(二)给药途径和方式
1. 全身用药
糖皮质激素具有高效抗炎、抗水肿和免疫抑制作用,全身作用常被用于风湿胶原病相关性疼痛和癌性疼痛的镇痛辅助治疗,可快速控制症状[8-10]。临床实践原则是在尽可能短的时间内使用最小有效剂量,依个体需要调整剂量,在获得良好治疗效果的同时,降低产生严重副作用的风险。给药途径包括口服和胃肠外给药,给药模式有短期大剂量冲击和/或阶段性小剂量维持。大剂量使用5d内可骤停,超过14d应逐渐减量。
1) 口服给药
泼尼松和甲泼尼龙最为常用,为糖皮质激素镇痛全身治疗的主要用药途径。泼尼松等效剂量小于0.5 mg/kg/d为小剂量,0.5~1.0 mg/kg/d为中剂量,大于1.0 mg/kg/d为大剂量,甲泼尼龙7.5~30.0 mg/kg/d为冲击剂量[12]。随症状和实验室指标(血沉、C反应蛋白等)控制情况,逐步下调剂量至个体最低有效量(最佳剂量)。模拟生理性激素分泌周期,每日早晨8:00前顿服或隔日顿服,可降低对HPA的抑制、撤药反应和对生长的抑制。但疾病初期或炎症反应严重时为增加抗炎镇痛效果,可每日三次给药。
2) 胃肠外给药
包括静脉和肌肉内注射。针对放射性损伤性疼痛、脊髓压迫性疼痛等的短期糖皮质激素冲击治疗,可采用静脉途径给药,特别在病程初期阶段。维持治疗阶段不建议使用胃肠外途径。少数对口服不能耐受的患者,可选择长效脂溶性糖皮质激素肌内注射,一年内使用不超过3~4次。常用制剂为曲安奈德、复方倍他米松混悬液和地塞米松棕榈酸酯注射液,其在组织中溶解吸收缓慢,作用持久。曲安奈德局部组织刺激较大,易形成结晶体沉淀,不宜多次注射[13] 。
2. 局部用药
为增加局部组织糖皮质激素的浓度,提高疗效的同时减少全身吸收,降低对HPA轴的抑制等全身副作用,慢性疼痛治疗中常使用局部糖皮质激素给药方式[4, 14,15] 。多选择中效和长效制剂。长效制剂或混悬液由于局部作用时间长,所需注射次数少,间隔长,更为常用。曲安奈德混悬液在局部组织吸收缓慢,作用时间可持续2~3周,但其局部刺激较大,多次注射易致沉淀和组织粘连,故不宜多次注射,也不推荐用于硬膜外腔。复方倍他米松(得宝松)每毫升包含2mg倍他米松磷酸钠(溶于水)和5mg二丙酸倍他米松(微溶于水),为半球状微晶体混悬液,颗粒细微,局部刺激小,兼有起效快和长效的作用,局部作用达4周以上,较曲安奈德更为安全,但同样不能用于静脉和皮下注射。根据不同慢性疼痛特点,糖皮质激素局部给药途径和方式有不同侧重和要求。
1) 腱鞘、韧带、肌腱、肌筋膜周围注射:适用于肌筋膜炎、腱鞘炎、肌腱末端病、韧带的劳损和无菌性炎症疼痛等[15]。建议在超声等实时引导下注射,将药液精确送达腱鞘内、软组织敏感点、肌腱或韧带表面,为防止组织断裂,应避免肌腱和韧带内注射,对急性肌腱断裂者也应避免局部注射治疗。
2) 关节腔和滑膜囊注射:适用于退行性骨性关节炎、部分创伤性骨关节炎、类风湿性关节炎的选择性治疗。糖皮质激素具有关节内抗炎和镇痛作用,但其对关节软骨的影响有争议,长期疗效仍受质疑[16]。为避免多次注射并减少感染风险,更推荐使用长效类糖皮质激素,间隔3~4个月关节腔注射一次,1年不超过4次,可连续2年。建议在超声、X线等影像引导下完成精准关节腔或滑膜囊注射,以避免靶点外注射及对关节软骨、滑膜等的损伤。应根据关节腔特点和容量选择合理穿刺路径和药物容量(剂量)。
3) 外周神经(节、根、丛、干)周围注射:适用于神经卡压、损伤、水肿等引起的疼痛,如坐骨神经痛、颈腰神经根性痛、臀上皮神经炎、带状疱疹相关性神经痛等。建议在超声、神经刺激器或X线等辅助下操作,无需寻找异感,避免神经内高张力注射,交感神经不推荐使用糖皮质激素治疗。
4) 硬膜外腔注射:适用于椎间盘突出、椎管狭窄引起的压迫性疼痛、非压迫性炎性脊神经根炎、带状疱疹后神经痛等。穿刺路径包括经棘突间隙、经椎板间隙、经椎间孔入路和骶管注射。注射节段应参照病变节段,由经过专门训练的专科医师在影像辅助和造影下操作[17],以提高穿刺准确性,避免蛛网膜下腔注射和脊髓损伤。硬膜外注射常用的糖皮质激素包括甲基强的松龙(40~80mg/次)、曲安奈德(10~40mg/次)、倍他米松(1ml/次)和地塞米松(5~10mg/次)[4, 18]。颗粒性制剂有可能引起局部沉积和入血后形成微血栓,硬膜外腔注射更倾向于选择非颗粒型制剂,尤其是颈胸段硬膜外腔注射[19]。椎间盘内糖皮质激素注射会诱发大量钙化,故应避免盘内注射糖皮质激素[20]。
5) 鞘内注射:用于慢性疼痛治疗仍存在争议[1]。除水溶性地塞米松外,其他糖皮质激素和剂型禁用于鞘内注射。
五、糖皮质激素治疗慢性疼痛的不良反应与防治
不良反应可由药物本身引起,也可由介入技术导致药物误入非治疗靶点引发。其发生率和严重程度与给药剂量、时间、剂型、注药部位等相关。局部注射可减少糖皮质激素的用药总量,降低系统不良反应,但仍存在药物的全身吸收,大剂量反复注射也可产生全身不良反应[20]。不同部位注射的全身吸收量目前还不清楚,注射次数和药物总量的确定仍存在争议。因此,在慢性疼痛治疗中,无论全身用药还是局部注射,均要考虑糖皮质激素的单次剂量、累积剂量、疗程和撤药反应,避免和降低不良反应发生[8, 20, 21]。由于使用的个体差异,即使小剂量使用也要注意不良反应的发生。
(一)药物相关不良反应与防治
糖皮质激素影响整个内分泌系统,包括糖代谢、骨代谢、脂代谢、免疫、胃肠、情绪、性激素和心血管等。单次或短时间使用时,少数患者可出现一过性面部潮红、兴奋、睡眠障碍、血压或血糖升高等。长时间或反复较大总量使用时,可能增加下述不良反应的发生。
1) HPA轴抑制反应:长期或反复使用糖皮质激素可抑制HPA轴,突然停药或减量过快可能引发肾上腺皮质危象,表现为恶心、呕吐、乏力、低血压和休克等。应尽量短期使用糖皮质激素并控制总剂量;需长期使用糖皮质激素时,选择小剂量、早晨顿服或隔日顿服可降低对HPA轴的抑制。一旦发生肾上腺皮质功能不全或危象,除立即对症处理外,常需要恢复或加大糖皮质激素剂量,待稳定后再逐步减量[22]。
2) 骨质疏松:这是长期糖皮质激素治疗的潜在并发症[8, 23]。糖皮质激素可增加破骨细胞活性和尿钙排泄,同时降低成骨细胞活性和胃肠道钙吸收,造成获得性骨量丢失和骨密度降低,增加脆性骨折发生几率。因此,使用糖皮质激素时应尽早补充钙剂(1200~1500 mg/d)和维生素D(800~1000 U/d)或活性维生素D,针对已存在骨密度降低者,可联合口服或胃肠外给予双磷酸盐[24]。
3) 代谢性副作用:糖尿病或糖耐量异常的患者常出现血糖升高,单次注射后一般在2~3d内最明显,此类患者须注意监测血糖,并及时调整降糖药和胰岛素剂量。库欣综合征的发生取决于糖皮质激素的治疗剂量和持续时间。
4) 感染易感性:糖皮质激素增加局部或全身的感染易感性,特别是服用高剂量糖皮质激素的同时行免疫抑制剂治疗的患者,能掩盖感染征象,延误诊断和治疗。因此,糖皮质激素治疗的患者应认真评估感染风险。
5) 肌腱/韧带粘连、脆化、断裂:与局部血管减少、组织纤维化、增加钙化和组织脆性相关。应避免肌腱和韧带内注射,同时控制局部注射糖皮质激素的剂量、次数和注射时压力。
6) 其他:活动性消化性溃疡、皮肤色素沉着、体重增加、低血钾、水肿、高血压等。
(二)技术和剂型相关不良反应与防治
糖皮质激素局部使用中由穿刺技术本身引起(如局部血肿、硬膜外脓肿、穿破硬膜后低颅压性头痛等),或穿刺导致药物误入血管、蛛网膜下腔引发。尽管该类不良反应罕见,一旦发生后果严重,需引起重视。
糖皮质激素混悬液的颗粒常大于红细胞,误入血管或由破损血管吸收可能引发小血管堵塞或血栓,尤其经椎间孔入路硬膜外或神经根注射时,糖皮质激素混悬液误入脊神经根动静脉、椎动脉可能导致脊髓或脑梗死[4, 19, 21],强烈推荐注药前反复回抽以及在影像引导下操作给药。
参考文献
[1] Rijsdijk M, van Wijck AJ, Kalkman CJ, Yaksh TL. The effects of glucocorticoids on neuropathic pain: a review with emphasis on intrathecal methylprednisolone acetate delivery. Anesth Analg. 2014;118(5):1097-1112. doi:10.1213/ANE.0000000000000161
[2] 刘磊, 张婷, 蒋春雷. 糖皮质激素非基因组机制的生理意义. 生理科学进展, 2013, 44(5):329-332..
[3] Jiang CL, Liu L, Tasker JG. Why do we need nongenomic glucocorticoid mechanisms?. Front Neuroendocrinol. 2014;35(1):72-75. doi:10.1016/j.yfrne.2013.09.005.
[4] Schilling LS, Markman JD. Corticosteroids for Pain of Spinal Origin: Epidural and Intraarticular Administration. Rheum Dis Clin North Am. 2016;42(1):137-ix. doi:10.1016/j.rdc.2015.08.003.
[5] Shaqura M, Li X, Al-Khrasani M, et al. Membrane-bound glucocorticoid receptors on distinct nociceptive neurons as potential targets for pain control through rapid non-genomic effects. Neuropharmacology. 2016;111:1-13. doi:10.1016/j.neuropharm.2016.08.019
[6] 阚会丽, 张宗旺. 糖皮质激素参与疼痛信号调控的研究进展.国际麻醉学与复苏杂志, 2012, 33(6):416-419..
[7] Zorrilla-Vaca A, Li J. Dexamethasone Injected Perineurally is More Effective than Administered Intravenously for Peripheral Nerve Blocks: A Meta-Analysis of Randomized Controlled Trials. Clin J Pain. 2018;34(3):276-284. doi:10.1097/AJP.0000000000000519
[8] 何静, 徐蕾. 糖皮质激素治疗类风湿关节炎的管理策略. 现代药物与临床, 2016, 31(9):1509-1512..
[9] 姜运昌, 李峻岭. 糖皮质激素在肿瘤治疗中的应用. 癌症进展, 2015, 6:577-579..
[10] 中华医学会风湿病学分会. 2018中国类风湿关节炎诊疗指南. 中华内科杂志, 2018(4):242-251..
[11] Konijn NPC, van Tuyl LHD, Boers M, et al. Similar efficacy and safety of initial COBRA-light and COBRA therapy in rheumatoid arthritis: 4-year results from the COBRA-light trial. Rheumatology (Oxford). 2017;56(9):1586-1596. doi:10.1093/rheumatology/kex223.
[12] 卫生部, 糖皮质激素类药物临床应用指导原则(2011版)
[13] Haroon M, Ahmad M, Baig MN, Mason O, Rice J, FitzGerald O. Inflammatory back pain in psoriatic arthritis is significantly more responsive to corticosteroids compared to back pain in ankylosing spondylitis: a prospective, open-labelled, controlled pilot study. Arthritis Res Ther. 2018;20(1):73. Published 2018 Apr 17. doi:10.1186/s13075-018-1565-4.
[14] 马柯. 糖皮质激素在疼痛微创介入治疗中的应用——中国专家共识. 中国疼痛医学杂志, 2017, 23(6):401-404..
[15] Ammitzbøll-Danielsen M, Østergaard M, Fana V, et al. Intramuscular versus ultrasound-guided intratenosynovial glucocorticoid injection for tenosynovitis in patients with rheumatoid arthritis: a randomised, double-blind, controlled study. Ann Rheum Dis. 2017;76(4):666-672. doi:10.1136/annrheumdis-2016-209840.
[16] Savvidou O, Milonaki M, Goumenos S, Flevas D, Papagelopoulos P, Moutsatsou P. Glucocorticoid signaling and osteoarthritis. Mol Cell Endocrinol. 2019;480:153-166. doi:10.1016/j.mce.2018.11.001.
[17] Vorobeychik Y, Sharma A, Smith CC, et al. The Effectiveness and Risks of Non-Image-Guided Lumbar Interlaminar Epidural Steroid Injections: A Systematic Review with Comprehensive Analysis of the Published Data. Pain Med. 2016;17(12):2185-2202. doi:10.1093/pm/pnw091.
[18] Chang-Chien GC, Knezevic NN, McCormick Z, Chu SK, Trescot AM, Candido KD. Transforaminal versus interlaminar approaches to epidural steroid injections: a systematic review of comparative studies for lumbosacral radicular pain. Pain Physician. 2014;17(4):E509-E524.
[19] Mehta P, Syrop I, Singh JR, Kirschner J. Systematic Review of the Efficacy of Particulate Versus Nonparticulate Corticosteroids in Epidural Injections. PM R. 2017;9(5):502-512. doi:10.1016/j.pmrj.2016.11.008.
[20] Stout A, Friedly J, Standaert CJ. Systemic Absorption and Side Effects of Locally Injected Glucocorticoids. PM R. 2019;11(4):409-419. doi:10.1002/pmrj.12042.
[21] Berthelot JM, Le Goff B, Maugars Y. Side effects of corticosteroid injections: what's new?. Joint Bone Spine. 2013;80(4):363-367. doi:10.1016/j.jbspin.2012.12.001.
[22] 徐建国, 唐会, 姚尚龙,等. 肾上腺糖皮质激素围手术期应用专家共识(2017版). 临床麻醉学杂志, 2017.
[23] 曹威, 林华. 糖皮质激素所致骨骼病变研究新进展. 中华骨质疏松和骨矿盐疾病杂志, 2016, 9(1):81-87.
[24] 糖皮质激素诱导的骨质疏松诊治的专家共识. 中华风湿病学杂志, 2013, 17(006):363-368.


