Nat Nanotech:肿瘤免疫治疗重大突破,上海药物所李亚平等开发表观遗传调控纳米囊泡,改善肿瘤免疫治疗
时间:2021-09-28 21:03:21 热度:37.1℃ 作者:网络
免疫疗法是肿瘤治疗领域的革命性进展,肿瘤内I型干扰素(IFN)的水平与包括结肠癌、黑色素瘤和三阴性乳腺癌等在内的多种肿瘤预后密切相关。虽然目前临床上可以通过注射重组人IFN提高其瘤内水平,但其肿瘤靶向性差、疗效低,易产生明显的全身免疫毒性。
而化疗药物、分子靶向药物以及表观遗传药物虽然也能在一定程度上诱导肿瘤内IFN表达,但由于特异性差,效果也不理想,特别是瘤内IFN的上调会不可避免地诱导多种免疫检查点分子表达,促使肿瘤发生免疫逃逸进而产生免疫耐受。
因此,如何选择性提高瘤内IFN等免疫分子水平,并同时克服其诱导的免疫耐受,是肿瘤免疫治疗领域亟待解决的重大科学问题。
2021年9月27日,中国科学院上海药物研究所李亚平课题组在 Nature Nanotechnology 期刊上发表了题为:T lymphocyte membrane-decorated epigenetic nanoinducer of interferons for cancer immunotherapy 的研究论文。
该研究通过工程化T淋巴细胞膜修饰干扰素表观遗传纳米诱导剂改善肿瘤免疫治疗,创造性地构建了一种“精准递送+智能释药一体化”的仿生纳米囊泡,揭示了该纳米递药系统的作用机理,取得了肿瘤特异性干扰素诱导并同时克服免疫耐受的重大突破。

针对上述临床重大需求,上海药物所研究员张鹏程和李亚平团队首先通过基因工程化技术构建了高表达程序性死亡受体-1(PD-1)的T细胞,并获得该工程化细胞的细胞膜囊;随后又用其包裹负载赖氨酸特异性组蛋白去甲基化酶1(LSD1)抑制剂ORY-1001的白蛋白纳米粒;最后,他们以还原敏感穿膜肽M70对其进行表面修饰,获得了表观遗传调控纳米囊泡(OPEN)。
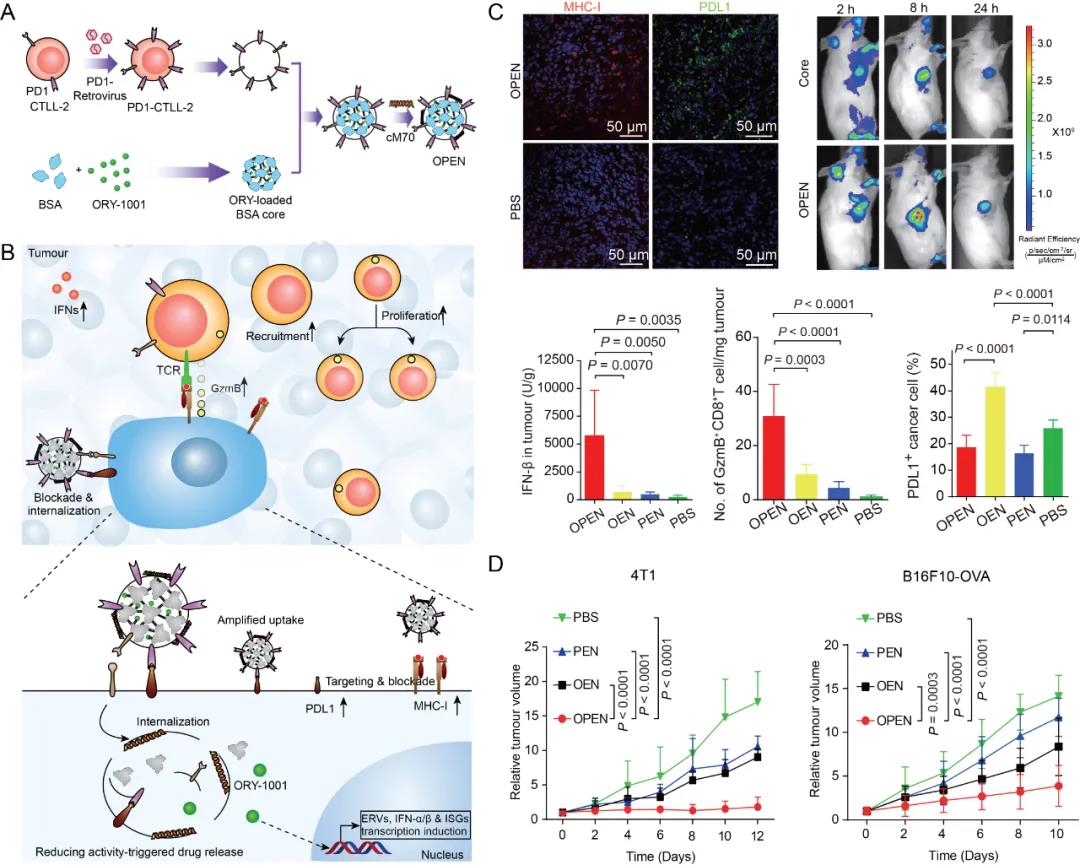
图:A. PD1过表达CTLL-2细胞的构建和负载ORY-1001纳米囊泡(OPEN)的制备。B. OPEN被肿瘤细胞PDL1识别并入胞,上调IFN表达,增加肿瘤微环境内T细胞浸润并促进细胞毒性T细胞(CTL)活化,同时阻断PDL1介导的免疫逃逸。C. OPEN特异性靶向肿瘤,显着上调瘤内IFN表达,促进抗原递呈,提高肿瘤中细胞毒性T细胞浸润并有效解除ORY-1001造成的免疫抑制。D. OPEN显着抑制乳腺癌和黑色素瘤的生长。
研究人员发现,在静脉注射后,OPEN能特异性靶向肿瘤,高效诱导瘤内IFN分泌,上调肿瘤细胞PD-L1和主要组织相容性复合体-I(MHC-I)等的表达,并进一步促进OPEN摄取,产生自增强效应,将瘤中细胞毒性T细胞浸润增加了29倍,显着降低ORY-1001的免疫副作用,在动物模型上有效抑制三阴性乳腺癌、黑色素瘤或结肠癌的生长。
该研究开拓了“精准递送+智能释药一体化”技术调控表观遗传、克服免疫耐受、改善肿瘤免疫治疗的新方向,为提高包括IFN在内的兼具抗癌活性和促进免疫逃逸的活性分子疗效以及降低其免疫副作用提供了新思路。
上海药物所博士研究生翟艺慧和上海交通大学仁济医院博士研究生王金名为该论文共同第一作者,李亚平和张鹏程为共同通讯作者。该研究工作同时得到了国家自然科学基金、中国科学院青年创新促进会和山东省自然科学基金的支持。
院士点评
中国科学院院士、国家纳米科学中心主任赵宇亮认为,该研究成果首次报道了纳米药物递释系统(NDDS)运载表观遗传药物并与免疫疗法相结合,克服免疫耐受,提高了表观遗传调控的特异性和免疫疗法的效果,具有显着的原创性和独特性。“成功解决了表观遗传药物具有的两面性难题,是采用NDDS提高癌症免疫疗法效果和安全性的一个里程碑式新进展。”
中国工程院院士郝希山表示,该研究首次将表观遗传药物仿生纳米化并与免疫疗法相结合,实现了表观遗传药物的肿瘤靶向递送和免疫检查点阻断效应,成功解决了表观遗传疗法的特异性差和效果具有两面性两大关键难题,是表观遗传疗法与免疫疗法有效结合治疗肿瘤的一个重大进展。
原始出处:
Zhai, Y., Wang, J., Lang, T. et al. T lymphocyte membrane-decorated epigenetic nanoinducer of interferons for cancer immunotherapy. Nat. Nanotechnol. (2021). https://doi.org/10.1038/s41565-021-00972-7.


