Nat Nanotech:原来肿瘤分“冷”“热”,这项给肿瘤“加温”的纳米技术有望成为癌症克星!
时间:2021-08-21 20:02:45 热度:37.1℃ 作者:网络
免疫检查点阻断疗法(immune checkpoint blockade therapy,ICB therapy)作为目前癌症治疗领域当仁不让的“网红”疗法,正在为更多患者带来希望。然而,需要关注的是,目前只有部分患者能够从中受益,比如在结直肠癌患者中,除了约4%群体治疗有效外,ICB疗法大多无效。
因此,医学界正致力于研究将“免疫冷肿瘤”转化为“免疫热肿瘤”的方式来加强ICB疗法的疗效,换句话说,就是首先通过一些疗法让无免疫原性肿瘤(免疫冷肿瘤)周围聚集更过的免疫细胞,提高生物标志物表达,“变身”成为有免疫原性肿瘤(免疫热肿瘤),再联合ICB疗法达到更有效的杀死肿瘤的效果。其中,免疫原性化疗作为“加热”肿瘤的疗法之一,显示出能与ICB疗法协同“作战”的巨大潜力,但由于不良的药代动力学、对健康组织和免疫细胞的非特异性毒性,化学疗法在提高ICB疗效方面受到了阻碍。
近日,美国亚利桑那大学的研究团队在 Nature Nanotechnology 上发表题为“Immunogenic camptothesome nanovesicles comprising sphingomyelin-derived camptothecin bilayers for safe and synergistic cancer immunochemotherapy”的研究文章,该项研究发明了一种新型纳米治疗平台以及跨膜转运技术作为“加热”肿瘤的方法,采用抗癌药物喜树碱来协同ICB疗法,在结直肠癌和黑色素瘤小鼠模型中,不仅能够根除大部分晚期肿瘤,阻断肿瘤转移,还能激活记忆免疫,防止癌症复发。
喜树碱(Camptothecin,CPT)是一种有效的化疗药物,可治疗多种癌症,显示出能够增强细胞毒性T淋巴细胞(CTL)杀伤力以杀死肿瘤细胞的潜力。然而,水溶性差、具有严重不良反应以及内酯环不稳定等特性限制了CPT与ICB疗法的联合应用。而鞘磷脂(sphingomyelin,SM)是一种在细胞表面发现的天然脂质,能够与治疗药物的功能部位结合,因此,研究人员假设,将喜树碱附着在鞘磷脂上或许能够改善喜树碱的缺陷,从而增强对癌症的治疗效果。
由此,研究人员合成了四种不同的SM-CPT,并筛选出了载药量最高、稳定性最好、副作用最小的Camptothesome-4。在将 Camptothesome-4 用于CT26荷瘤小鼠体内进行药代动力学和组织分布的评估后,试验结果显示,Camptothesome-4显着延长了循环半衰期,并通过有效的CPT释放,将更多的药物输送到肿瘤中,同时也具备优越的安全性。

SM-CPT的合成设计过程
接下来,为了阐明Camptothesome-4是否保留了CPT的抗癌活性、以及是否能够联合PD-1/PD-L1等ICB疗法提升抗癌效果,研究人员比较了单剂量Camptothesome-4、游离CPT以及 Onivyde(一种FDA批准的CPT衍生物)治疗CT26荷瘤小鼠的效果。试验结果显示,在Camptothesome-4治疗后的肿瘤中,生物标志物PD-L1、PD-1和IFN-γ显着上调,这些数据为Camptothesome-4联合PD-L1/PD-1阻断治疗结直肠癌提供了坚实的支持。
此外,在研究人员向CT26荷瘤小鼠静脉注射单剂量 Camptothesome-4 加三次腹腔注射抗PD-L1单克隆抗体后,其联合疗法能显着阻碍肿瘤发展,并在五分之一的小鼠中根除了肿瘤。
这一效果在MC38小鼠模型中同样卓着,联合阻断PD-L1/PD-1疗法和Camptothesome-4, 可以在六只小鼠中根除五只体内的肿瘤,并显着延长小鼠存活率。同时,五只存活的小鼠在接受MC38细胞再次激发后,依旧没有肿瘤产生,这意味着这一联合疗法能够激活记忆免疫,防止肿瘤复发。
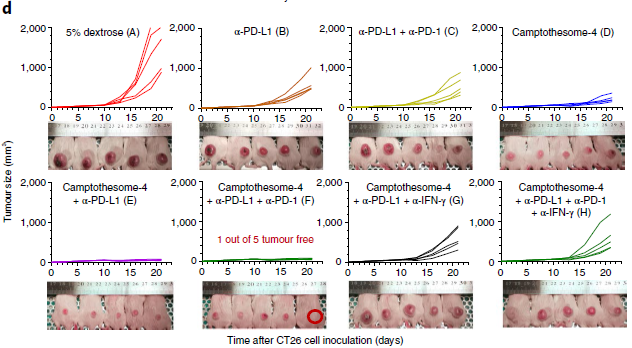
CT26荷瘤小鼠使用PD-L1/PD-1疗法+Camptothesome-4后的肿瘤变化
在试验过程中,研究人员发现了生物标志物IDO1在CT26和MC38结直肠癌细胞中的表达,由此,他们选择以DOX(阿霉素)为跨膜载体,将IDO1抑制剂 IND(indoximod,吲哚莫德)整合到 Camptothesome-4中,以评估其抗癌潜力。试验结果显示,当与PD-L1/PD-1联合阻断时,DOX-IND/camptothesome-4在五分之三的小鼠中消除了约400 mm3的肿瘤,并延长了小鼠存活时间。

DOX-IND/camptothesome-4的合成设计过程
研究人员又将试验更进一步,建立了晚期和转移性原位结直肠癌与黑色素瘤的小鼠模型,并加入叶酸靶向。当与叶酸靶向共同使用时,DOX-IND/camptothesome-4 在33.3%的小鼠中进一步抑制肿瘤生长并根除肿瘤。结合PD-L1/PD-1疗法时,叶酸/DOX-IND/camptothesome-4帮助66.7%的小鼠达到了无瘤生存,且无可检测的肿瘤转移。
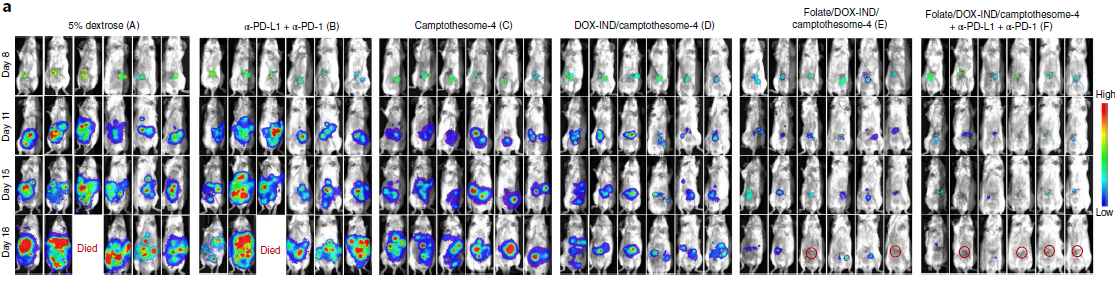
各疗法对小鼠体内晚期肿瘤的治疗效果
总之,该项试验研究展现了基于这一纳米平台所开展的联合疗法,在治疗早期和临床上难以治疗的晚期转移性肿瘤时所取得的显着疗效。其研究作者表示,他们的纳米技术平台可用于提供一系列癌症疗法,同时,由于运用到了获得FDA批准的鞘磷脂脂质载体,将使这一平台在药物开发中具有重要的领先优势,他们期待早期临床试验的展开。
原始出处:
Wang, Z., Little, N., Chen, J. et al. Immunogenic camptothesome nanovesicles comprising sphingomyelin-derived camptothecin bilayers for safe and synergistic cancer immunochemotherapy. Nat. Nanotechnol. (2021). https://doi.org/10.1038/s41565-021-00950-z.


