综述:特发性肺纤维化治疗药物治疗进展
时间:2021-08-20 11:02:23 热度:37.1℃ 作者:网络
特发性肺纤维化( IPF ),是特发性间质性肺炎中最常见和最严重的疾病,是一种未知原因的慢性疾病,其特征是肺实质进行性瘢痕形成,最终导致肺功能丧失,死于呼吸衰竭,IPF的中位生存期大约为2-3年。IPF主要表现为隐匿的劳累,虚弱;呼吸短促,干咳,伴发进行性呼吸困难,胸部听诊出现“Velcro啰音”,病人做深慢呼吸时,可以在整个吸气时间在病人双肺肺底听到不连续的,高调短促爆裂音,有如轻轻撕开尼龙扣的声音,这是纤维化的小气道和肺泡结构突然打开的声音。一些危险因素如吸烟,慢性支气管炎,环境或职业接触以及微生物可能会导致具有易感遗传背景的人群罹患该疾病。目前关于IPF发病机理的认识是由伤口愈合反应失调涉及到大量纤维化信号通路的异常,导致细胞外基质( ECM )沉积过多和胶原蛋白的积累从而引起肺重构。
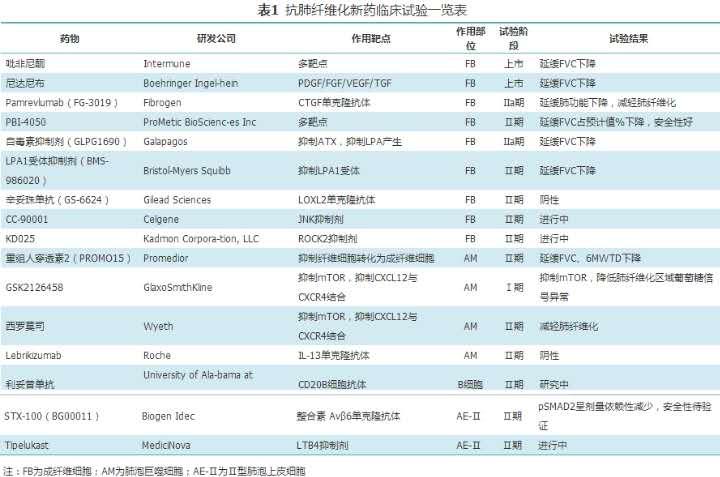
IPF预后差,未经治疗的患者诊断后中位生存期为3~5年[1] 。以IPF为代表的慢性纤维化性肺疾病抗肺纤维化药物的研发,基于对肺纤维化机制的认识。目前已有吡非尼酮和尼达尼布被批准上市,其有效性和安全性已在随机对照试验(RCT)和真实世界研究中证实 。针对不同部位、不同靶点的抗肺纤维化药物研发速度加快,呈现多元化的趋势(表1 )。
一、IPF发病机制和药物作用靶点
在易感基因和环境因素交互作用下,吸烟、慢性微吸入、职业暴露、病毒感染、机械牵张和环境污染,导致肺泡上皮细胞老化和反复损伤,从而异常激活,分泌促炎、促纤维化介质,包括成纤维细胞生长因子(FGF)、结缔组织生长因子(CTGF)、趋化因子等;同时免疫细胞如巨噬细胞,可分泌血小板衍生因子(PDGF)、金属蛋白酶(MMPs)等,参与炎症反应和修复。上述物质通过肺间质细胞、肺间质周围细胞、循环纤维细胞、上皮间充质转化和内皮间充质转化多种途径,促进成纤维细胞增殖、转化为肌成纤维细胞。肌成纤维细胞是IPF的主要效应细胞,可通过酪氨酸激酶、丝氨酸-苏氨酸激酶、G蛋白耦联等多种通路分泌大量细胞外基质(ECM),异常聚集形成瘢痕组织,导致肺结构重塑和功能丧失 。
IPF治疗药物的作用靶点包括避免环境危险因素,减轻肺泡上皮细胞老化和损伤,减少其分泌促炎、促纤维化介质;减轻炎症反应,减少免疫细胞分泌细胞因子;抑制成纤维细胞转化为肌成纤维细胞,减少ECM产生和沉积,减慢甚至阻止肺纤维化发生,延缓肺功能下降。除单一药物,多靶点不同药物联合治疗也是可能的治疗策略。
二、作用于成纤维细胞药物
1.Pamrevlumab(FG-3019):
FG-3019是人源性CTGF单克隆抗体。CTGF是分泌型细胞基质蛋白,调节多条信号通路,可介导上皮细胞、星状细胞和成纤维细胞分化,诱导肌成纤维细胞形成,促进ECM沉积,导致组织重塑和纤维化。辐射诱导小鼠肺纤维化模型中,小鼠接受20Gy辐射剂量处理,分别在辐射前2 d,辐射后2、20和112 d,给予FG-3019干预8周。结果显示FG-3019有预防、减轻或逆转小鼠肺结构重塑的作用,不同时间点各组别均出现肺功能改善和生存期延长的作用,其中辐射后20 d干预组70%小鼠存活 。
在美国开展了一项评估不同剂量FG-3019治疗IPF安全性和有效性的开放性、多中心Ⅱa期试验(FGCL-3019-049)。研究入选89例IPF患者,分为低剂量组(15 mg/kg,静脉注射,1次/3周,持续45周)和高剂量组(30 mg/kg,静脉注射,1次/3周,持续45周)。低剂量组患者用力肺活量(FVC)占预计值%为45%~85%,一氧化碳弥散量(D L CO)占预计值% ≥ 30%,试验前3~12个月病情进展、肺功能恶化或呼吸困难加重;高剂量组患者FVC占预计值% ≥ 55%,试验前18个月内病情进展;高分辨率CT (HRCT)显示间质性肺纤维化证据,即整个肺内≥10%至<50%的实质纤维化(网格影)且<25%蜂窝影。有效性终点包括肺功能、高分辨率CT和生活质量评估;安全性终点为不良事件(急性加重)和严重不良事件(严重急性加重)。结果显示FG-3019可延缓肺功能下降,48周时,两组FVC变化值为-0.15和-0.13 L,FVC占预计值%变化值为-3.00%和-2.25%,D L CO占预计值%变化值为-4.50%和-5.61%。定量HRCT显示两组网格影伴肺结构改变、磨玻璃影、蜂窝影、肺总量较基线时明显改善 。研究共有24例(27%)发生38次SAE,其中13例退出试验,以肺炎、IPF恶化、呼吸衰竭最常见,两组AE和SAE发生率及常见类型无显著性差异 [19] 。研究表明FG-3019治疗IPF具有安全性和有效性,其局限性是缺乏对照组。
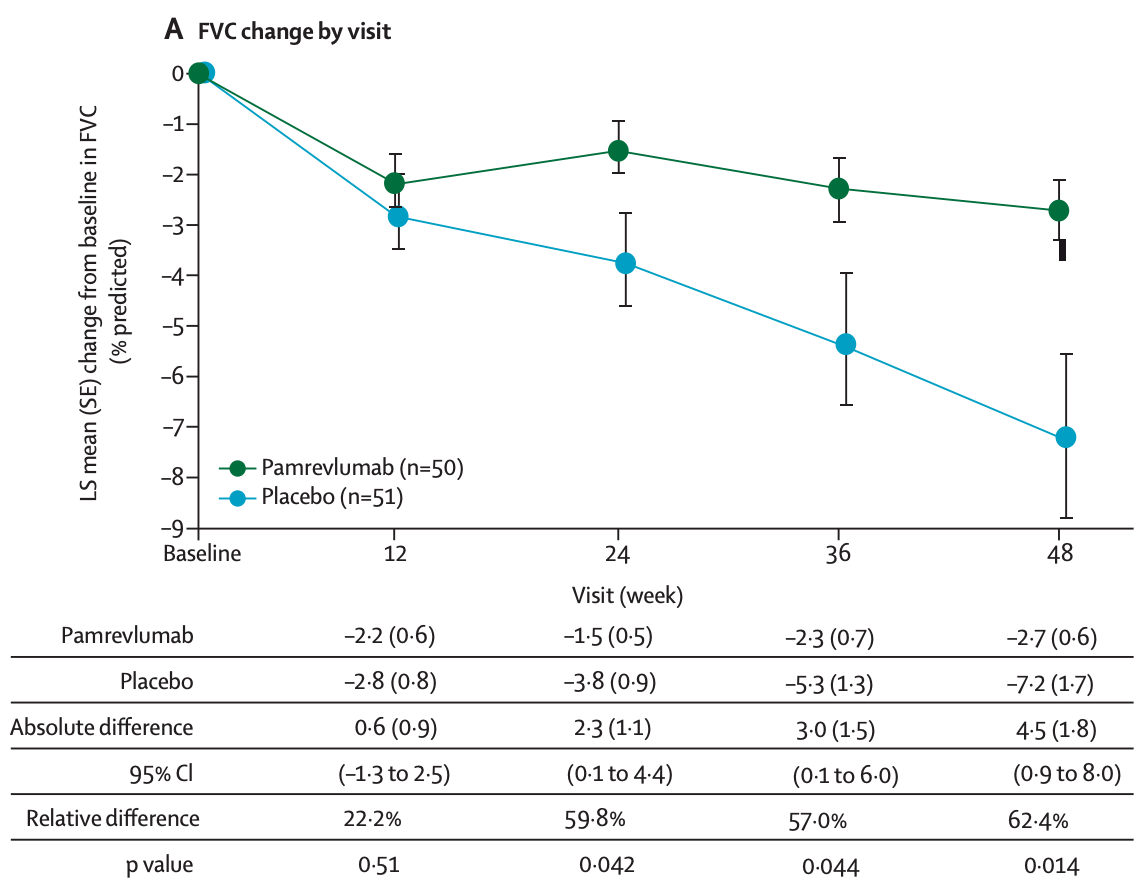
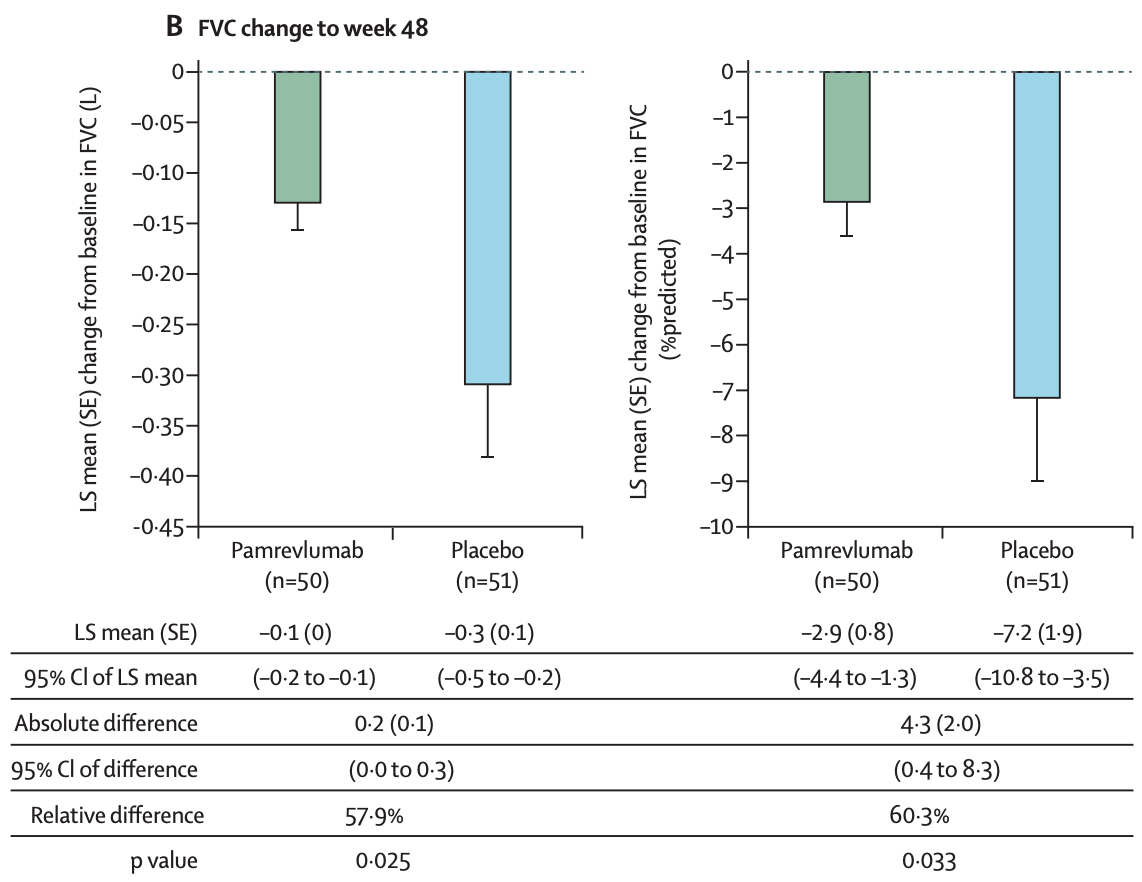
PRAISE是双盲、Ⅱ期RCT,纳入103例FVC占预计值%≥ 55%的IPF患者,随机分入pamrevlumab组(50例,30 mg/kg,静脉注射,每3周1次,共48周)和安慰剂组(53例) [20] 。主要终点是第48周FVC占预计值%变化值,其他终点是疾病进展(48周时FVC占预计值%的下降≥10%或死亡)以及第24和48周定量HRCT评估肺纤维化程度。结果显示48周时pamrevlumab组FVC占预计值%的下降(-2.9%)显著低于安慰剂组(-7.2%);pamrevlumab组患者发生疾病进展的比例(10.0%)显著低于安慰剂组(31.4%);pamrevlumab和安慰剂组48周肺纤维化体积的变化分别为75.4和151.5 ml,治疗差异为-76.2 ml,且这种差异在24周时已观察到,表明pamrevlumab可以延缓肺纤维化进展;此外,FG-3019组圣乔治呼吸问卷(SGRQ)分数显著低于安慰剂组。研究结果表明,pamrevlumab治疗IPF安全、有效,可以提高患者生活质量。
2.PBI-4050:
PBI-4050即3-戊基苯乙酸钠盐,是新合成的小分子中链脂肪酸类似物,对G蛋白耦联受体GPR40和GPR84分别具有激动和拮抗作用。PBI-4050与GPR40和(或)GPR84结合,可抑制成纤维细胞转化为肌成纤维细胞,抑制ECM沉积,减少促炎介质(单核细胞趋化蛋白-1、IL-8和IL-6)和促纤维化介质(CTGF和IL-6)表达。
一项研究PBI-4050治疗IPF安全性、耐受性和有效性的开放性、单组设计、多中心Ⅱ期试验,纳入41例IPF患者 。其中9例接受PBI-4050单药治疗(800 mg/d,口服),其余各16例接受PBI-4050联合吡非尼酮或PBI-4050联合尼达尼布治疗,为期20周,包括6次随访 [22] 。主要终点是4个月时出现治疗相关实验室异常值和(或)急性加重患者例数,次要终点包括3个月时肺功能、影像及生物标志物较基线变化。结果显示PBI-4050药物代谢动力学特征在PBI-4050组和PBI-4050联合尼达尼布组相似,但在PBI-4050联合吡非尼酮组降低,提示两种药物可能存在相互作用。PBI-4050组和PBI-4050联合尼达尼布组,第12周FVC绝对值或占预计值%无显著变化,PBI-4050联合吡非尼酮组FVC占预计值%显著地降低( P <0.024),3组患者药物耐受性均良好。PBI-4050单药或联合尼达尼布有望成为抗肺纤维化新的治疗方案。
3.自毒素抑制剂(GLPG1690):
细胞外溶血磷脂酰胆碱(LPC)在水解酶自毒素(ATX)作用下,分解产生溶血磷脂酸(LPA),LPA与GPR结合,影响细胞迁移和增殖。ATX是磷酸二酯酶家族成员,是产生LPA的主要途径。IPF患者肺组织、支气管肺泡灌洗液和呼出气中LPA水平升高,提示LPC-ATX-LPA通路可能成为IPF的治疗靶点 [24,25] 。GLPG1690是一种ATX抑制剂。
一项针对GLPG1690治疗IPF安全性、耐受性、药物动力学特征的多中心、平行设计Ⅱa期RCT,于2016至2017年开展。IPF患者以3∶1分入试验组(GLPG1690,600 mg/d)和对照组,为期12周,在第1、2、4、8、12周和最后一次治疗2周后接受评估和随访。患者在入选前1年内接受HRCT评估,FVC占预计值% ≥ 50%,D L CO占预计值% ≥ 30%。主要终点是出现急性加重、异常实验室指标、异常生命体征、异常心电图的患者比例和LPA血浆浓度变化,次要终点是肺功能变化、生活质量评估等。结果显示两组出现急性加重患者比例为67%和65%,为轻中度,实验室指标、生命体征、心电图和SGRQ评分较基线无明显变化,试验组LPA血浆浓度在第4周和12周降低,随访中恢复基线水平。12周两组FVC变化值为25和-70 ml,FVC下降减缓甚至逆转。GLPG1690是首个进行IPF治疗RCT的ATX抑制剂,代表一种潜在的抗肺纤维化药物种类。
一项研究不同剂量GLPG1690联合IPF标准治疗的安全性及有效性的双盲、多中心、平行设计Ⅲ期RCT(ISABELA)于2018年11月开展 [26] 。750名IPF患者以1∶1∶1分入高剂量组(GLPG1690,600 mg/d)、低剂量组(GLPG1690,200 mg/d)和对照组,为期52周。患者入选前5年诊断IPF,入选前1年内接受HRCT评估,接受当地IPF标准治疗,即吡非尼酮、尼达尼布或任何原因未服此两种药物,服药者要求入选前至少2个月内剂量稳定,FVC占预计值% ≥ 45%,D L CO占预计值% ≥ 30%。主要终点是52周时FVC下降率,次要终点是疾病进展(定义为FVC占预计值%下降≥ 10%)或全因死亡的复合终点,首次出现呼吸疾病相关住院治疗的时间,SGRQ评分较基线变化等,该研究尚在进行中。
4.LPA1受体抑制剂(BMS-986020):
BMS-986020是特异性LPA1受体抑制剂。LPA1受体具有介导成纤维细胞聚集、内皮细胞功能障碍的作用,博来霉素诱导肺纤维化小鼠经LPA1受体基因敲除后,其肺泡上皮细胞凋亡、血管渗漏及成纤维细胞水平降低 [27] 。
一项研究BMS-986020治疗IPF安全性及有效性的双盲、多中心、Ⅱ期RCT于2013年开展 [28] 。143例IPF患者分入高剂量组(48例,BMS-986020,1 200 mg/d)、低剂量组(48例,BMS-986020,600 mg/d)及对照组(47例),持续治疗26周。患者年龄介于40~90岁,入选前6年内首次诊断IPF,吸入支气管扩张剂后FVC占预计值%介于45%~90%,D L CO占预计值%为30%~80%。主要研究终点是26周时FVC变化率,次要研究终点是26周时肺纤维化定量评分(QLF)几何平均比(GMR)、6 min步行试验、呼吸急促问卷变化(SOBQ)等。结果显示26周时低级剂量组、高剂量组及对照组FVC变化为-0.076、-0.05、-0.136 L(后两组差异有统计学意义, P =0.049),三组QLF GMR变化为1.14、1.09、1.11,6 min步行试验变化为-14.2、6.1、10.3 m,SOBQ变化分别为3.8、-1.7、3.9,病死率为4.17%、4.17%、2.13%,急性加重发生率为18.75%、33.33%、25.53%。研究表明BMS-986020 600 mg bid显著地延缓FVC下降速度,但可出现剂量相关性肝酶升高。
5.辛妥珠单抗(GS-6624):
赖氨酰氧化酶样蛋白2(LOXL2)是催化胶原交联的酶,在肺纤维化发病中发挥作用 [29,30] 。与正常组织相比,肿瘤和纤维化组织中LOXL2表达增加 [31] 。博来霉素诱导小鼠肺纤维化模型中,鼠源性LOXL2单克隆抗体可有效预防和逆转肺纤 维化[29] ,推测人源性LOXL2单克隆抗体(GS-6624)可能有相似的抗肺纤维化作用。
一项研究GS-6624治疗IPF安全性、耐受性、药代学及药效学Ⅰ期试验(AB0024-201)于2010年开展,为期113 d。研究包括A、B两部分,A部分是剂量序贯递增、双盲RCT,入选18例患者,B部分是随机、双剂量(GS-6624,125或200 mg,静脉注射>1 h)开放试验,入选30例患者。主要研究终点是GS-6624安全性、耐受性及药代学特征,次要研究终点是GS-6624抗体形成及对FVC、D L CO、SGRQ的影响,该研究结果未公布。
ATLAS是研究GS-6624治疗AB0024-201受试者安全性、耐受性的Ⅱ期试验。该研究2012年在美国开展,共纳入34例患者,依据原始试验剂量每2周静脉注射GS-6624 200 g/L或每(7±2)天皮下注射125 g/L,排除合并重要器官功能障碍、怀孕等患者。主要研究终点是末次药物治疗后30 d至165周内急性加重患者比例、治疗相关生化及血液学异常,次要研究终点是72周及144周FVC占预计值%、D L CO占预计值%变化等。结果显示33例患者出现急性加重,其中35.3%为重症,3例患者死亡;72及144周时FVC占预计值%分别下降8.05%及12.04%,D L CO占预计值%分别下降7.41%及22.08%。
RAINIER是研究GS-6624治疗IPF有效性和安全性双盲、多中心Ⅱ期RCT [32] 。研究入选544例IPF患者,按1∶1分入治疗组(GS-6624,125 mg,皮内注射,1次/周)和对照组。患者6 min步行距离≥50 m,海平面静息未吸氧时SpO 2 ≥89%,可耐受肺弥散功能检查。主要终点为无进展生存期(PFS),重要次要终点为全因死亡率、FVC占预计值%,其他次要终点为6 min步行距离和SGRQ。治疗时间由临床事件决定。试验中发生120次和200次无进展生存事件后进行中期分析,第二次中期分析时,由于达到了预先设定的治疗无效标准而终止试验。结果显示两组PFS和FVC占预计值%变化值分别为12.6和15.4个月,-11.7%和-7.1%,无统计学差异,其他次要终点无统计学差异。两组AE、SAE发生率相似,常见咳嗽、上呼吸道感染、呼吸困难和IPF加重。RAINIER是阴性结果,GS-6624较安慰剂未显示出抗纤维化优势。
6.CC-90001:
二代Jun N末端激酶(JNK)信号通路是TGF-β 1 下游信号转导通路,其异常表达能影响TGF-β 1 活性,改变IPF进程 [33] 。CC-90001是JNK抑制剂。
一项评估CC-90001治疗肺纤维化安全性、耐受性、药代学及药效学的开放、多中心、多剂量交错递增、Ⅰb期临床试验,于2015年在美国和澳大利亚开展。18例PF患者以1∶1分入低剂量组(CC-90001,100 mg/d)和高剂量组(CC-90001,200 mg/d),低剂量组中至少3例患者完成最短2周治疗并经评估达剂量递增标准时,余同组6例入组高剂量组开始治疗;3例中1例达剂量递增停止标准,余6例中3例开始低剂量治疗;余6例中≥2例达剂量递增停止标准,高剂量CC-90001治疗不再开展,所用患者接受持续12周治疗。此外,高剂量组患者达剂量递增停止标准时入组低剂量组,≥2例出现此情况,重复或停止试验。入选患者≥18岁,经HRCT评估符合肺纤维化诊断,肝功能正常并签署知情同意书,在筛选期、治疗12周内及随访4周时接受评估。主要研究终点是16周时发生急性加重的患者数量、实验室评估、心电图等,次要研究终点是16周时CC-90001血浆浓度、药代学特征,该研究结果尚未见报道。
一项研究两种剂量CC-90001治疗IPF安全性、药物动力学特征、生活质量评估的双盲、多中心Ⅱ期RCT于2017年开展,共纳入135例IPF患者,以1∶1∶1分入低剂量组(200 mg,1次/d,口服)、高剂量组(400 mg,1次/d,口服)和安慰剂组。患者接受24周治疗后进入治疗延长阶段,第24周时安慰剂组患者以1∶1分入低剂量组和高剂量组,继续治疗80周,共计104周。患者FVC占预计值%为45%~95%,D L CO占预计值%为25%~90%,6 min步行距离≥150 m。主要研究终点是24周时FVC占预计值%变化,次要研究终点是24周时FVC变化、病情进展情况、SGRQ评分,以及104周时6 min步行距离、Borg评分等。研究结果尚未见报道。
7.KD025:
Rho/Rho相关蛋白激酶(ROCK)信号通路可增加肌球蛋白轻链磷酸化水平,增加肌动-肌球蛋白收缩力促使细胞在ECM中迁移。Rho/ROCK信号还可活化TGF-β 1 和CTGF,在IPF发病中起作用 [34] 。KD025是选择性ROCK2抑制剂。
一项研究KD025治疗IPF安全性、耐受性的随机、多中心、开放标签Ⅱ期临床试验于2016年开展 [35] 。研究纳入76例IPF患者,以2∶1分入治疗组(KD025,400 mg,1次/d,口服)和对照组(最佳支持治疗,由医师制定治疗方案),持续24周。患者入选前5年内诊断IPF,FVC占预计值%≥50%,D L CO占预计值%≥30%,静息经皮血氧饱和度(SpO 2 )≥ 88%。主要研究终点是24周时FVC变化值、发生AE患者数。该研究尚在进行。
8. Fresolimumab
Fresolimumab( GC1008 )是重组人单克隆抗体,可抑制所有三种转化生长因子-β( TGF-β )的同工型,而TGF-β在IPF发病机理中起着核心作用。其中在这三类同工型中,TGF-β1与IPF的纤维化过程最相关。在肺部,TGF-β由多种细胞类型产生并以非活性形式分泌;TGF-β的进一步活化由多种因素介导,例如基质金属蛋白酶,整合素,它们可以裂解TGF-β前体复合物,激活TGF-β。TGF-β可以促进巨噬细胞和成纤维细胞的募集、激活和增殖并导致过多的ECM沉积和胶原蛋白生成。在这些细胞中TGF-β还刺激几种促炎性和纤维化细胞因子的表达。因此,TGF-β途径的下调被认为是中止纤维化过程的关键。
早在2005年,Fresolimumab就开展了I期临床研究( NCT00125385 ),旨在研究安全性,耐受性和在5个剂量组的IPF患者单次静脉输注中给予fresolimumab的药物动力学。这项研究已完成,但尚未见任何结果报道,而且自此后fresolimumab再未有任何研究跟进。
9. Carlumab
Carlumab( CNTO888 )是针对人CC趋化因子配体2( CCL2 )的重组单克隆抗体,CCL2也称为单核细胞趋化蛋白1( MCP-1 )。CCL2被证实参与了几种疾病的发病过程,其作用包括单核细胞,淋巴细胞和树突状细胞的募集和迁移;成纤维细胞募集到炎症部位;血管生成;成纤维细胞和肌成纤维细胞的胶原蛋白合成,从而导致纤维化。体内和体外的动物和人体研究表明,CCL2的水平与纤维化有关( IPF患者的支气管肺泡灌洗液中CCL2的水平升高 ),并且在IPF患者中存在CCL2高反应性的成纤维细胞。其他介质,例如IL-13和TGF-β也与CCL2途径相关;肺纤维化的小鼠模型显示这三个分子似乎可以相互调节纤维化活性。在肺成纤维细胞中,抑制CCL2会导致IL-13和TGF-β纤维化作用的降低。
在2015年,进行了一项II期临床研究,评估Carlumab在IPF患者中的疗效和安全性( NCT00786201 )。总共筛选了205例患者,并将126例患者随机分为4个剂量组( 安慰剂、1mg/Kg、5 mg/Kg和15mg/Kg carlumab ),每4周接受一次静脉输液,持续48周。在试验期间,风险收益分析显示了carlumab的不佳效果,因此导致提前终止研究。在任何的carlumab剂量组均未达到FVC的主要终点。接受carlumab治疗的患者实际上表现出比接受安慰剂的患者更加恶化的趋势( 1mg/kg -290mL; 5mg/Kg -370mL; 15mg/Kg -320mL;安慰剂-130ml )。
10. Simtuzumab
Simtuzumab是一种针对赖氨酰氧化酶Like-2( LOXL2 )的人类单克隆抗体,LOXL2是一类催化基质蛋白交联的酶。它们的生理作用在于帮助稳定ECM,促进1型胶原分子的交联,从而产生成纤维细胞可在其上生长的结构。基质蛋白交联的增加可能增强了IPF病理状态下的基质硬度。升高的LOXL2水平有助于肌成纤维细胞的分化和基质的产生,进一步推动了纤维化的进展。LOXL2在IPF肺的纤维化区域中高表达,并且血清水平也在IPF的肺中升高。因此,抑制LOXL2的作用可以中断纤维化的恶性循环,降低成纤维细胞的激活水平,降低生长因子的产生并且下调TGF-β。
在完成的一项II期临床研究中( NCT01769196 ),患者随机接受皮下注射Simtuzumab 125mg/mL每周一次和安慰剂长达254周。主要终点是无进展生存期,其时限为148周。Simtuzumab治疗在主要终点和次要终点( 包括预测的FVC和DLco下降百分比,步行6分钟的路程, SGRQ分数变化,以及全因死亡率和住院率 )均未达到,未能证明有效。
三、作用于免疫细胞药物
1.重组人穿透素2(human pentraxin-2,PRM-151):
PRM-151也称血清淀粉样蛋白P,可抑制单核细胞分化为促炎、促纤维化巨噬细胞和纤维细胞,减少促炎细胞因子分泌和白细胞聚集,与凋亡细胞结合加速其清除 [36,37] 。
一项研究PRM-151剂量递增治疗IPF安全性、耐受性、药物动力学特征的双盲、多中心Ⅰb期RCT于2011年开展 [37] 。研究共纳入21例IPF患者,随机分入3组,药物剂量分别为1、5、10 mg/kg,每组随机选择2例接受安慰剂治疗,最终3组分别纳入8、7和6例。患者在第1、3、5、8、15天接受PRM-151或安慰剂静脉注射,观察至57 d,接受肺功能检查、6 min步行距离、SGRQ、生物标志物评估 [37] 。主要研究终点是药物安全性和耐受性,次要研究终点包括药物血浆峰浓度、肺功能较基线变化等。患者FVC占预计值% ≥ 45%,D L CO占预计值%为35%~80%,静息SpO 2 ≥ 88%,试验前35天内使用环磷酰胺、类固醇、免疫抑制剂或任何试验药物排除。结果显示3组PRM-151血浆峰浓度分别是基线时2、5和8倍,未观察到输液反应、剂量限制毒性或SAE,未检测到PRM-151抗体。静脉注射PRM-151患者肺功能优于安慰剂组,随访第57天,两组FVC、FVC占预计值%、D L CO占预计值%较基线变化值分别为(0.064±0.142)L和(−0.063±0.116)L,(2.4±4.0)%和(−1.5±3.3)%,(−1.8±4.9)%和(−2.3±2.1)%,均无统计学差异 [37] 。安慰剂组血管内皮生长因子(VEGF)水平随时间升高,PRM-151治疗组VEGF水平稳定 [37] 。研究结果表明,PRM-151治疗IPF有良好的耐受性、有效性、药物动力学特征,需要开展定量HRCT评估PRM-151治疗后患者肺组织结构和肺功能变化的前瞻性RCT。
随后开展了研究PRM-151治疗IPF对FVC占预计值%影响的多中心Ⅱ期RCT [38] 。研究共纳入117例患者,FVC占预计值%为50%~90%,FEV 1 /FVC>0.70,D L CO占预计值%为25%~90%,6 min步行距离≥ 150 m,分入试验组(77例,10 mg/kg,1次/4周)和安慰剂组(39例)。主要终点是28周时FVC占预计值%最小二乘均值变化;次要研究终点是肺容量、定量HRCT评估肺组织结构和6 min步行距离变化。结果显示试验组可显著减缓FVC占预计值%及6 min步行距离下降(-2.5%和-4.8%, P =0.001;-0.5和-31.8 m, P <0.001),其他结果差异无统计学意义 [38] 。最常见不良反应为咳嗽、乏力和鼻咽炎 [38] 。研究结果表明,PRM-151可显著减缓IPF患者28周内肺功能下降,需要扩大样本量继续开展RCT评估其疗效和安全性。
2.哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂:
纤维细胞是循环性骨髓来源的前体细胞,可在肺部分化为肌成纤维细胞,促进肺纤维化,该过程依赖趋化因子CXCL12和纤维细胞表面受体CXCR4结合,CXCL12和CXCR4的表达可被mTOR特异性抑制剂西罗莫司抑制 [39] 。博来霉素诱导小鼠肺纤维化模型中,西罗莫司使外周血和肺内表达CXCR4的纤维细胞数量减少,肺纤维化程度减轻 [40] 。
GSK2126458是mTOR抑制剂,一项双盲、剂量递增Ⅰ期RCT于2013年开展,旨在研究其安全性、可耐受性和药物动力学特征 [41] 。研究共纳入17例患者,分为4个队列,每队列按3∶1分为试验组和对照组,各队列试验组分别给予GSK2126458剂量为0.25、1、2、2 mg,2次/d,持续7~10 d。患者明确诊断为IPF,FVC占预计值%>40%,D L CO占预计值%>30%,丙氨酸氨基转移酶<2倍正常值上限(ULN),碱性磷酸酶和胆红素≤1.5倍ULN。主要研究终点是各队列基线和治疗初期、中期及末期的血药浓度-时间曲线下面积(AUC)和药物动力学特征,次要研究终点为肺功能评估和药物安全性及耐受性 [41] 。该研究采用药物动力学模型和18氟-脱氧葡萄糖-正电子发射计算机断层显像(18F-FDG-PET/CT)结果。结果显示GSK2126458对mTOR有剂量依赖性和暴露依赖性抑制作用,还可降低IPF肺纤维化区域的葡萄糖信号异常 [41] 。结果支持进一步评估mTOR通路作为IPF新治疗的靶点。
一项双盲、安慰剂对照试验于2015年开展,预计2019年完成。入选患者明确诊断为IPF,随机分入西罗莫司组和安慰剂组。主要研究终点是22周时外周血中表达CXCR4的纤维细胞浓度和出现AE患者比例。该试验尚在进行中。
Lebrikizumab是人源性IL-13单克隆抗体。肺泡上皮细胞、间充质细胞和炎症细胞可释放细胞因子,包括GF、IL、IFN、TNF和趋化因子 [42] 。IL-13可促进成纤维细胞增殖和ECM形成,促进TGF-β、PDGF、CTGF释放,以及胶原蛋白和纤连蛋白合成,在IPF发病中发挥重要作用 [42,43] 。
针对Lebrikizumab单药或联合吡非尼酮治疗IPF有效性和安全性的双盲、多中心、平行设计Ⅱ期RCT,于2013至2017年开展。研究包括A、B队列,各队列分为试验组和对照组。A队列试验组给予Lebrikizumab(250 mg,皮内注射,1次/4周,持续52周),后在开放标签期内延长治疗52周,共计104周;对照组给予安慰剂52周,后在开放标签期内给予Lebrikizumab治疗52周,共104周。B队列试验组给予吡非尼酮联合Lebrikizumab,共52周,吡非尼酮剂量为2 403 mg/d或口服药物最大耐受剂量,Lebrikizumab剂量同A队列;对照组接受吡非尼酮和安慰剂治疗,共52周。4组分别纳入76、78、177、174例,共505例IPF患者,基线肺功能稳定,FVC占预计值%≥40%,D L CO占预计值%为25%~90%,6 min步行距离≥100 m。A队列患者分组前4周和安慰剂治疗时,未接受IPF治疗,B队列患者吡非尼酮MTD≤2 403 mg/d。主要研究终点是52周时FVC占预计值%下降率,次要研究终点包括52周时6 min步行距离和D L CO年下降率,122周内FVC占预计值%下降≥10%或任何原因死亡的患者比例等。结果显示,A队列两组间52周时FVC占预计值%下降率(-6.18%和-5.20%, P =0.45),6 min步行距离年下降率(-44.65%和-22.72%, P =0.31),D L CO年下降率(-4.78%和-4.24%, P =0.60),122周内FVC占预计值%下降≥10%或任何原因死亡的患者比例(34.2%和27.6%, P =0.42)无统计学差异。B队列两组间研究结果相似,无统计学差异(-6.04%和-5.54%, P =0.55;-25.56%和-46.98%, P =0.20;-5.75%和-5.57%, P =0.60;30.3%和26.6%, P =0.42)。研究结果表明,Lebrikizumab单药或联合吡非尼酮治疗不能延缓IPF肺功能进展或降低全因死亡率。
3.利妥昔单抗:
IPF患者血清和肺组织中存在B细胞异常,血浆B细胞刺激因子浓度明显高于正常对照组,且B细胞刺激因子浓度较高的IPF患者1年生存率较低 [44] ,考虑B细胞可能与IPF发病及预后相关。2018年12月开展的针对CD20B细胞单克隆抗体利妥昔单抗治疗IPF有效性的随机、多中心、平行设计Ⅱ期临床试验,纳入58例患者,年龄50~85岁,均明确诊断IPF。患者平均分入试验组(利妥昔单抗,1 mg,静脉注射2次,注射间隔14 d)和对照组并随访9个月。主要研究终点为人表皮样细胞-2抗体滴度,次要研究终点为抗热休克蛋白70抗体浓度变化、FVC占预计值%、急性加重发生率等。该研究仍在进行。
Rituximab( RTX )是针对CD20的单克隆抗体,其与CD20 +的B淋巴细胞结合,从而诱导细胞凋亡和抑制细胞增殖。间质性肺病( ILD )证实与免疫过度活动有关,有证据表明在抗合成酶综合征和系统性硬化相关的ILD患者中长期使用Rituximab,可以改善的肺功能。但另一方面,人们也担心Rituximab治疗本身甚至可能引起肺纤维化。
4. Dactrekumab
Dactrekumab( QAX576 )是抗IL-13的单克隆抗体,首先在一项多中心研究中探索Dactrekumab如何影响IPF患者的IL-13水平( NCT00532233 ),但是在招募了31名患者后,该研究因招募速度太慢而提前终止。进一步的一个小型的II期临床研究在2015年完成,旨在评估QAX576在快速进展的IPF患者中的安全性,耐受性,药代动力学和疗效( NCT01266135 )。它招募了40名患者参与,随机接受10mg/kg QAX576的每四周静脉注射。中期经过评估无效后,该研究终止。
5. Tralokinumab
Tralokinumab是人IgG4单克隆抗体,可中和IL-13并阻止与其受体的相互作用。临床前研究表明,在免疫缺陷小鼠模型中,ralokinumab可显着减少可量化的纤维化标记物( 例如壁增厚,气道血清CC16浓度和BAL caspase 3活性 )。这些数据表明,Tralokinumab可抑制IL-13信号通路引起的纤维化。
在一项开展的II期随机剂量范围研究中,评估了在176名IPF患者中使用tralokinumab的安全性和有效性( NCT01629667 )。实验组的患者被随机分配接受400或800毫克的tralokinumab,每4周静脉注射1次,持续68周。研究主要终点是第52周的从基线开始的预测强制肺活量(FVC)百分数变化,次要终点包括FVC的绝对变化, 6分钟步行距离变化,IPF恶化导致与呼吸有关的死亡率和住院率。这项研究报告了较高的退组率,在52周中期分析中,由于缺乏疗效而提前终止。
6. Lebrikizumab
Lebrikizumab是另一种结合可溶性IL-13的单克隆抗体。在一项随机的多中心双盲法,安慰剂对照,平行组研究中评估了lebrikizumab作为单一疗法( 即没有背景IPF治疗 )和与吡非尼酮联用治疗的安全性和有效性( NCT01872689 )。共有505名参与者纳入并分为两个队列:在队列A中,有154名IPF患者接受了lebrikizumab单独治疗,每4周一次皮下注射250mg,持续52周;B组,351名IPF患者使用吡非尼酮进行背景稳定治疗后,接受Lebrikizumab治疗,每4周一次皮下注射250mg,持续52周。主要终点是超过52周后的FVC百分比的年下降率。次要终点包括从随机分组到全因死亡的时间、一氧化碳扩散能力( DLco )预测百分比的年下降率,六分钟的步行距离( 6MWD ),以及IPF患者在“评估生活质量”中获得的总分( ATAQ-IPF )。队列A的结果在主要终点方面,治疗组和安慰剂组之间无显著性差异( 治疗组的FVC下降为-4.8%,而-安慰剂组为6.1%;p =0.356 )。同样,队列B也未达到主要终点( 治疗组FVC下降-5.4%,而安慰剂组下降-5.8%;p = 0.581 )。
7. Romilkimab
Romilkimab( SAR156597 )是IgG4抗体,可结合并中和循环中的IL-4和IL-13。最近,IIb期随机,双盲,安慰剂对照试验( NCT02345070 )的结果已经发表。该研究旨在评估SAR156597两种剂量水平的安全性和有效性。共有327名患者被随机分配接受每周皮下注射200毫克SAR156597,每2周一次皮下注射200毫克SAR156597,和安慰剂。主要终点是52周时相对于基线的FVC百分比变化,次要终点是52周时的疾病进展和全因死亡率。两个剂量组与安慰剂相比,在任何主要或次要终点均无显著性差异。
8. VAY-736
VAY-736是B细胞活化因子受体( BAFF-R )的人源化单克隆抗体拮抗剂,皮下给药。有大量证据表明IPF患者常见宿主免疫反应异常,发现肺实质中异常的B细胞聚集,并且伴有血液中BAFF-R浓度的升高。在IPF患者中也发现了高CXCL13水平( 一种B细胞标志物,与移动到炎症部位有关 )的这种情况,这些证据都支持了在IPF的病理过程中B细胞起着重要的作用。动物模型显示博莱霉素诱导的鼠肺纤维化中,BAFF水平在支气管肺泡灌洗液( BAL )和肺实质中均有显著升高。
一些临床试验主要集中于BAFF-R特异性单克隆抗体在自身免疫性肝炎,多发性硬化症,寻常型天疱疮,干燥综合征,系统性狼疮红斑的治疗。VAY-736目前正在开展一项在IPF患者中的II期三盲,随机,安慰剂对照的研究( NCT03287414 ),第48周预测FVC百分比的变化作为主要终点。有趣的是,这项研究正在选择性地招募那些认为对实验疗法更可能有反应的患者,如1)在筛选以下至少一种自身抗体时血清反应阳性:类风湿因子,ANA,抗dsDNA,抗CCP,Scl-70,SSA( 抗Ro ),SSB( 抗La ),抗RNP,抗-Smith,Jo-1,PL-7,PL-12,EJ,OJ,SRP,Ku,Mi-2,抗PM / Scl; 或2)通过筛查胸部的高分辨率CT扫描,发现肺门/纵隔淋巴结病( 短轴直径> 1cm )者。
四、作用于肺泡上皮细胞药物
1.人源性整合素αvβ6单克隆抗体[STX-100(BG00011)]:
整合素是α、β亚基非共价配对形成的跨膜受体,在肌成纤维细胞表面表达,参与细胞和ECM间信号通路,控制TGF-β激活和释放,在IPF发病过程中有重要作用 [45] 。
一项评估BG00011治疗IPF安全性和耐受性的双盲、平行设计Ⅱa期RCT在美国开展。研究纳入41例IPF患者,分入试验组(BG00011,皮内注射,每周1次,连续8周,剂量逐渐增加)和对照组 [46] 。患者FVC占预计值%≥50%,D L CO占预计值%≥30%、静息时未吸氧或氧流量≤2 L/min时SpO 2 >90%、残气量(RV)占预计值%≤50%。主要研究终点是16周时出现急性加重的患者比例,次要研究终点是16周时外周血和BALF中生物标志物变化、BG00011抗体是否产生、药物血浆峰浓度等。结果显示试验组TGF-β传导通路中pSMAD2水平被抑制70%。BG00011≥0.3 mg/kg时可显著抑制pSMAD2,1 mg/kg时达最大抑制。试验组和对照组急性加重发生率分别为87%和70%。
另一项双盲Ⅱb期RCT在2018年开展。研究预计纳入290例IPF患者,分入试验组(BG00011,皮内注射,56 mg/周,持续52周)和对照组 [47] 。患者D L CO占预计值%为30%~79%,FVC占预计值%≥50%,服用尼达尼布或吡非尼酮需在分组前8周内剂量恒定。主要研究终点是52周时FVC下降率,次要研究终点是FVC占预计值%下降率,出现疾病进展和首次AE的时间等。该研究尚在进行。
2.Tipelukast(MN-001):
花生四烯酸代谢产物白三烯(LTs)是肺纤维化的调节因子之一 [48] 。由IPF患者肺泡上皮细胞产生,患者肺组织中LTB4水平显著地升高 [49] ,提示其可能为IPF的潜在治疗靶点。
一项评估LTB4抑制剂MN-001治疗IPF安全性和耐受性的双盲、平行设计Ⅱ期RCT于2016年开展 [50] 。研究纳入15例IPF患者,以2∶1分入试验组(MN-001,口服,750 mg,2次/d,持续26周)和对照组,后全部患者进入开放标签延长期(MN-001,口服,750 mg,2次/d,持续26周)评估药物有效性。入选IPF患者年龄介于21~80岁,疾病表现中至重度,GAP指数Ⅱ~Ⅲ期,服用尼达尼布者在入组前3个月内药物剂量稳定。主要研究终点是26周时FVC变化,次要研究终点是第1、3、6个月评估每例患者发生急性加重数,26周时6 min步行距离下降率、呼吸困难评分变化值等。该研究尚在进行。
五、小结
在过去的十年中,在nintedanib和pirfenidone获得了批准应用于IPF患者的同时,十几种具有不同分子靶标的单克隆抗体也在IPF中进行着艰苦的探索。但迄今为止完成的许多临床实验的结果都令人失望,例如针对v6整合素和LOXL2的抗体,被认为在纤维化过程中起着至关重要的作用;经典的抗炎途径IL-13和IL-4阻断剂可能代表了研究最广泛的领域,但始终如一的阴性试验结果可能标志着其在IPF治疗策略的结束。在另一方面,有关抗CTGF抗体pamrevlumab的2期研究最新的令人信服的结果,激发了为IPF患者寻找新的有效疗法的希望。虽然这项研究比较了针对安慰剂的单一疗法中的实验药物,但其他近期和正在进行的RCT均使患者能够接受背景抗纤维化治疗。出于道德和实践原因,IPF中放弃真正的安慰剂组可能是必需的,但对RCT的设计也构成了重大挑战。一个增强试验有效性的策略是纳入对治疗反应的指标,迄今为止,只有很少的IPF研究进行了这种尝试( 例如lebrikizumab和VAY-736 )。未来,需要更多可靠、可预测的生物标志物的证据,以建立成功RCT的基础,并最终提供个性化的治疗选择。


